Anticuerpos monoclonales anti-Chikungunya y usos de los mismos.
Un anticuerpo monoclonal que se fija específicamente al virus CHIK entero,
en donde el anticuerpo monoclonal se fija específicamente a un epítopo de la proteína CHIK E2 localizado en la superficie exterior de un virus CHIK y se selecciona del grupo depositado en la CNCM (Colección Nacional de Cultivos de Microorganismos) 28 rue du Docteur Ros, 75724 Paris Cedex 15, en fecha 6 de septiembre de 2007 bajo los números de acceso I-3824 (3E4), e I-3823 (8A4).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2008/003092.
Solicitante: INSTITUT PASTEUR.
Nacionalidad solicitante: Francia.
Dirección: 28 rue du Docteur Roux 75015 Paris FRANCIA.
Inventor/es: DESPRES, PHILIPPE, BREHIN,ANNE-CLAIRE, SALL,AMADOU ALPHA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K16/10 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › de virus ARN.
- G01N33/569 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para microorganismos, p. ej. protozoarios, bacterias, virus.
PDF original: ES-2550997_T3.pdf


Fragmento de la descripción:
Anticuerpos monoclonales anti-Chikungunya y usos de losmismos
Campo de la invención La presente invención se refiere al campo de la arbovirosis causada por el virus Chikungunya (CHIK) . La presente invención concierne específicamente a anticuerpos monoclonales (MAbs) anti-CHIK, y más específicamente MAbs anti-CHIK.E2 y su uso como productos de diagnóstico en métodos para detección de la presencia o ausencia de una cepa de CHIK.
Antecedentes de la invención El virus Chikungunya (CHIK) tiene la capacidad de causar epidemias explosivas en África, India, y el Sudeste de Asia (Epstein, 2007; revisado por Powers y Logue, 2007) . El virus es transmitido por mosquitos del género Aedes (Ae.) . El virus CHIK ha sido responsable de epidemias de magnitud sin precedentes en la isla La Reunión y el Océano Indico desde 2005, y en India, en donde una cifra estimada de 1, 4 millones de habitantes se han infectado en 2006 (Schuffenecker et al., 2006; Staikowsky et al., 2006; Arankalle et al., 2007; revisado por Pialoux et al., 2007) .
Los humanos infectados con el virus CHIK experimentan típicamente enfermedad aguda con poliartralgia incapacitante, dolor muscularsevero yrigidezen lasarticulacionesseguidaavecesporuna erupciónmaculopapular (Johnston y Peters, 1996;Borgherin et al., 2007; revisado por Pialoux et al., 2007; Rulli et al., 2007) . La infección del virus CHIK está asociada en casi todos los casos con mialgias. La infección del virus CHIK de las células satélites en el interior de los músculos podría explicar, en parte, algunas características de las manifestaciones clínicas (Ozden et al., 2007) . Los síntomas clínicos de la infección de virus Chikungunya son a menudo diagnosticados erróneamente para enfermedades arbovirales debido a otros alphavirus artritogénicos tales como elvirus Igbo-Ora de África Occidental, el virus O'nyong-nyong (ONN) de África Central, los virus Ross River y Barma de Australia y el virusPacíficoMayaro de América del Sur, así como el virus Sindbis (SIN) cosmopolita.
El virus CHIK es un miembro del género alphavirus y la familia Togaviridae (revisado por Strauss y Strauss, 1994) . Los alphavirus son pequeños virus de RNA positivos monocatenarios envueltos que exhiben un gran tropismo celular. Las superficies virales están cubiertas de picos anclados a la membrana compuestos de tripletes de heterodímeros de las glicoproteínas E1 y E2 de la envoltura. Las proteínas del pico viral facilitan la fijación a las superficies celulares y la entrada del virus. La glicoproteína E1 de la envoltura es una proteína de fusión de clase II que media la fusión membranal activada a pH bajo durante la infección del virus. E2 es una glicoproteína transmembranal de tipo I de 50 kDa: los primeros 260 aminoácidos constituyen el ectodominio, seguido por aproximadamente 100 aminoácidos que forman la región del vástago, una región que abarca 30 aminoácidos, y un endodominio citoplásmico corto de 30 aminoácidos (Pletnev et al., 2001; Mukhopadhyay et al., 2006) . pE2 (el precursor de 62 kDa para las proteínas E3 y E2) y E1 están ensamblados como heterodímeros en el retículo endoplásmico (revisado por Strauss y Strauss, 1994) . Después de la escisión de pE2 en el aparato de Golgi para formar E3 y E2, los complejos E1-E2 son transportados a la membrana plasmática (PM) . La interacción del ectodominio citoplásmico E2 con la nucleocápsida preensamblada es uno de los pasos iniciales en el proceso de la envoltura delvirus en laPM.La integridad delvirion semantieneporinteraccionesdirectasentreE1 yE2 (Strauss y Strauss, 1994) . Durante el curso del ciclo vital del alphavirus, la glicoproteína E2 es responsable de la fijación del receptor. La mayoría de los anticuerpos neutralizantes reconocen epítopos en E2 más bien que en E1 (revisado por Strauss y Strauss, 1994) . Los anticuerpos que reconocen epítopos conformacionales en la superficie exterior de E2 tienen potencial para neutralizar la infección de alphavirus.
La diagnosis biológica de la infección de virus CHIK está basada esencialmente en un método cuantitativo en tiempo real basado en RT-PCR durante la fase virémica inicial (Edwards et al., 2007; Laurent et al., 2007; Santhosh et al., 2007) . Los métodos serológicos detectan tempranamente IgM anti-CHIK después de las primeras manifestaciones clínicas e IgG específica después de 2 semanas (revisado por Pialoux et al., 2007) . Sin embargo, los ensayos ELISA y de inmunodetección son escasamente específicos y sensibles debido a la reactividad cruzada del virus CHIK con miembros afines del complejo antigénico del Bosque de Semliki (SF) (Greiser-Wilke et al., 1991) .
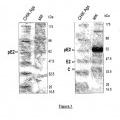
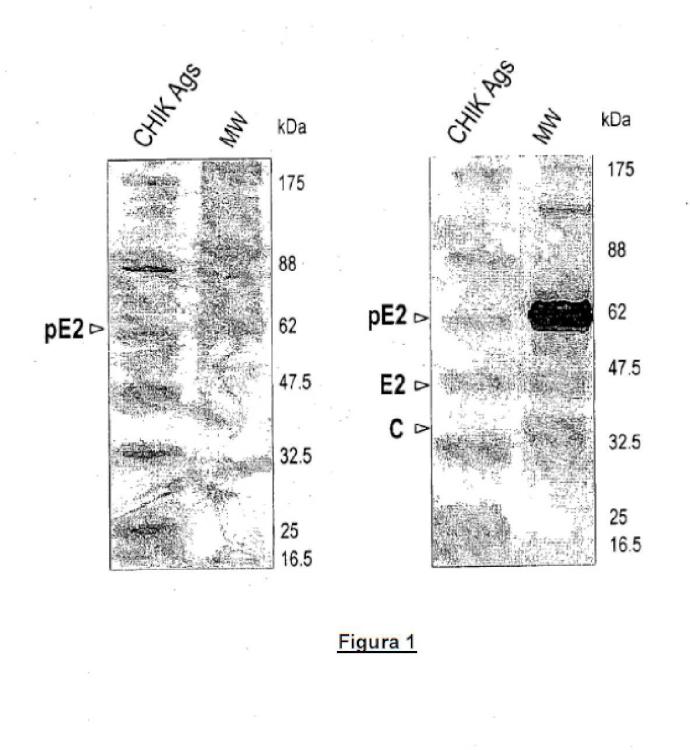
Breve descripción de las figuras Figura 1: Composición de la proteína CHIK y especificidad antigénica de la preparación viral. Antígenos CHIK (CHIK Ags) se separaron por 4-12% SDS-PAGE en condiciones desnaturalizantes y se visualizaron directamente por tinción con Azul Coomassie (izquierda) o se sometieron a electrotransferencia sobre una membrana de PVDF para análisis de inmunotransferencia utilizando anti-CHIK HMAF (derecha) . Las posiciones de los marcadores de peso molecular (MW) se indican en kDa.
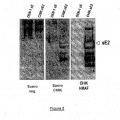
Figura 2: Antigenicidad de la glicoproteína CHIK sE2 recombinante soluble. Se realizó el análisis de imunotransferencia con la proteína CHIK.sE2 recombinante soluble purificada y DEN-1 sE anti-CHIK HMAF (CHIK HMAF) , suero humano normal (suero neg.) , y suero de paciente CHIK-positivo (suero CHIK pos.) .
Figura 3: Ensayos de clasificación cinética en sobrenadantes de hibridoma productores de anticuerpos. Las curvas muestran la fijación monitorizada en unidades de resonancia (RU) de la proteína 50 mM CHIK.sE2 en sobrenadantes de hibridoma productores de anticuerpos 3C3, 3E4, 5A8, 6F2, 8A4, y 9B5 a lo largo del tiempo.
Figura 4: Sensibilidad de detección de E2 utilizando MAbs anti-CHIK.E2. Se utilizó el virus CHIK purificado con sacarosa para recubrir las placas ELISA a 105 FFU/pocillo y se añadieron concentraciones crecientes de MAbs 3C3 (▲) , 3E4 (○) , y 8A4 (■) . La reactividad de MAbs se ensayó por ELISA indirecto como se describe en Métodos.
Figura 5: Reactividad de MAbs anti-CHIK.E2 con E2 sintetizado endógenamente en células infectadas. Se infectaron células Vero 24 horas con virus CHIK.06-49 a 0, 4 MOI. En (A) , detección de E2 por ensayo IF utilizando MAbs anti-CHIK.E2. Las células fijadas se permeabilizaron (+TX-100) o no se permeabilizaron (-TX-100) y se sometieron luego a inmunotinción con 2, 5 μg.mL-1 MAb 3C3, 3E4, o 8A4. Se utilizó como control anti-CHIK HMAF (dilución 1:500) . En (B) , análisis de citometría de flujo de células infectadas con el virus CHIK utilizando MAbs anti-CHIK.E2. Las células infectadas fijadas (línea continua) o células falsamente infectadas (línea de puntos) se permeabilizaron con saponina (línea negra) o no se permeabilizaron (línea gris) y se sometieron luego a inmunotinción con 2, 5 μg.mL-1 de MAb 3C3, 3E4, o 8A4. Como control positivo se utilizó anti-CHIK HMAF (dilución 1:500) .
Figura 6: Se determinó la reactividad de MAbs anti-CHIK.E2 para las proteínas E2 reducidas por análisis de inmunotransferencia. Las membranas se transfirieron con 100 ng de proteína CHIK.sE2 purificada (pista 1) o 105 FFU de virusCHIKpurificadoconsacarosa (pista2) yseincubaronindividualmenteconMAb 3C3, 3E4, u 8A4 como se describe en Métodos. Como control positivo se utilizó anti-CHIK HMAF.
Figura 7: Alineación de secuencias E2 de CHIK (SEQ ID NO: 1) , Igbo-Ora (SEQ ID NO: 2) y virus ONN (SEQ ID NO: 3) , mostrando la región de los residuos E2-1 a E2-364. Los sitios de glicosilación enlazados a asparagina están marcados con (♦) . Los marcos abiertos indican las tres diferencias específicas de los aminoácidos en el virus ONN en comparación con los virus CHIK e Igbo-Ora.
Figura 8: Sensibilidad de ELISA de captura de antígeno utilizando MAbs anti-CHIK E2. Se realizó un análisis cuantitativo utilizando MAb 8A4 como anticuerpo de captura y MAb 3E4 como anticuerpo de detección y sobrenadantes de cultivo de virus (A) y glicoproteína recombinante soluble CHIK.sE2 como antígeno viral (B) . En (A) , virus CHIK.06-49diluidoenserie desarrollado encélulasdemosquito AP61 (●) o células humanas 293A (□) . En (B) concentraciones crecientes de proteína recombinante soluble CHIK.sE2 purificada.
Breve descripción de la invención Los inventores han desarrollado y caracterizado anticuerpos monoclonales (MAbs) que encuentran una ventaja particular en el estudio de la biología del virus CHIK y la patogénesis de la enfermedad relacionada con CHIK.
Como puede apreciar un experto en la técnica, la originalidad de la presente invención reside en el hecho de que los inventores... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo monoclonal que se fija específicamente al virus CHIK entero, en donde el anticuerpo monoclonal se fija específicamente a un epítopo de la proteína CHIK E2 localizado en la superficie exterior de un virus CHIK y se selecciona del grupo depositado en la CNCM (Colección Nacional de Cultivos de Microorganismos) 28 rue du Docteur Ros, 75724 Paris Cedex 15, en fecha 6 de septiembre de 2007 bajo los números de acceso I-3824 (3E4) , e I-3823 (8A4) .
2. Un kit para detectar la presencia o ausencia de una cepa del virus Chikungunya (CHIK) o de un virus Igbo10 Oraen una muestra, que comprende almenos un anticuerpo monoclonal conforme a la reivindicación 1.
3. Uso de un anticuerpo monoclonal conforme a la reivindicación 1 o una combinación de los mismos como reactivo de diagnosis in vitro.
Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Ensayo de toxina botulínica con sensibilidad mejorada, del 1 de Julio de 2020, de BioMadison, Inc: Un método para aumentar la sensibilidad de la detección basada en células de una toxina botulínica, que comprende: (i) proporcionar una célula […]
Bebidas energéticas y otras ayudas nutricionales derivadas de licores a base de agave, del 1 de Julio de 2020, de Roar Holding, LLC: Una composición que comprende compuestos inhibidores de monoamino oxidasa (MAO), cuya composición se prepara mediante la eliminación de etanol de una bebida […]
Evaluación asistida del pronóstico en la enfermedad inflamatoria, del 24 de Junio de 2020, de KINGS COLLEGE LONDON: Un método in vitro de recopilación de información útil para predecir el resultado clínico en un sujeto, en donde el sujeto tiene o se sospecha que tiene una enfermedad […]
Vacunas y diagnóstico de torque teno virus porcino, del 18 de Junio de 2020, de VIRGINIA TECH INTELLECTUAL PROPERTIES, INC.: Composición inmunogénica que comprende una proteína según SEQ ID NO. 16.
Marcadores celulares para el diagnóstico de la enfermedad de Alzheimer y para la progresión de la enfermedad de Alzheimer, del 17 de Junio de 2020, de YEDA RESEARCH AND DEVELOPMENT CO. LTD.: Un método para el diagnóstico de la probabilidad de la enfermedad de Alzheimer (EA) en un individuo examinado, que comprende: (i) medir los […]
Biomarcadores de TB, del 22 de Abril de 2020, de United Kingdom Research and Innovation: Un método para el diagnóstico de TB en un sujeto, comprendiendo el método: (a) proporcionar una muestra de dicho sujeto, siendo dicha muestra seleccionada […]
Procedimiento para detectar bacterias coliformes contenidas en la leche, del 15 de Abril de 2020, de ASAHI KASEI KABUSHIKI KAISHA: Procedimiento para lisar bacterias coliformes contenidas en la leche, que comprende la etapa de mezclar un agente de lisis que contiene lisozima, un surfactante aniónico […]