ANTICUERPOS CONTRA INTERLEUCINA-22 Y USOS PARA ELLOS.
Un anticuerpo aislado o fragmento de unión a antígeno del mismo que se unen específicamente a interleucina-2 (IL-2) e inhiben competitivamente la unión de un segundo anticuerpo a dicha IL-2,
siendo dicho segundo anticuerpo un anticuerpo monoclonal producido por un hibridoma elegido entre PTA-254 y PTA-255
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/020833.
Solicitante: GENETICS INSTITUTE, LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 87 CAMBRIDGE PARK DRIVE CAMBRIDGE, MA 02140 ESTADOS UNIDOS DE AMERICA.
Inventor/es: TOMKINSON,KATHLEEN N, FOUSER,LYNETTE, PITTMAN,DEBRA,D, LI,Jing , TAN,Xiang-Yang , VELDAN,Geertruida M.
Fecha de Publicación: .
Fecha Solicitud PCT: 22 de Junio de 2004.
Clasificación Internacional de Patentes:
- C07K16/24F
Clasificación PCT:
- C07K16/24 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra citoquinas, linfoquinas o interferones.
Clasificación antigua:
- C07K16/24 C07K 16/00 […] › contra citoquinas, linfoquinas o interferones.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
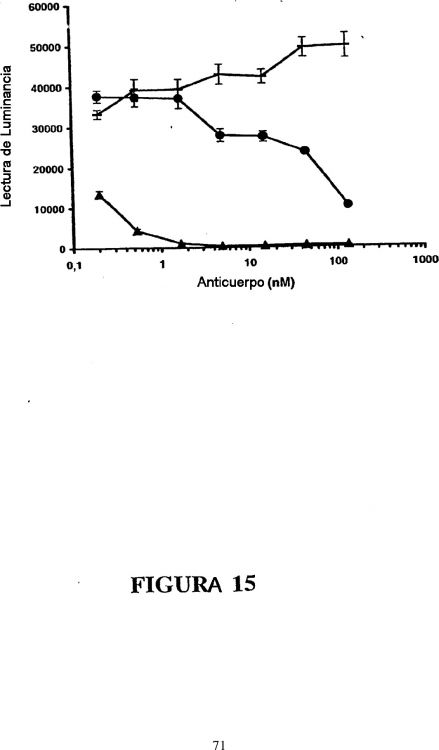
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
Esta invención se refiere a anticuerpos y a fragmentos de unión a antígenos de los mismos que unen interleucina–22 (IL–22), en particular, IL–22 humana, y sus usos en regular actividades asociadas con IL–22. Los anticuerpos descritos en el presente documento son útiles en diagnosticar, evitar, y/o tratar trastornos asociados a IL–22, por 5 ejemplo, trastornos autoinmunes (por ejemplo, artritis).
ANTECEDENTES DE LA INVENCIÓN
La interleucina–22 (IL–22) es una citocina de clase II que muestra homología de secuencia con IL–10. Su expresión está regulada por incremento en linfocitos T por IL–9 o por ConA (Dumoutier L. y col. (2000) Proc Natl Acad Sci EE.UU. 97 (18): 10144–9). Estudios adicionales han mostrado que la expresión de ARNm de IL–22 ARNm se induce 10 en vivo en respuesta a administración de LPS y que IL–22 modula parámetros indicadores de una respuesta de fase aguda (Dumoutier L. y col. (2000) supra; Pittman D. y col. (2001) Genes and 15 Immunity 2: 172). Tomadas conjuntamente, estas observaciones sugieren que IL–22 juega un papel en inflamación (Kotenko S.V. (2002) Cytokine & Growth Factor Reviews 13 (3): 223–40).
Se cree que IL–22 se une a un complejo receptor constituido por IL–22R e IL–10R2, dos miembros de la familia de 15 receptores de citocinas de tipo II (CRF2) (Xie M.H. y col. (2000) J Biol Chem 275(40): 31335–9; Kotenko S.V. y col. (2001) J Biol Chem 276 (4): 2725–32). Ambas cadenas del receptor de IL–22 se expresan constitutivamente en un número de órganos. Las líneas celulares epiteliales derivadas de estos órganos son responsables de IL–22 in vitro (Kotenko S.V. (2002) Cytokine & Growth Factor Reviews 13 (3): 223–40). IL–22 induce activación de las rutas de JAK/STAT3 y de ERK, así como intermedios de otras rutas de MAPK (Dumoutier L., y col. (2000) supra; Pittman D. y 20 col. (2000) supra; Pittman D. y col. (2000) J Biol Chem 164(4): 1814–9; Kotenko S.V. y col. (2001) J Biol Chem 276 (4): 2725–32; Kotenko S.V. y col. (2002) J Biol Chem 277(37): 33676–82).
Los miembros de CRF2 son receptores para IFNα/β, IFNγ, factor de coagulación VIla, IL–10 y las proteínas relacionadas con IL–10 IL–19, IL–20, IL–22, IL–24, así como las citocinas similares a IFN identificadas recientemente, IL–28 e IL–29 (Kotenko S.V. (2002) Cytokine & Growth Factor Reviews 13 (3): 223–40; Kotenko, S.V. y col. (2000) 25 Oncogence 19 (21): 2557–65; Sheppard, P. y col. (2003) J Biol Chem 4 (1): 63–8; Kotenko S.V. y col. (2003) Nature Immunology 4 (1): 69–77). Además de estos receptores de membrana, la familia CRF2 incluye también una proteína soluble, proteína de unión a IL–22 (IL–22BP), que es específica para IL–22 y bloquea su actividad (Dumoutier, L. y col. (2001) J Biol Chem 166 (12): 7090–5; Kotenko S.V. y col. (2001) J Biol Chem 166 (12): 7096–103; Kotenko S.V. y col. (2001) Proc Natl Acad Sci USA 98 (17): 9511–6; Gruenberg, B.H. y col. (2001) Genes & Immunity 2 (6):329–34; 30 Wei C–C y col. (2003) Genes & Immunity 4: 204–211). Aunque el complejo receptor de IL–22 es único para IL–22, sin embargo, cada cadena (es decir, IL–22R y IL–10R2) está compartida por otros miembros de CRF2 definiendo receptores funcionales para IL–20, IL–24 (IL–22R/IL–20R2), IL28, IL29 (IFN–λR1/IL–10R2) y IL–10 (IL–10R1/IL–10R2) (Dumoutier, L. y col. (2001) J. Immunol. 167 (7): 3545–9; Wang, M. y col. (2002) J Biol Chem 277 (9): 7341–7; Parrish–Novak, J. y col. (2002) J Biol Chem 277 (49): 47517–23; Kotenko S.V. y col. (1997) EMBO J. 16 (19): 5894–35 903; Spencer, S.D. y col. (1998) J Exp Med 187 (4): 571–8).
Ambas cadenas del receptor compuesto de CRF2 son necesarias para transducción de señales. Una cadena del receptor compuesto se ha definido históricamente como una cadena de unión a ligando (por ejemplo, IFNγR1) en base a su alta afinidad por la citocina. La otra cadena (por ejemplo, IFNγR2) se ha caracterizado como una cadena ayudante o accesoria y muestra afinidad mínima por la citocina sola (Kotenko, S.V. y col. (2000) Oncogene 19 (21): 40 2557–65). Resultados más recientes sugieren que ambas cadenas receptoras pueden contribuir a la afinidad de unión, al menos por IL–10 e IL–22 (Xie M.H. y col. (2000) J Biol Chem 275 (40): 31335–9; Kotenko S.V. y col. (2001) J Biol Chem 276 (4): 2725–32; Kotenko S.V. y col. (2002) J Interferon Cytokine Res 22 (11): 1099–112).
SUMARIO DE LA INVENCIÓN
La presente solicitud proporciona, al menos en parte, agentes de unión a IL22 tales como anticuerpos y fragmentos 45 de unión a antígenos de los mismos que se unen a interleucina–22 ("IL–22"), en particular, IL–22 humana, con alta afinidad y especificidad. Los anticuerpos y fragmentos de unión a antígenos de los mismos de la presente invención se refieren también en el presente documento como "anticuerpos anti–IL22" y "fragmentos de los mismos," respectivamente. En una realización, el anticuerpo anti–IL22 o fragmento del mismo es un antagonista de IL–22, y así reduce, neutraliza, y/o antagoniza al menos una actividad asociada a IL–22. Por ejemplo, el anticuerpo anti–IL22 o 50 fragmento del mismo puede unirse a IL–22, por ejemplo, a un epítopo de IL–22 e interferir con una interacción, por ejemplo, unión, entre IL–22 y un complejo receptor de IL–22, por ejemplo, un complejo que comprende receptor de IL–22 ("IL–22R") y receptor 2 de interleucina–10 ("IL–10R2"), o una subunidad del mismo (por ejemplo, IL–22R o IL–10R2, individualmente). Así, los anticuerpos y fragmentos de los mismos de la invención se pueden usar para
interferir con (por ejemplo, inhibir, bloquear, o reducir de otra manera) una interacción, por ejemplo, unión, entre IL–22 y un complejo receptor de IL–22, o una subunidad del mismo.
Además, los solicitantes han mostrado que la administración de IL–22 en vivo induce parámetros de una respuesta de fase aguda y que una reducción de actividad de IL–22 usando un anticuerpo anti–IL–22 neutralizante mejora síntomas inflamatorios en un modelo de artritis inducida por colágeno (CIA) de ratón. La expresión de ARNm de IL–5 22 está regulada por incremento en áreas inflamadas. Así, los antagonistas de IL–22, por ejemplo, anticuerpos anti–IL–22 neutralizantes y fragmentos de los mismos, se pueden usar para inducir inmunosupresión en vivo. De acuerdo con ello, los anticuerpos anti–IL22 o fragmentos de los mismos de la invención son útiles en diagnosticar, tratar y/o evitar trastornos asociados a IL–22, por ejemplo, trastornos autoinmunes (por ejemplo, esclerosis múltiple, trastornos artríticos tales como artritis reumatoide); trastornos respiratorios (por ejemplo, asma, enfermedad pulmonar 10 obstructiva crónica (COPD)); afecciones inflamatorias de, por ejemplo, la piel (por ejemplo, soriasis), el sistema cardiovascular (por ejemplo, aterosclerosis), el sistema nervioso (por ejemplo, enfermedad de Alzheimer), los riñones (por ejemplo., nefritis), el hígado (por ejemplo, hepatitis) y el páncreas (por ejemplo, pancreatitis).
De acuerdo con ello, en un aspecto, la invención presenta un anticuerpo aislado o un fragmento de unión a antígenos del mismo, que interacciona con, por ejemplo, se une a, IL–22, en particular, a IL–22 de mamíferos, por 15 ejemplo, a IL–22 humana o murina. En una realización, al anticuerpo o fragmento del mismo es un anticuerpo neutralizante, por ejemplo, reduce o inhibe una o más actividades asociadas a IL–22, por ejemplo, secreción de quimiocinas (por ejemplo, secreción de GRO1); una respuesta de fase aguda, fosforilación de una quinasa, por ejemplo, proteína STAT (por ejemplo, proteína STAT–3), proliferación celular (por ejemplo, proliferación y/o fosforilación de HEPG2), entre otras. Los anticuerpos anti–IL–22 o fragmentos de los mismos se pueden unir a IL–22 20 con alta afinidad, por ejemplo, con una constante de afinidad (Kd) de menos de 10E–7 M, preferentemente 10E–8, 10E–9, 10E–10, más preferentemente, 10E–11 o afinidad...
Reivindicaciones:
1. Un anticuerpo aislado o fragmento de unión a antígeno del mismo que se unen específicamente a interleucina–22 (IL–22) e inhiben competitivamente la unión de un segundo anticuerpo a dicha IL–22, siendo dicho segundo anticuerpo un anticuerpo monoclonal producido por un hibridoma elegido entre PTA–5254 y PTA–5255.
2. El anticuerpo o fragmento del mismo de la reivindicación 1, que tiene una constante de afinidad (Kd) de 10E9 o 5 una afinidad más alta.
3. El anticuerpo o fragmento del mismo de la reivindicación 1, que neutraliza la fosforilación de STAT en HEPG2 o la proliferación de linfocitos BaF3 con una DE50 en el intervalo de aproximadamente 5 nM a 200 pM o más alto.
4. El anticuerpo o fragmento del mismo de la reivindicación 1, que se asocia con IL22 con cinéticas en el intervalo de aproximadamente 10E4 a 10E6 1/Ms y que tiene cinéticas de disociación en el intervalo de aproximadamente 10E3 a 10 10E6 1/s.
5. El anticuerpo o fragmento del mismo de la reivindicación 1, en el que la IL–22 comprende una secuencia de aminoácidos que es al menos el 90% idéntica a los aminoácidos 34–179 de la SEC ID N.º: 2 y es capaz de inducir la fosforilación de una proteína Stat–3.
6. El anticuerpo o fragmento del mismo de la reivindicación 2, en el que la IL–22 comprende los aminoácidos 34–179 15 de el SEC ID N.º: 2.
7. El anticuerpo o fragmento del mismo de la reivindicación 1, en el que la IL–22 es de origen humano.
8. El anticuerpo o fragmento del mismo de la reivindicación 1, que es un anticuerpo humanizado, injertado con CDR o humano.
9. Un anticuerpo monoclonal producido por un hibridoma elegido entre PTA–5254 y PTA–5255. 20
10. Una composición farmacéutica que comprende el anticuerpo o fragmento del mismo de la reivindicación 1.
11. La composición farmacéutica de la reivindicación 10, que comprende adicionalmente otro agente terapéutico seleccionado del grupo constituido por un inhibidor de citocinas, un inhibidor de factor de crecimiento, un inmunosupresor, un agente antiinflamatorio, un inhibidor metabólico, un inhibidor de enzimas, un agente citotóxico y un agente citostático. 25
12. La composición farmacéutica de la reivindicación 11, en la que el agente terapéutico está seleccionado del grupo constituido por un antagonista de TNF, un antagonista de IL–12, un antagonista de IL–15, un antagonista de IL–17, un antagonista de IL–18, un antagonista de IL–21R, un agente que reduce las linfocitos T, un agente que reduce las linfocitos B, metotrexato, Ieflunomida, sirolimus (rapamicina) o un análogo de los mismos, un inhibidor de Cox–2, un inhibidor de cPLA2, un NSAID y un inhibidor de p38. 30
13. Uso de un anticuerpo o fragmento del mismo de la reivindicación 1 en la elaboración de un medicamento para tratar o evitar un trastorno asociado con IL22 en un sujeto.
14. Uso de un anticuerpo o fragmento del mismo de la reivindicación 1 en la elaboración de un medicamento para tratar o evitar una respuesta de fase aguda en un sujeto.
15. El uso de la reivindicación 13, en la que el trastorno asociado a IL22 está seleccionado del grupo constituido por 35 un trastorno autoinmune, un trastorno respiratorio y una afección inflamatoria.
16. El uso de la reivindicación 13, en el que el trastorno asociado a IL22 está seleccionado del grupo constituido por artritis reumatoide, osteoartritis, esclerosis múltiple, miastenia gravis, enfermedad de Crohn, enfermedad inflamatoria del intestino, lupus, diabetes, soriasis, asma, enfermedad pulmonar obstructiva crónica (COPD), inflamación cardiovascular, pancreatitis, hepatitis y nefritis. 40
17. El uso de la reivindicación 13 o de la reivindicación 14, en el que el sujeto es un mamífero.
18. El procedimiento de la reivindicación 17, en el que el mamífero es un ser humano.
19. El anticuerpo o fragmento del mismo de la reivindicación 1 para usar en terapia.
Patentes similares o relacionadas:
ANTICUERPOS MONOCLONALES HUMANOS CONTRA INTERLEUCINA 8 (IL-8), del 10 de Febrero de 2012, de GENMAB A/S: Un anticuerpo monoclonal humano aislado que se une a IL-8 humana que comprende las seis secuencias de CDR VLCDR1 de SEC ID Nº: 16, VLCDR2 […]
ANTICUERPOS ANTAGONISTAS DE IL-17, del 3 de Noviembre de 2011, de NOVARTIS AG: Un anticuerpo de unión a IL-17 o fragmento del mismo que comprende los dominios variables de cadena ligera (VL) y de cadena pesada (VH); dicha molécula de unión IL-17 […]
MOLÉCULAS DE ANTICUERPO HUMANAS PARA IL-13, del 13 de Junio de 2011, de MEDIMMUNE LIMITED: Un miembro de unión específico aislado para IL-13 humana, que comprende un sitio de unión al antígeno de anticuerpo que está compuesto por un dominio VH […]
ANTICUERPOS ANTI-IL-23, del 3 de Noviembre de 2010, de ELI LILLY AND COMPANY: Un anticuerpo monoclonal anti-IL23, o la porción de unión al antígeno de este, que comprende: (i) una secuencia de LCDR1 de acuerdo con la SEQ ID NO:28; […]
ANTICUERPOS DIRIGIDOS CONTRA IL-22RA Y ASOCIADOS DE UNION Y PROCEDIMIENTO DE USO EN INFLAMACION, del 3 de Noviembre de 2010, de ZYMOGENETICS, INC.: Un procedimiento de producción de un anticuerpo de un polipéptido en un animal no humano, en el que el polipéptido inoculado se selecciona del grupo […]
 METODOS PARA PRODUCIR ANTICUERPOS, del 22 de Junio de 2010, de UCB PHARMA, S.A.: Un método para obtener un anticuerpo con una función deseada, método que comprende:
a) poner una población de células B en contacto con una serie de recipientes unitarios a […]
METODOS PARA PRODUCIR ANTICUERPOS, del 22 de Junio de 2010, de UCB PHARMA, S.A.: Un método para obtener un anticuerpo con una función deseada, método que comprende:
a) poner una población de células B en contacto con una serie de recipientes unitarios a […]
 USO DE INHIBIDORES DE IL-18 PARA EL TRATAMIENTO O PREVENCION DE LA SEPSIS, del 16 de Marzo de 2010, de YEDA RESEARCH AND DEVELOPMENT CO. LTD.: El uso de un inhibidor de IL-18 en la fabricación de un medicamento para el tratamiento y/o la prevención de disfunción cardíaca relacionada […]
USO DE INHIBIDORES DE IL-18 PARA EL TRATAMIENTO O PREVENCION DE LA SEPSIS, del 16 de Marzo de 2010, de YEDA RESEARCH AND DEVELOPMENT CO. LTD.: El uso de un inhibidor de IL-18 en la fabricación de un medicamento para el tratamiento y/o la prevención de disfunción cardíaca relacionada […]
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]