ANTICUERPO MODIFICADO ANTI-TNF ALFA.
Anticuerpo monoclonal modificado anti-TNF alfa derivado del anticuerpo quimérico infliximab que es sustancialmente no inmunogénico o menos inmunogénico en el hombre que el AcMo cA2 (infliximab) cuando se usa in vivo,
y que comprende alteraciones de restos aminoacídicos específicos en la región V de sus cadenas ligera y pesada en comparación con el AcMo cA2, en el que dichas alteraciones están en la región V de la cadena pesada:
en el que dichas alteraciones están en la región V de la cadena pesada:
M18L, K19R, V23A, I28T, I51T, I56T, S79N, A80S, V81L, T86N, D87S, R89K, L116V
y en la región V de la cadena ligera:
L3Q, A9D, I10T, L11S, V13A, V19A, Q38H, R39T, I58V, S74T, T77S, V78L, S80A, I83A, D85T;
donde dichas alteraciones causan una reducción o eliminación del número de secuencias peptídicas dentro de dichas regiones V, que actúan en el AcMo cA2 como ligandos de unión a MHC de clase II y estimulan a las células T en el hombre
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP02/12566.
Solicitante: MERCK PATENT GMBH.
Nacionalidad solicitante: Alemania.
Dirección: FRANKFURTER STRASSE 250,64293 DARMSTADT.
Inventor/es: BAKER, MATTHEW, CARR, FRANCIS J., HELLENDOORN,KOEN.
Fecha de Publicación: .
Fecha Concesión Europea: 26 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C07K16/24B
- C07K7/08A
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/24 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra citoquinas, linfoquinas o interferones.
- C07K16/46 C07K 16/00 […] › Inmoglobulinas híbridas (híbridos de una inmunoglobulina con un péptido distinto de una inmunoglobulina C07K 19/00).
- C07K7/04 C07K […] › C07K 7/00 Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados. › Péptidos lineales que contienen solamente enlaces peptídicos normales.
- C12N15/13 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Inmunoglobulinas.
Clasificación antigua:
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/24 C07K 16/00 […] › contra citoquinas, linfoquinas o interferones.
- C07K16/46 C07K 16/00 […] › Inmoglobulinas híbridas (híbridos de una inmunoglobulina con un péptido distinto de una inmunoglobulina C07K 19/00).
- C07K7/04 C07K 7/00 […] › Péptidos lineales que contienen solamente enlaces peptídicos normales.
- C12N15/13 C12N 15/00 […] › Inmunoglobulinas.
Fragmento de la descripción:
Anticuerpo modificado anti-TNF alfa.
Campo de la invención
La presente invención se refiere a polipéptidos para administrar especialmente a humanos y, en particular, para uso terapéutico. Los polipéptidos son polipéptidos modificados en los que la modificación da lugar a una reducción de la propensión del polipéptido a inducir una respuesta inmunitaria tras su administración a una persona. En particular, la invención se refiere a la modificación de anticuerpos reactivos frente al factor de necrosis tumoral humano alfa (TNF alfa) que dan lugar a anticuerpos anti-TNF alfa sustancialmente no inmunogénicos o menos inmunogénicos que cualquier equivalente no modificado cuando se usan in vivo.
Antecedentes de la invención
Existen muchos casos en los que la eficacia de una proteína terapéutica está limitada por una reacción inmunitaria no deseada a dicha proteína terapéutica. Diversos anticuerpos monoclonales de ratón han mostrado ser prometedores como tratamientos en varios contextos patológicos humanos, pero en ciertos casos han fracasado debido a la inducción de grados significativos de respuesta de anticuerpos humanos anti-ratón (HAMA, por sus siglas en inglés) [Schroff, R. W. y col. (1985) Cancer Res. 45: 879-885; Shawler, D. L. y col. (1985) J. Immunol. 135: 1530-1535]. En el caso de los anticuerpos monoclonales, se han desarrollado diversas técnicas en un intento por reducir la respuesta HAMA [documentos WOA8909622, EPA0239400, EPA0438310, WOA9106667 y EPA0699755]. Estas técnicas de ADN recombinante generalmente han reducido la información genética del ratón en la construcción final del anticuerpo al tiempo que se aumentaba la información genética humana en dicha construcción final. No obstante, en varios casos, los anticuerpos "humanizados" resultantes han seguido desarrollado una respuesta inmune en pacientes [Issacs J. D. (1990) Sem. Immunol. 2: 449-456; Rebello, P. R. y col. (1999) Transplantation 68:1417-1420].
Los anticuerpos no son la única clase de molécula polipeptídica administrada como agente terapéutico frente a la cual puede desarrollarse una respuesta inmunitaria. Incluso proteínas de origen humano y con las mismas secuencias de aminoácidos que las que aparecen en humanos pueden inducir una respuesta inmunitaria en humanos. Entre los ejemplos destacables se incluye el uso terapéutico del factor estimulante de colonias de granulocitos y macrófagos [Wadhwa, M. y col. (1999) Clin. Cancer Res. 5: 1353-1361] e interferón alfa 2 [Russo, D. y col. (1996) Bri. J. Haem. 94: 300-305; Stein, R. y col. (1988) New Engl. J. Med. 318: 1409-1413] entre otros.
Un factor clave en la inducción de una respuesta inmunitaria es la presencia en la proteína de péptidos que puedan estimular la actividad de las células T mediante su presentación en el contexto de las moléculas de MHC de clase II, los denominados "epítopes de células T". Estos epítopes de células T se definen normalmente como cualquier secuencia de restos de aminoácidos con capacidad para unirse a moléculas de MHC de clase II. De forma implícita, por "epítope de células T" se entiende un epítope que cuando se une a moléculas de MHC puede ser reconocido por un receptor de la célula T (TCR) y el cual puede, al menos en principio, causar la activación de estas células T acoplándose a un TCR para inducir una respuesta de células T.
Las moléculas de MHC de clase II son un grupo de proteínas muy polimórficas que tienen una función central en la selección y activación de células T colaboradoras. El grupo de antígenos leucocitarios humanos DR (HLA-DR) es el isotipo predominante de este grupo de proteínas, sin embargo, los isotipos HLA-DQ y HLA-DP desempeñan funciones similares. La presente invención es aplicable a la detección de epítopes de células T presentados en el contexto de los antígenos MHC de clase II DR, DP o DQ. En la población humana, los individuos son portadores de dos a cuatro alelos DR, dos alelos DQ y dos DP. Se ha resuelto la estructura de varias moléculas DR y estas aparecen como un surco de unión a péptidos de extremo abierto con varios bolsillos hidrófobos que acoplan restos hidrófobos (restos del bolsillo) del péptido [Brown y col. Nature (1993) 364: 33: Stem y col (1994) Nature 368: 215]. El polimorfismo que identifica los diferentes alotipos de la molécula de clase II contribuye a una amplia diversidad de diferentes superficies de unión para péptidos dentro del surco de unión a péptidos y a nivel poblacional asegura una flexibilidad máxima con respecto a la capacidad para reconocer proteínas extrañas y organizar una respuesta inmunitaria frente a organismos patógenos.
Una respuesta inmunitaria frente a una proteína terapéutica se desarrolla a través de la ruta de presentación del péptido MHC de clase II. Aquí, las proteínas exógenas son engullidas y procesadas para su presentación en asociación con moléculas de MHC de clase II del tipo DR, DQ o DP. Las moléculas de MHC de clase II se expresan en células presentadoras de antígenos (APC) profesionales, como macrófagos y células dendríticas entre otras. El reconocimiento de un complejo MHC de clase II-péptido por un receptor de célula T relacionado en la superficie de la célula T, junto con la unión cruzada de determinados correceptores diferentes, como la molécula CD4, puede inducir un estado activado dentro de la célula T. La activación induce la liberación de citocinas que adicionalmente activan a otros linfocitos, como las células B que producen anticuerpos o activación de células T citotóxicas como una respuesta inmune celular completa.
La identificación del epítope de la célula T es la primera fase de la eliminación del epítope; sin embargo, hay pocos casos claros en la técnica donde la identificación y eliminación del epítope se integren en un único esquema. Por tanto, los documentos WO98/52976 y WO00/34317 muestran técnicas de reconocimiento de plegamiento por ordenador para identificar secuencias de polipéptidos con el potencial para unirse a un subgrupo de alotipos DR de MHC de clase II humano. En estas técnicas se eliminan epítopes de células T predichos mediante el uso de una sustitución razonable de aminoácidos en la proteína de interés. Sin embargo, con este esquema y otros procedimientos por ordenador para la identificación de epítopes [Godkin, A. J. y col. (1998) J. Immunol. 161: 850-858; Sturniolo, T. y col. (1999) Nat. Biotechnol. 17: 555-561], los péptidos predichos como capaces de unirse a moléculas de MHC de clase II pueden no funcionar como epítopes de células T en todas las situaciones, especialmente in vivo, debido a las rutas de procesamiento o a otros fenómenos. Además, las técnicas por ordenador para la predicción de epítopes de células T en general no han sido capaces de predecir epítopes con restricción DP o DQ.
Además de las técnicas por ordenador, existen métodos in vitro para determinar la capacidad de los péptidos sintéticos para unirse a moléculas MHC de clase II. Un ejemplo de método usa líneas de células B de alotipo MHC definido como fuente de unión a la superficie de MHC de clase II y puede aplicarse para la identificación del ligando MHC de clase II [Marshall K. W. y col. (1994) J. Immunol. 152:4946-4956, O'Sullivan y col. (1990) J. Immunol. 145: 1799-1808; Robadey C. y col. (1997) J. Immunol. 159: 3238-3246]. Sin embargo, estas técnicas no están adaptadas para la selección de múltiples epítopes posibles en una amplia variedad de alotipos de MHC, ni pueden confirmar que un péptido de unión pueda funcionar como epítope de células T.
Recientemente se han empleado técnicas que utilizan complejos solubles de moléculas de MHC recombinantes en combinación con péptidos sintéticos [Kern, F. y col. (1998) Nature Medicine 4:975-978; Kwok, W. W. y col. (2001) TRENDS in Immunol. 22:583-588]. Estos reactivos y procedimientos se usan para identificar la presencia de clones de células T a partir de muestras de sangre periférica de humanos o animales de experimentación que son capaces de unirse a complejos MHC-péptido en particular, pero no están adaptados para la selección de múltiples epítopes potenciales en una amplia diversidad de alotipos de MHC.
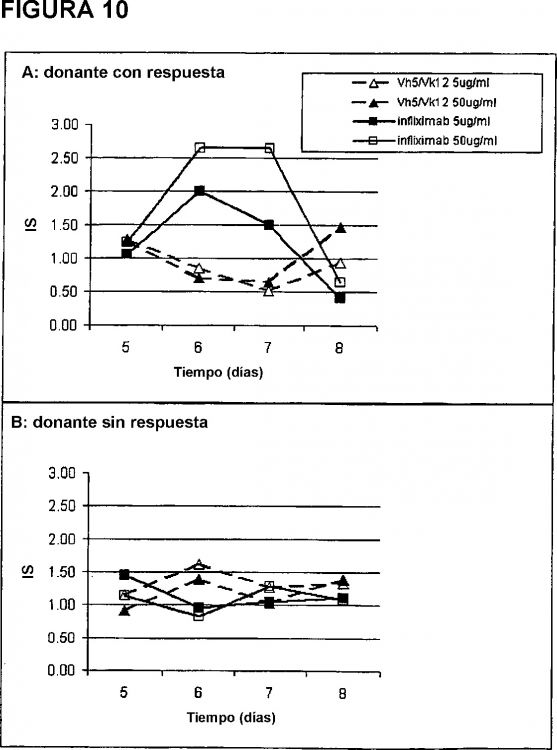
Los ensayos biológicos de activación de células T siguen siendo la mejor opción práctica para proporcionar una lectura de la capacidad de una secuencia peptídica/proteica problema para inducir una respuesta...
Reivindicaciones:
1. Anticuerpo monoclonal modificado anti-TNF alfa derivado del anticuerpo quimérico infliximab que es sustancialmente no inmunogénico o menos inmunogénico en el hombre que el AcMo cA2 (infliximab) cuando se usa in vivo, y que comprende alteraciones de restos aminoacídicos específicos en la región V de sus cadenas ligera y pesada en comparación con el AcMo cA2, en el que dichas alteraciones están en la región V de la cadena pesada:
en el que dichas alteraciones están en la región V de la cadena pesada:
M18L, K19R, V23A, I28T, I51T, I56T, S79N, A80S, V81L, T86N, D87S, R89K, L116V
y en la región V de la cadena ligera:
L3Q, A9D, I10T, L11S, V13A, V19A, Q38H, R39T, I58V, S74T, T77S, V78L, S80A, I83A, D85T;
donde dichas alteraciones causan una reducción o eliminación del número de secuencias peptídicas dentro de dichas regiones V, que actúan en el AcMo cA2 como ligandos de unión a MHC de clase II y estimulan a las células T en el hombre.
2. Anticuerpo modificado de la reivindicación 1, en el que la región V de la cadena pesada alterada comprende la secuencia de aminoácidos de la SEQ ID No 3 y la región V de la cadena ligera alterada comprende la secuencia de aminoácidos SEQ ID No 6.
3. Anticuerpo modificado según una cualquiera de las reivindicaciones 1-2, en el que los dominios de la región constante derivan de la IgG1 humana y kappa humana.
4. Anticuerpo modificado según cualquiera de las reivindicaciones 1 a 3, en el que cuando se utiliza como proteína completa en un ensayo biológico de proliferación celular inducida de células T humanas muestra un índice de estimulación menor que el del anticuerpo parental probado en paralelo usando células del mismo donante, en el que dicho índice se toma como el valor de proliferación celular valorado tras la estimulación por la proteína y dividido por el valor de proliferación celular valorado en células control que no reciben la proteína y en el que la proliferación celular se mide por cualquier medio disponible.
5. Molécula de ADN que codifica un anticuerpo según una cualquiera de las reivindicaciones 1 a 4.
6. Composición farmacéutica adecuada para el tratamiento de la artritis reumatoide y la enfermedad de Crohn que comprende un anticuerpo anti-TNF alfa modificado como se define en cualquiera de las reivindicaciones 1-4, opcionalmente junto con un vehículo, diluyente o excipiente farmacéuticamente aceptables.
7. Uso de un anticuerpo anti-TNF alfa según se define en cualquiera de las reivindicaciones 1-4 para la producción de un medicamento para el tratamiento de la artritis reumatoide y la enfermedad de Crohn.
Patentes similares o relacionadas:
CITOQUINA QUE INDUCE APOPTOSIS, del 29 de Junio de 2011, de IMMUNEX CORPORATION: Un polipéptido TRAIL soluble purificado que contiene una secuencia de aminoácidos que es al menos 80% idéntica a una secuencia seleccionada del grupo […]
ANTICUERPOS ESPECIFICOS DE TGF BETA 1, del 15 de Junio de 2011, de ELI LILLY AND COMPANY: Un anticuerpo o un fragmento de unión antigénica del mismo que neutraliza la proteína TGF-ß1 humana y tiene una K d de menos de 40pM para la TGF-ß1 […]
 USO DE PÉPTIDOS MIMÉTICOS DEL ÁCIDO POLI-ALFA 2,8-SIÁLICO PARA MODULAR FUNCIONES DE NCAM, del 27 de Mayo de 2011, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE Université de la Méditerranée - Aix-Marseille II Schafer-N Universitätsklinikum Hamburg-Eppendorf: Un péptido para uso como un medicamento para modular crecimiento, regeneración y plasticidad de células de vertebrados que expresan NCAM, en el que […]
USO DE PÉPTIDOS MIMÉTICOS DEL ÁCIDO POLI-ALFA 2,8-SIÁLICO PARA MODULAR FUNCIONES DE NCAM, del 27 de Mayo de 2011, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE Université de la Méditerranée - Aix-Marseille II Schafer-N Universitätsklinikum Hamburg-Eppendorf: Un péptido para uso como un medicamento para modular crecimiento, regeneración y plasticidad de células de vertebrados que expresan NCAM, en el que […]
 COMBINACIONES DE PÉPTIDOS PARA VACUNAS CONTRA LA ALERGIA A LOS GATOS, del 1 de Marzo de 2011, de CIRCASSIA LIMITED: Una composición para uso en la prevención o tratamiento de alergia a los gatos en un individuo por tolerización que comprende los polipéptidos: CPAVKRDVDLFLT (SEC […]
COMBINACIONES DE PÉPTIDOS PARA VACUNAS CONTRA LA ALERGIA A LOS GATOS, del 1 de Marzo de 2011, de CIRCASSIA LIMITED: Una composición para uso en la prevención o tratamiento de alergia a los gatos en un individuo por tolerización que comprende los polipéptidos: CPAVKRDVDLFLT (SEC […]
PEPTIDOS CON CAPACIDAD DE PENETRACION CELULAR Y SUS USOS, del 28 de Febrero de 2011, de UNIVERSITAT POMPEU FABRA: Péptidos con capacidad de penetración celular y sus usos.Los péptidos, o sales farmacéutica o biológicamente aceptables de los mismos, comprende la secuencia […]
 PÉPTIDOS QUE PUEDEN UNIRSE AL FACTOR TRANSFORMANTE DE CRECIMIENTO B1 (TGF-B1), del 11 de Febrero de 2011, de PROYECTO DE BIOMEDICINA CIMA, S.L.: Los péptidos tienen la capacidad de unirse al factor transformante de crecimiento TGF-ß1 (TGF-ß1) y son potenciales inhibidores de la actividad biológica del […]
PÉPTIDOS QUE PUEDEN UNIRSE AL FACTOR TRANSFORMANTE DE CRECIMIENTO B1 (TGF-B1), del 11 de Febrero de 2011, de PROYECTO DE BIOMEDICINA CIMA, S.L.: Los péptidos tienen la capacidad de unirse al factor transformante de crecimiento TGF-ß1 (TGF-ß1) y son potenciales inhibidores de la actividad biológica del […]
PROCEDIMIENTO PARA LA IDENTIFICACION DE LAS ESPECIES COMERCIALES DE LA FAMILIA MERLUCCIIDAE, ELEMENTOS NECESARIOS Y APLICACIONES, del 11 de Febrero de 2011, de CONSEJO SUPERIOR INVESTIG. CIENTIFICAS: Procedimiento para la identificación de las especies comerciales de la Familia Merlucciidae, elementos necesarios y aplicaciones.La invención proporciona […]
 ANTICUERPO MONOCLONAL HUMANO ESPECIFICO PARA LIPOPOLISACARIDOS (LPS) DE SEROTIPO IATS 011 DE PSEUDOMONAS AERUGINOSA, del 2 de Diciembre de 2010, de KENTA BIOTECH AG: Anticuerpo monoclonal humano específico para el lipopolisacárido (LPS) del serotipo IATS 011 de P. aeruginosa que comprende una cadena ligera y una cadena pesada […]
ANTICUERPO MONOCLONAL HUMANO ESPECIFICO PARA LIPOPOLISACARIDOS (LPS) DE SEROTIPO IATS 011 DE PSEUDOMONAS AERUGINOSA, del 2 de Diciembre de 2010, de KENTA BIOTECH AG: Anticuerpo monoclonal humano específico para el lipopolisacárido (LPS) del serotipo IATS 011 de P. aeruginosa que comprende una cadena ligera y una cadena pesada […]