ANTICUERPO FRENTE AL RECEPTOR OPIOIDE TIPO DELTA1b DE DANIO RERIO.
Anticuerpo frente al receptor opioide tipo Delta1b de danio rerio.
La presente invención proporciona anticuerpos, preferiblemente policlonales, específicos frente al receptor opioide tipo Delta1b de pez cebra, los cuales son capaces de reconocer dicho receptor específicamente sin presentar reactividad cruzada con otros tipos receptores opioides. Además, la invención proporciona un antígeno del receptor opioide tipo Delta1b de pez cebra empleado para la generación de dichos anticuerpos, así como un método de obtención de dichos anticuerpos y un kit que comprende dichos anticuerpos para la detección del receptor opioide tipo Delta1b de pez cebra.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201330192.
Solicitante: UNIVERSIDAD DE SALAMANCA.
Nacionalidad solicitante: España.
Inventor/es: ARÉVALO MARTIN,Juan Carlos, RODRIGUEZ RODRIGUEZ,Raquel E.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/705 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Receptores; Antígenos celulares de superficie; Determinantes celulares de superficie.
- C07K16/28 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N15/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas animales.
PDF original: ES-2486116_A1.pdf
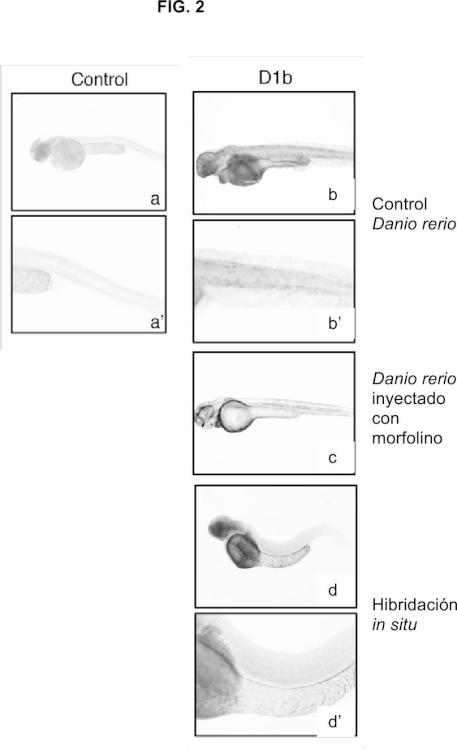
Fragmento de la descripción:
La presente invención se encuadra en el campo de la inmunología, específicamente dentro de los anticuerpos específicos frente a los receptores opioides de tipo Deltalb (D1b) de pez cebra (Danio rerio) y de sus métodos de obtención.
ESTADO DE LA TÉCNICA ANTERIOR
Los receptores opioides pertenecen a la superfamilia de los receptores acoplados a proteínas G (GPCRs), cuya importancia estriba en que intervienen en el mecanismo de acción de muchas hormonas y neurotransmisores conocidos. Los receptores opioides están constituidos por un dominio N-terminal extracelular, 7 dominios transmembrana conectados por 3 lazos intracelulares y 3 lazos extracelulares y una cola C-terminal intracelular. Según su estructura tridimensional, es conocido que los dominios transmembrana de los receptores opioides forman hélices muy unidas, orientadas en contra de las agujas del reloj. Junto a los lazos extracelulares, esta estructura da lugar a una interfase dinámica a la cual se unen los ligandos opioides.
Los receptores opioides comparten una homología en su secuencia aminoacídica de aproximadamente un 60%. Existen desde el punto de vista farmacológico tres receptores opioides: mu, delta y kappa. Los receptores p (MOR) presentan una alta afinidad por el agonista peptídico DAMGO, por la morfina y sus derivados, como la morfina-6-(B- glucurónido, y por los antagonistas CTOP y naloxonacina, así como por las endorfinas, consideradas sus agonistas endógenos. Por su parte, los receptores opioides 5 (DOR) tienen una alta afinidad por los agonistas DPDPE, DSLET, deltorfina II y por el antagonista naltrindol, compuestos que se unen con menor afinidad a los receptores k y p. Además, de acuerdo con estudios farmacológicos y de comportamiento, se ha propuesto la existencia de subtipos del receptor 5 (Sofuoglu et al., 1991, Pharmacol Exp Ther., 257(2):676-680): el receptor 51, que es activado selectivamente por DPDPE y bloqueado por el antagonista BNTX; y el receptor 52 que es activado selectivamente por la deltorfina II y bloqueado por el antagonista NTB. Además, ambos subtipos son activados por los péptidos endógenos encefalinas y por la p-endorfina y bloqueados con alta afinidad por el antagonista naltrindol. Se ha descrito que los receptores kappa, con muy poca afinidad por la morfina, están
relacionados con el sistema inmune. También se conoce un receptor tipo opioide (ORL), que no presenta actividad analgésica.
Las sustancias opioides son conocidas fundamentalmente por su actividad analgésica, así como por su capacidad de inducir tolerancia, dependencia y en algunas ocasiones, adicción, tras un consumo prolongado. Sin embargo, la existencia de varios subtipos farmacológicos de cada receptor opioide, y la ausencia de caracterización genética que pudiera determinar si cada subtipo farmacológico procedía de un gen diferente, obligaron a la comunidad científica a abrir nuevas puertas en la investigación sobre la actividad del sistema opioide. Una vez clonados los tres genes que codifican para los tres receptores opioides clásicos, mu, delta y kappa, se comenzó a elucidar la actividad farmacológica y funcional de cada uno de estos receptores, y además de su capacidad analgésica, su posible implicación en distintos procesos que forman parte del desarrollo embrionario, como la proliferación celular, la neurogénesis, la diferenciación neuronal o la protección neuronal frente a diversos daños producidos por ausencia de oxígeno o por la presencia de alguna sustancia tóxica. En concreto, los receptores opioides mu y kappa potencian la neurogénesis, el receptor opioide kappa incrementa la tasa de proliferación celular cuando es activado por la morfina y el receptor opioide delta interviene tanto en neurogénesis como en protección neuronal.
Trabajos previos han demostrado la estrecha relación que existe entre la caracterización molecular y farmacológica de los receptores opioides descritos hasta el momento (MOR, DOR, KOR y ORL) de pez cebra y de mamíferos avalando así la idoneidad del pez cebra como modelo experimental para el estudio de los mecanismos que describen el dolor y la drogodependencia. La evolución de los receptores opioides en las especies analizadas, incluida el pez cebra, ocurre de manera paralela, y así, el receptor mu de pez cebra es homólogo al receptor mu de humano, rata y ratón, y los receptores tipo delta de pez cebra son homólogos al receptor delta de mamífero.
En concreto, en los últimos años se han clonado cinco receptores de pez cebra semejantes a los receptores opioides de mamíferos, a los que se ha denominado: ZFOR1 (del inglés, Zebrafish Opioid Receptor 1), actualmente llamado ZfDORI, que presenta homología con el receptor opioide delta de mamíferos (Rodríguez et al., 2000, Neurosci Lett., 288(3):207- 210); ZFOR2 (actualmente ZfMOR), que presenta homología con el receptor opioide mu (Barrallo et al., 2000, Brain Res Mol Brain Res., 84(1-2): 1-6); ZFOR3 (actualmente ZfKOR), que presenta homología con el receptor opioide kappa (Alvarez et al., 2006, Neurosci Lett.,
405(1-2):94-99); ZFOR4 (actualmente ZÍDOR2), que es un duplicado de ZÍDOR1 y, por ello, presenta mayor homología con el receptor opioide delta (Piñal- Seoane et al., 2006, J Mol Endocrino!., 37(3):391-403) y ZfORL, que presenta homología con el receptor ORL (Rivas- Boyero et al., 2011, J Mol Endocrino!.).
El pez cebra (Danio rerio), un teleósteo originario del río Ganghes, se utiliza como modelo experimental para estudiar el desarrollo embrionario de los vertebrados ya que presenta una serie de ventajas sobre otros organismos que son utilizados como modelos experimentales, siendo relativamente fácil el manejo de sus embriones y la realización de sondeos genéticos que revelan las etapas y mecanismos de la embriogénesis.
Se ha señalado que el pez cebra es un sistema adecuado para determinar la funcionalidad de proteínas codificadas por el genoma humano, así como para estudiar el desarrollo del sistema nervioso e identificar anomalías metabólicas. En los últimos años el pez cebra está siendo utilizado como organismo modelo para el descubrimiento y validación de nuevas dianas farmacológicas, así como en estudios toxicológicos y en la búsqueda de nuevas drogas. Varios autores ya han propuesto al pez cebra como un modelo para el análisis biológico de los efectos de diversas drogas como el alcohol y la cocaína, obteniendo resultados parecidos a los encontrados en ratones. Anichtchik y colaboradores (Anichtchik et al., 2004, J Neurochem., 88(2):443-453) han demostrado que la administración de neurotoxinas catecolaminérgicas al pez cebra produce alteraciones neuroquímicas y comportamentales. Además, el pez cebra es un organismo en el que se pueden realizar análisis químicos de moléculas de bajo peso molecular, evitando el efecto materno que puede alterar los resultados si el mismo análisis se realiza sobre animales con desarrollo intrauterino. Por ello, este modelo es adecuado para realizar ensayos preclínicos frente a agentes tóxicos, y puesto que los embriones modifican su comportamiento tras la ingesta de alcohol o cocaína, el pez cebra podría ser utilizado como modelo para el estudio del fenómeno de adicción.
Existen controversias sobre los mecanismos que subyacen a la aparición y el desarrollo de tolerancia y dependencia a drogas de abuso. Parece claro que es necesario desarrollar nuevos modelos que aporten información sobre estos desafortunados efectos secundarios desde el punto de vista molecular, estructural, celular y de comportamiento. En este sentido se han realizado estudios sobre los efectos de la adicción a diferentes drogas utilizando el pez cebra como sistema modelo (Ninkovic y Bally-Cuif, 2006, Methods, 39(3):262-274).
El pez cebra puede ser un buen modelo para el estudio de los agentes opioldes, ya que actualmente, 38 años después del descubrimiento de los opioides endógenos, se conocen mejor sus funciones, aunque no se han podido establecer con certeza absoluta los mecanismos endógenos que describen su funcionamiento, ni se ha podido definir la forma de controlar los efectos secundarios producidos por éstos, como son la tolerancia y dependencia a las drogas.
En concreto, es enorme la controversia existente en cuanto a los mecanismos intracelulares que hacen posible, por un lado, el control del dolor crónico y por otro, la producción de dependencia de la droga utilizada como agente analgésico. Hasta el momento, los estudios realizados con otros modelos experimentales no han resuelto muchas de las discrepancias existentes.
Hasta el momento no se han generado anticuerpos contra los receptores opioides de pez cebra. Seguramente esto se debe a las dificultades que entraña la semejanza molecular entre los distintos subtipos de receptores opioides.... [Seguir leyendo]
Reivindicaciones:
1. Péptido aislado que consiste en la secuencia aminoacídica SEQ ID NO: 1.
2. Polinucleótido aislado que codifica para el péptido según la reivindicación 1.
3. Polinucleótido según la reivindicación 2 que consiste en la secuencia nucleotídica SEQ ID NO: 2.
4. Construcción genética que comprende el polinucleótido según cualquiera de las reivindicaciones 2 ó 3.
5. Construcción genética según la reivindicación 4 que es un vector de expresión.
6. Célula que comprende la construcción genética según cualquiera de las reivindicaciones 4 ó 5.
7. Método de obtención de anticuerpos policlonales específicos frente al receptor opioide tipo Deltal b de Danio rerio que comprende:
a. obtener el suero previamente extraído de un mamífero inmunizado con el péptido según la reivindicación 1, y
b. purificar los anticuerpos policlonales frente al receptor opioide tipo Deltalb de Danio rerio presentes en el suero obtenido en la etapa (a).
8. Método según la reivindicación 7 donde el mamífero es un conejo.
9. Suero que comprende anticuerpos policlonales específicos frente al receptor opioide tipo Deltal b de Danio rerio obtenible por el método según cualquiera de las reivindicaciones 7 u 8.
10. Anticuerpo específico frente al péptido según la reivindicación 1.
11. Anticuerpo según la reivindicación 10, donde el anticuerpo es policlonal y ha sido obtenido mediante el método según cualquiera de las reivindicaciones 7 u 8.
12. Uso del suero según la reivindicación 9 o del anticuerpo según cualquiera de las reivindicaciones 10 u 11 para la detección del receptor opioide tipo Delta1b de Danio rerio.
13. Uso según la reivindicación 12, donde la detección del receptor opioide tipo Delta1b de Danio rerio se lleva a cabo mediante un ensayo inmunohistoquímico.
14. Uso según la reivindicación 13, donde el ensayo inmunohistoquímico se selecciona de la lista que consiste en: Western blot, ELISA o inmunofluorescencia.
15. Kit para la detección del receptor opioide tipo Delta1b de Danio rerio que comprende el anticuerpo según cualquiera de las reivindicaciones 10 u 11.
16. Uso del kit según la reivindicación 15 para la detección del receptor opioide tipo Delta1b de Danio rerio.
17. Método de detección del receptor opioide tipo Delta1b de Danio rerio que comprende:
a. poner en contacto una muestra biológica aislada con el anticuerpo según cualquiera de las reivindicaciones 10 u 11,
b. incubar la muestra biológica aislada y el anticuerpo del paso (a) durante un periodo de tiempo adecuado para que tenga lugar una respuesta inmunológica, y
c. determinar la presencia de respuesta inmunológica tras la incubación del paso (b).
18. Método según la reivindicación 17, donde la presencia de respuesta inmunológica en el paso (c) se determina mediante un ensayo inmunohistoquímico.
19. Método según la reivindicación 18, donde el ensayo inmunohistoquímico se selecciona de la lista que consiste en: Western blot, ELISA o inmunofluorescencia.
Patentes similares o relacionadas:
 CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
 Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
PÉPTIDO DE MITICINA Y SU USO EN REGENERACIÓN CELULAR, del 4 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente en la regeneración celular y/o […]
Péptido de miticina y su uso en regeneración celular, del 28 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Péptido de miticina y su uso en regeneración celular. La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente […]
Moléculas de unión de alta avidez que reconocen MAGE-A1, del 8 de Abril de 2020, de Max Delbrück Centrum für Molekulare Medizin (MDC) Berlin-Buch: Una construcción de reconocimiento de antígenos que es un receptor de células T (TCR), que comprende (i) una región variable de la cadena alfa […]
Moléculas de unión a ligando y usos de las mismas, del 25 de Diciembre de 2019, de Vegenics Pty Limited: Una molécula de unión a ligando que comprende un polipéptido de unión a ligando fusionado a un fragmento de dominio constante de inmunoglobulina, comprendiendo […]
Tratamiento de las enfermedades relacionadas con la apolipoproteína a1 por inhibición del transcrito antisentido natural a la apolipoproteína a1, del 17 de Octubre de 2019, de CuRNA, Inc: Un oligonucleótido que se dirige a un transcrito antisentido natural de apolipoproteína A1 para su uso como un compuesto terapéutico, donde el oligonucleótido […]