Preparación de un antibiótico cristalino de ácido fusídico.
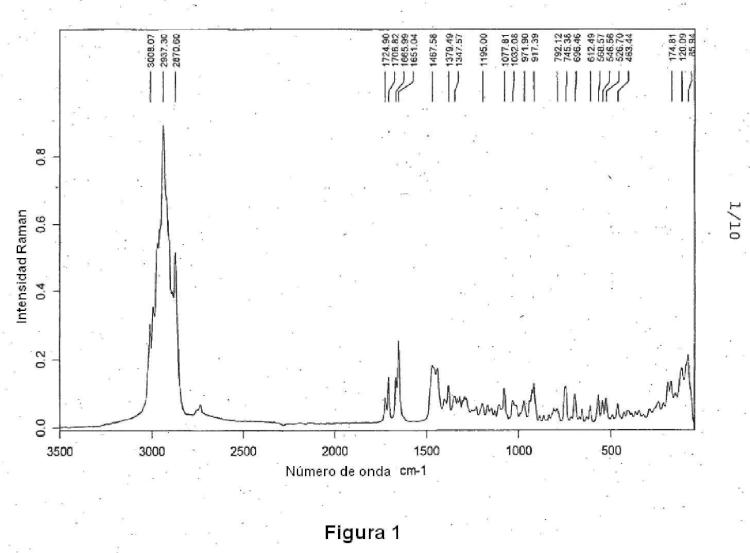
Ácido fusídico cristalino caracterizado por exhibir un ángulo de reflexión de (2θ
) a 22.7 (±0.1) excediendo en 30% con respecto al pico de intensidad más grande en un difractograma en polvo de rayos X (XRD) y excediendo la ausencia de ángulos de reflexión (2θ) en el rango de 10.2-12.0 (±0.1) en 5% con respecto al pico de intensidad más grande.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DK2006/000600.
Solicitante: LEO PHARMA A/S.
Nacionalidad solicitante: Dinamarca.
Dirección: INDUSTRIPARKEN 55 2750 BALLERUP DINAMARCA.
Inventor/es: JENSEN, JAN, ANDERSEN,NIELS RASTRUP.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/575 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › sustituidos en posición 17 beta por una cadena de al menos tres átomos de carbono, p. ej. colano, colestano, ergosterol, sitosterol.
- A61P31/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos.
- C07J13/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides normales que contienen carbono, hidrógeno, halógeno u oxígeno, teniendo un enlace doble carbono-carbono a partir de o hacia la posición 17.
PDF original: ES-2553165_T3.pdf




Patentes similares o relacionadas:
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Tratamiento o prevención de infecciones asociadas a biopelículas con agua con cloro libre disponible, del 15 de Julio de 2020, de Sonoma Pharmaceuticals, Inc: Agua con cloro libre disponible (FAC) para su uso en el tratamiento o reducción de la incidencia de una infección en un mamífero provocada por una biopelícula que contiene […]
Macrocíclico y composición que comprende el mismo, del 8 de Julio de 2020, de Shenzhen TargetRx, Inc: Un compuesto macrocíclico sustituido, que es un compuesto macrocíclico representado por la fórmula (I), o una forma cristalina, una sal farmacéuticamente […]
Composición farmacéutica que comprende un complejo de carga portador polimérico y al menos un antígeno proteínico o peptídico, del 1 de Julio de 2020, de CureVac AG: Composición farmacéutica que incluye: (A) un complejo de carga portador polimérico, que comprende: a) un portador polimérico que comprende componentes catiónicos reticulados […]
Composiciones farmacéuticas para uso tópico basadas en ácido hialurónico sulfatado como promotor de absorción de la piel, del 1 de Julio de 2020, de FIDIA FARMACEUTICI S.P.A.: Una composición farmacéutica para uso tópico que contiene ácido hialurónico sulfatado como promotor de absorción de la piel de diclofenaco, ketoprofeno, ibuprofeno […]
Composición para uso en el tratamiento de paroniquia, del 24 de Junio de 2020, de Veloce BioPharma LLC: Una composición para uso en el tratamiento de una infección fúngica, micótica, viral y/o bacteriana, en donde la infección es paroniquia, cuya composición comprende: […]
PÉPTIDO DE MITICINA Y SU USO EN REGENERACIÓN CELULAR, del 4 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente en la regeneración celular y/o […]
Métodos para proporcionar virosomas con adyuvante y virosomas con adyuvante obtenibles de esta manera, del 3 de Junio de 2020, de BESTEWIL HOLDING B.V: Un método para preparar los virosomas con adyuvante, que comprende las etapas de: (i) proporcionar una composición acuosa de los virosomas sin adyuvante que comprende […]