ANESTÉSICO LOCAL ALCALINIZADO, EN BOLSA.
Producto farmacológico (1) que comprende: - un contenedor (2) sustancialmente en forma de bolsa,
apropiado para recibir un fluido farmacológico, caracterizado porque comprende además - una solución (3) que contiene un anestésico local alcalinizado recibido en dicho contenedor (2)
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06425351.
Solicitante: GUARDANT S.R.L.
Nacionalidad solicitante: Italia.
Dirección: VIA PIAVE 32 00044 FRASCATI RM ITALIA.
Inventor/es: Pelloni,Vittorio.
Fecha de Publicación: .
Fecha Solicitud PCT: 24 de Mayo de 2006.
Clasificación Internacional de Patentes:
- A61J1/10 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61J RECIPIENTES ESPECIALMENTE ADAPTADOS PARA USOS MEDICOS O FARMACEUTICOS; DISPOSITIVOS O METODOS ESPECIALMENTE CONCEBIDOS PARA CONFERIR A LOS PRODUCTOS FARMACEUTICOS UNA FORMA FISICA O DE ADMINISTRACION PARTICULAR; DISPOSITIVOS PARA ADMINISTRAR ALIMENTOS O MEDICINAS VIA ORAL; CHUPETES PARA BEBES; ESCUPIDERAS. › A61J 1/00 Recipientes especialmente adaptados a fines médicos o farmacéuticos (cápsulas o similares para administración vía oral A61J 3/07; adaptados especialmente para instrumentos o aparatos quirúrgicos o de diagnóstico A61B 50/30; recipientes para sustancias radioactivas G21F 5/00). › Recipientes tipo saco.
- A61K31/167 A61 […] › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo el átomo de nitrogeno de un grupo carboxiamida unido directamente al ciclo aromático, p. ej. lidocaina, paracetamol.
- A61K31/445 A61K 31/00 […] › Piperidinas no condensadas, p. ej. piperocaína.
- B32B27/08 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B32 PRODUCTOS ESTRATIFICADOS. › B32B PRODUCTOS ESTRATIFICADOS, es decir, HECHOS DE VARIAS CAPAS DE FORMA PLANA O NO PLANA, p. ej. CELULAR O EN NIDO DE ABEJA. › B32B 27/00 Productos estratificados compuestos esencialmente de resina sintética. › de una resina sintética de una clase diferente.
Clasificación PCT:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2358043_T3.pdf
Fragmento de la descripción:
La presente invención se refiere a un producto farmacológico que comprende un recipiente para un fluido que recibe un anestésico local.
Desde hace varios años, investigaciones llevadas a cabo por las industrias farmacéuticas están destinadas a anestésicos locales que poseen un índice terapéutico óptimo, es decir, una relación de dosis efectiva/dosis tóxica que reduzca al máximos los riesgos para el paciente. En la práctica clínica, la efectividad de un anestésico local es evaluada por el tiempo de aparición de su efecto (es decir, el llamado tiempo de inicio o tiempo de latencia), la duración de este efecto y la calidad del bloqueo sensorial y motriz provocado. Desde luego, aparte de las características físico-químicas del anestésico, el bloqueo motriz y sensorial depende también del volumen y concentración del medicamento administrado. En general, al incrementar la dosis, la calidad del bloqueo mejora, pero el riesgo de efectos secundarios aumenta en el mismo grado.
Dicho tiempo de inicio del bloqueo está relacionado sobre todo con la capacidad de difusión o difusividad del anestésico, mientras que desde este punto de vista la dosis y su concentración son menos relevantes. En particular, el anestésico es difundible en forma no ionizada y la fracción no ionizada se relaciona con las características intrínsecas del medicamento y con el pH del medio: si este último es alcalino, la difusividad es más elevada. A este respecto, estudios realizados en nervios aislados, llevados a cabo utilizando diferentes agentes bloqueadores de los impulsos nerviosos, para pH extracelular constante, han destacado que los anestésicos no ionizados, así como las aminas terciarias ionizables, son potenciados por bicarbonato sódico tampón. (Wong K, Strichartz GR, Raymond SA "On the mechanism of potentiation of local anaesthetics by bicarbonate buffer: drug structure-activity studies on isolated peripheral nerve" (“Mecanismo de potenciación de anestésicos locales por bicarbonato tampón: estudios sobre la estructura-actividad sobre nervios periféricos aislados”) Anesth. Analg. 76,131, 1993)
Una experiencia relevante en obstetricia, llevada a cabo en 600 casos, ha confirmado que la utilización de la mepivacaína modificada en el pH reduce el tiempo de latencia de estos anestésicos locales sin efectos secundarios en la madre o en el feto durante el parto por la sección C. (Varrassi G, Capogna D, Celleno G, “Analgesia ed anestesia in ostetricia" (“Efecto analgésico y anestesia en obstetricia”) Interservice Press 1991:132.
La reducción del tiempo de latencia y la mayor profundidad del bloqueo producidos son debidos a la difusión de CO2 a través de la membrana nerviosa con la disminución en que ello comporta del pH axoplasmático. El pH bajo incrementa la velocidad y grado de formación de formas activas protonadas del anestésico local. Además, el anestésico local ionizado no se difunde fácilmente a través de las membranas; por lo tanto, el medicamento permanece retenido dentro del axoplasma, situación conocida como “retención de iones” (“ion trap”). Por lo tanto, la alteración de la solución al aumentar el pH incrementa la velocidad de difusión del anestésico a través de la membrana nerviosa (retención catiónica) (“cathion trap”).
Otros datos clínicos de interés es que las soluciones alcalinizadas son localmente mejor toleradas con respecto a las no modificadas (Martin AJ. “pH-adjustment and discomfort caused by the intradermal injection of lignocaine (“Ajuste de pH y molestias provocadas por la inyección intradérmica de lignocaína”), Anaesthesia 1191 Mar, 46(3), 242). Este hecho hace particularmente útiles estos anestésicos en las zonas en la que el dolor provocado por la infiltración de la solución (por ejemplo, en cirugía ambulatoria y bloqueos periféricos) se percibe en mayor proporción.
El anestésico local al que se hace referencia, tal como, por ejemplo, mepivacaína, se encuentra habitualmente a disposición en viales. En el momento de la administración, el vial es roto y el anestésico, por la razones que se indican, es más o menos disuelto con solución fisiológica 0,9% NaCl y recibe la adición de bicarbonato sódico (NaHCO3). Por lo tanto, esta solución se obtiene de forma extemporal y manualmente, en una forma sustancialmente empírica, obteniendo en general un pH de la solución que es más elevado que el asociado al anestésico separadamente. No obstante, dado el riesgo de precipitación del bicarbonato en la solución y las formas empíricas de obtención, el pH final es prácticamente en todos los casos más bajo que el teórico que se puede obtener con una solución perfectamente saturada. En particular, en la actualidad los preparados comerciales disponibles en Italia tienen un pH débilmente básico (por ejemplo, igual a 6,4 aproximadamente para el anestésico Lidocaína, aproximadamente 6,0 para Bupivacaína y aproximadamente 6,2 para Mepivacaína).
Además, evidentemente las formas de preparación exponen la solución al riesgo de contaminación ambiental debido también a la posibilidad de que trocitos de cristal de los viales, polvo o queratinas caigan en el contenedor que contiene la solución.
La adición de bicarbonato a los anestésicos locales, además de provocar una modificación del pH, comporta también un incremento del pCO2 que lleva a cabo una acción sinérgica a la de la modificación del pH. No obstante, esta segunda acción se pierde cuando se lleva a cabo la adición de bicarbonato, tal como en la técnica conocida, en un sistema abierto y cuando la solución no es preparada en el momento del bloqueo, dado que el CO2 se dispersa.
El documento US 4.623.334 da a conocer un aparato para a la administración intravenosa de medicamentos, en el que el medicamento puede contener lidocaína.
Por lo tanto, el problema técnico que subyace a la presente invención consiste en dar a conocer un anestésico local alcalinizado en una forma farmacéuticamente adecuada que permita superar los inconvenientes mencionados con referencia a la técnica conocida.
Este problema es solucionado por un producto farmacológico según la reivindicación 1.
La presente invención da a conocer varias ventajas relevantes. La ventaja principal consiste en que el anestésico local alcalinizado envasado en una bolsa permite obtener una solución óptima, y en particular saturada del anestésico y del agente alcalinizante, y conservar las características de dicha solución incluso durante largos periodos de tiempo a una temperatura de 5-25ºC, dado que no existe necesidad de preparación extemporal.
Además, el anestésico que se consigue de este modo es estable para cualquier concentración y tiene un pH determinado.
Otras ventajas, características y modos operativos de la presente invención quedarán evidentes de la siguiente descripción detallada de algunas realizaciones de la misma, que tienen carácter de ejemplo y que no tienen objetivo de limitación. Se hará referencia a las figuras de los dibujos adjuntos, en los que:
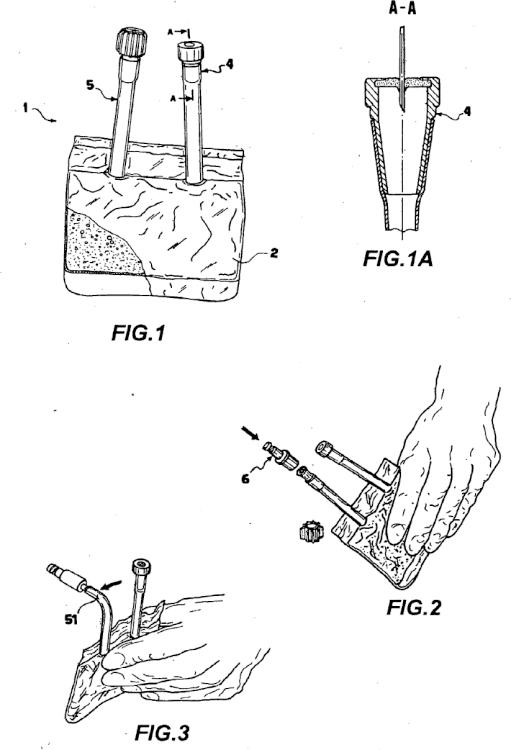
- La figura 1 muestra una vista en perspectiva frontal, con una sección parcial, de un producto farmacológico, de acuerdo con una primera realización de la invención;
- La figura 1A muestra una vista en sección del producto del la figura 1, según la línea de corte A-A;
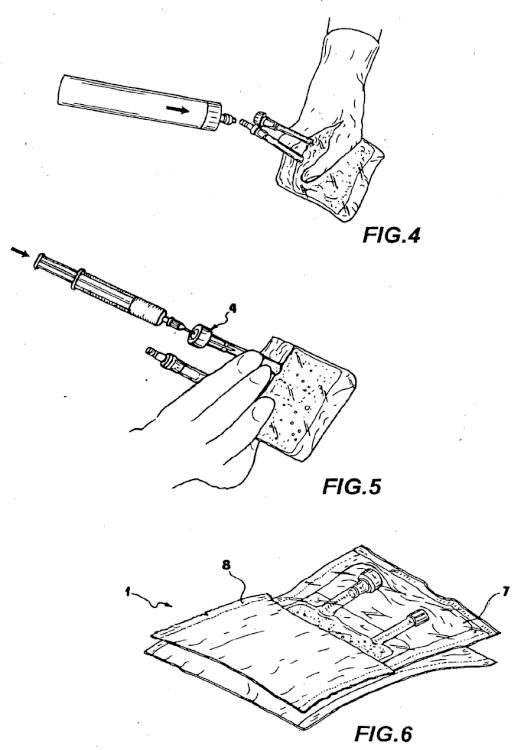
- las figuras 2 a 5 muestran cada una de ellas una vista en perspectiva del producto de la figura 1 durante su utilización clínica;
- las figura 6 muestra otra vista en perspectiva del producto de la figura 1 durante la operación de su envasado antes de su utilización clínica.
Haciendo referencia a la figura 1, un producto farmacológico de acuerdo con una primera realización de la invención, se ha indicado de manera general con el numeral 1.
El producto 1 comprende un cuerpo de contenedor 2 en forma sustancialmente de bolsa, de un material altamente biocompatible, recibiendo en su interior un fluido farmacológico 3 que consiste e una solución de un anestésico local con un agente alcalinizante, en particular NaHCO3.
En la presente realización, el anestésico local es clorhidrato de mepivacaína y el producto 1 contiene mepivacaína alcalinizada con una concentración de 2%. Siempre en la presente realización, 1 ml de solución inyectable contiene:
- principio activo: 20 mg de clorhidrato de mepivacaína, igual a 17,4 mg de mepivacaína;
- excipientes:... [Seguir leyendo]
Reivindicaciones:
1. Producto farmacológico (1) que comprende:
- un contenedor (2) sustancialmente en forma de bolsa, apropiado para recibir un fluido farmacológico, caracterizado porque comprende además
- una solución (3) que contiene un anestésico local alcalinizado recibido en dicho contenedor (2).
2. Producto (1), según la reivindicación 1, en el que dicho anestésico local es seleccionado a partir de un grupo que comprende mepivacaína, bupivacaína y lidocaína.
3. Producto (1), según la reivindicación 1 ó 2, en el que dicha solución (3) tiene un pH comprendido en un rango aproximado de 8,0-8,5.
4. Producto (1), según cualquiera de las reivindicaciones anteriores, en el que dicho contenedor (2) es transparente.
5. Producto (1), según cualquiera de las reivindicaciones anteriores, en el que dicho contenedor (2) está fabricado en un material bilaminado.
6. Producto (1), según la reivindicación anterior, en el que dicho contenedor (2) tiene una capa interna en contacto con dicha solución (3), de polipropileno.
7. Producto (1), según la reivindicación 5 ó 6, en el que dicho contenedor (2) tiene una capa externa de PVC.
8. Producto (1), según cualquiera de las reivindicaciones anteriores, en el que dicho contenedor (2) es estéril.
9. Producto (1), según cualquiera de las reivindicaciones anteriores, en el que dicho contenedor (2) comprende un elemento autosellante (4) apropiado para permitir la repetida extracción de dicha solución (3) mediante una aguja.
10. Producto (1), según cualquiera de las reivindicaciones anteriores, en el que dicho contenedor (2) comprende un elemento de conexión (5) para un conector de recogida múltiple (6).
11. Producto (1), según la reivindicación anterior, en el que dicho elemento de conexión (5) tienen un tabique transversal (51) apropiado para su rotura en la primera utilización del mismo.
12. Producto (1), según cualquiera de las reivindicaciones anteriores, que comprende además un conector múltiple de recogida (6) para la extracción de dicha solución (3).
13. Producto (1), según cualquiera de las reivindicaciones anteriores, que comprende una envolvente externa (7, 8) que protege por completo dicho contenedor (2) contra el contacto con el medio ambiente, y que puede ser retirado en el momento de la utilización.
14. Producto (1), según la reivindicación anterior, en el que dicha envolvente externa (7) es estéril.
15. Producto (1), según la reivindicación 13 ó 14, en el que dicha envolvente externa (7) está realizada en polipropileno.
16. Producto (1), según cualquiera de las reivindicaciones 13 a 16, en el que dicha envolvente externa (8) es apropiada para proteger dicho contenedor (2) contra la luz.
17. Producto (1), según cualquiera de las reivindicaciones 13 a 15, en el que dicha envolvente externa (8) está realizada en aluminio.
18. Producto (1), según cualquiera de las reivindicaciones 13 a 15, en el que dicha envolvente externa (7) es transparente.
19. Producto (1), según cualquiera de las reivindicaciones anteriores, que comprende una primera envolvente (7) que comprende dicho contenedor (2) y una segunda envolvente (8) que comprende dicha envolvente (7), protegiéndola completamente con respecto al contacto con el medio ambiente, pudiendo ser retiradas dichas envolventes (7, 8) antes de la utilización.
20. Producto (1), según la reivindicación anterior, en el que dicha primera envolvente externa (7) es transparente.
21. Producto (1), según cualquiera de las reivindicaciones 19 ó 20, en el que dicha primera envolvente (7) es estéril.
22. Producto (1), según cualquiera de las reivindicaciones 19 a 21, en el que dicha segunda envolvente (8) es apropiada para proteger dicho contenedor (2) contra la luz.
23. Producto (1), según cualquiera de las reivindicaciones 19 a 22, en el que dicha segunda envolvente (8) está realizada en aluminio.
Patentes similares o relacionadas:
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Triple combinación de antagonistas del receptor 5-HT6 puros, inhibidores de la acetilcolinesterasa y antagonista del receptor NMDA, del 15 de Julio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un antagonista del receptor 5-HT6 puro, un inhibidor de la acetilcolinesterasa y un antagonista del receptor NMDA, en el que el antagonista […]
Combinación de agonistas inversos del receptor de histamina-3 con inhibidores de acetilcolinesterasa, del 24 de Junio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un agonista inverso del receptor de histamina-3 y un inhibidor de acetilcolinesterasa; en donde el agonista inverso del receptor de histamina-3 […]
Compuestos inhibidores de la acetilcolinesterasa y agonistas de los receptores serotoninérgicos 5HT4, con efecto paramnesiante, sus procedimientos de preparación y composiciones farmacéuticas que los contienen, del 10 de Junio de 2020, de Université de Caen: Compuesto de fórmula general (I): **(Ver fórmula)** en la que: X representa un átomo de hidrógeno, o un átomo de halógeno […]
Nuevos derivados de piperazina y piperidina, síntesis y uso de los mismos en la inhibición de la oligomerización de VDAC, la apoptosis y la disfunción mitocondrial, del 3 de Junio de 2020, de The National Institute for Biotechnology in the Negev Ltd: Compuesto de Fórmula general (Id): **(Ver fórmula)** en la que L2 es un grupo de enlace seleccionado del grupo que consiste en un alquilamidileno […]
Compuestos de benzaldehído sustituidos y métodos para su uso en el aumento de la oxigenación tisular, del 27 de Mayo de 2020, de Global Blood Therapeutics, Inc: Un compuesto de Fórmula (I): **(Ver fórmula)** o un tautómero o una sal farmacéuticamente aceptable del mismo, para su uso en el tratamiento […]
Composición farmacéutica en comprimido que comprende bilastina, del 27 de Mayo de 2020, de Alfred E. Tiefenbacher (GmbH & Co. KG): Una composición farmacéutica en forma de comprimido, que comprende a) una forma cristalina de bilastina, en donde la forma cristalina tiene picos característicos a 6,53, […]
Nuevas composiciones para prevenir y/o tratar trastornos degenerativos del sistema nervioso central, del 27 de Mayo de 2020, de AMICUS THERAPEUTICS, INC: Un compuesto de Fórmula III: **(Ver fórmula)** en donde: R1 es C(R2)(R3)(R4); R2 es hidrógeno, -OH o halógeno; R3 es hidrógeno, -OH, halógeno o -CH3; […]