Análogos de glucagón que muestran solubilidad y estabilidad fisiológicas.
Un péptido que comprende (i) SEC ID Nº: 1 sustituida con una cisteína en la posición 24 en la que una cadena de polietilenglicol (PEG) está unida covalentemente a la cadena lateral de la Cys en la posición 24 del péptido o (ii) SEC ID Nº:
1 sustituida con una cisteína en la posición 24 en la que una cadena de PEG está unida covalentemente 5 a la cadena lateral de la Cys en la posición 24 del péptido y una, dos o tres sustituciones de aminoácidos en posiciones seleccionadas de las posiciones 5, 7, 10, 12, 13, 14, 17, 18, 19, 20, 21, 28 y 29, en las que las una, dos o tres sustituciones de aminoácidos se seleccionan de
a. Ala, Ser, Pro o Gly en la posición 5;
b. Ala, Ser, Pro o Gly en la posición 7;
c. Fe, Trp o acetil fenilalanina en la posición 10;
d. His, Arg u Orn en la posición 12;
e. Phe, Trp o acetil fenilalanina en la posición 13;
f. Met, Ile, Val, Cys, Nle u homocisteína en la posición 14;
g. His, Lis u Orn en la posición 17;
h. His, Lis u Orn en la posición 18;
i. Ser, Thr, Pro, o Gly en la posición 19;
j. Asp, Asn o Glu en la posición 20;
k. Asn, Glu o Gln en la posición 21;
l. Asp, Glu o Aln en la posición 28; y
m. Ala, Ser, Pro o Gly en la posición 29
en donde el péptido estimula la actividad del receptor de glucagón, como se mide por la producción de AMPc usando el ensayo descrito en el Ejemplo 13, y sales farmacéuticamente aceptables de dicho péptido.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/043334.
Solicitante: INDIANA UNIVERSITY RESEARCH AND TECHNOLOGY CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 351 WEST 10TH STREET INDIANAPOLIS, IN 46202 ESTADOS UNIDOS DE AMERICA.
Inventor/es: DIMARCHI, RICHARD D., SMILEY, DAVID L.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/26 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Glucagón.
PDF original: ES-2507098_T3.pdf
Fragmento de la descripción:
Análogos de glucagón que muestran solubilidad y estabilidad fisiológicas
Antecedentes Se produce hipoglucemia cuando los niveles de glucosa en sangre bajan demasiado para proporcionar suficiente energía para las actividades del cuerpo. En adultos o niños mayores de 10 años, la hipoglucemia es poco común excepto como un efecto secundario del tratamiento de la diabetes, pero puede resultar de otras medicaciones o enfermedades, deficiencias hormonales o enzimáticas o tumores. Cuando la glucosa en sangre comienza a caer, el glucagón, una hormona producida por el páncreas, señaliza al hígado para que degrade glucógeno y libere glucosa, provocando que los niveles de glucosa en sangre aumenten hacia un nivel normal. Sin embargo, para los diabéticos, esta respuesta del glucagón a la hipoglucemia puede estar alterada, haciendo más difícil que los niveles de glucosa vuelvan al intervalo normal.
La hipoglucemia es un acontecimiento con peligro para la vida que requiere atención médica inmediata. La administración de glucagón es una medicación establecida para el tratamiento de la hipoglucemia aguda y puede restaurar los niveles normales de glucosa en un periodo de minutos desde la administración. Cuando se usa glucagón en el tratamiento médico agudo de la hipoglucemia, se solubiliza una forma cristalina de glucagón con un tampón de ácido diluido y la solución se inyecta por vía intramuscular. Aunque este tratamiento es eficaz, la metodología es incómoda y peligrosa para alguien que está semiconsciente. En consecuencia, existe la necesidad de un análogo de glucagón que mantenga el rendimiento biológico de la molécula parental pero sea suficientemente soluble y estable, en condiciones fisiológicas relevantes. De modo que puede pre-formularse como una solución, lista para inyección.
Adicionalmente, se recomienda a los diabéticos que mantengan niveles de glucosa en sangre casi normales para retardar o prevenir las complicaciones microvasculares. La consecución de este objetivo habitualmente requiere terapia de insulina intensiva. Al intentar conseguir este objetivo, los médicos se han encontrado con un aumento sustancial de la frecuencia y gravedad de la hipoglucemia en sus pacientes diabéticos. En consecuencia, son necesarios productos farmacéuticos y metodologías mejorados para tratar la diabetes que tengan menos probabilidades de inducir hipoglucemia que las terapias de insulina actuales.
Como se describe en el presente documento, se proporcionan agonistas del glucagón de alta potencia que muestran estabilidad biofísica y solubilidad acuosa potenciadas. Estos compuestos pueden usarse de acuerdo con una realización para preparar soluciones pre-formuladas listas para inyección para tratar hipoglucemia. Como alternativa, los agonistas de glucagón pueden co-administrarse con insulina para tamponar los efectos de la insulina para permitir un mantenimiento más estable de los niveles de glucosa en sangre. Además, otros usos beneficiosos de composiciones que comprenden los péptidos de glucagón modificados desvelados en el presente documento se describen en detalle posteriormente.
Sumario La invención proporciona un péptido como se define en la reivindicación 1.
De acuerdo con un aspecto los péptidos de glucagón desvelados en el presente documento se modifican por la adición de un segundo péptido al extremo carboxilo terminal del péptido de glucagón. En una realización un péptido de glucagón está unido covalentemente mediante un enlace peptídico con un segundo péptido, en el que el segundo péptido comprende una secuencia seleccionada del grupo que consiste en SEC ID Nº : 19, SEC ID Nº : 20 y SEC ID Nº : 21.
De acuerdo con una realización se proporciona una composición farmacéutica que comprende los péptidos de glucagón nuevos desvelados en el presente documento. En una realización, las composiciones farmacéuticas comprenden soluciones que están esterilizadas y contenidas dentro de diversos envases. Las composiciones farmacéuticas pueden envasarse adicionalmente como parte de un kit que incluye un dispositivo desechable para administrar la composición a un paciente.
Los péptidos o composiciones pueden usarse para tratar rápidamente la hipoglucemia usando una composición acuosa pre-formulada. El método comprende la etapa de administrar una cantidad eficaz de una solución acuosa que comprende un péptido de glucagón modificado nuevo de la presente divulgación. En una realización, el péptido de glucagón está pegilado en la posición 21 o 24 del péptido de glucagón y la cadena de PEG tiene un peso molecular de aproximadamente 500 a aproximadamente 5.000 Dalton. La solución de glucagón modificada puede pre-envasarse en un dispositivo que se usa para administrar la composición al paciente que padece hipoglucemia.
Los péptidos o composiciones pueden usarse en un método que se proporciona para regular los niveles de glucosa en sangre en pacientes dependientes de insulina. El método comprende las etapas de administrar insulina en una cantidad terapéuticamente eficaz para el control de la diabetes y administrar un péptido de glucagón modificado
nuevo de la presente divulgación en una cantidad terapéuticamente eficaz para la prevención de hipoglucemia, en el que dichas etapas de administración se realizan en un intervalo de doce horas entre sí. En una realización el péptido de glucagón y la insulina se co-administran como una única composición, en la que el péptido de glucagón está pegilado con una cadena de PEG que tiene un peso molecular seleccionado del intervalo de aproximadamente 5.000 a aproximadamente 40.000 Dalton.
Los péptidos o composiciones pueden usarse en un método para inducir la parálisis temporal del tracto intestinal. El método comprende la etapa de administrar uno o más de los péptidos de glucagón pegilados desvelados en el presente documento a un paciente.
Los péptidos o composiciones pueden usarse en un método para reducir el aumento de peso o inducir la pérdida de peso, en el que el aminoácido 29 del péptido de glucagón está unido con un segundo péptido mediante un enlace peptídico, y dicho segundo péptido comprende la secuencia de SEC ID Nº : 19, SEC ID Nº : 20 o SEC ID Nº : 21. En una realización el péptido de glucagón está pegilado.
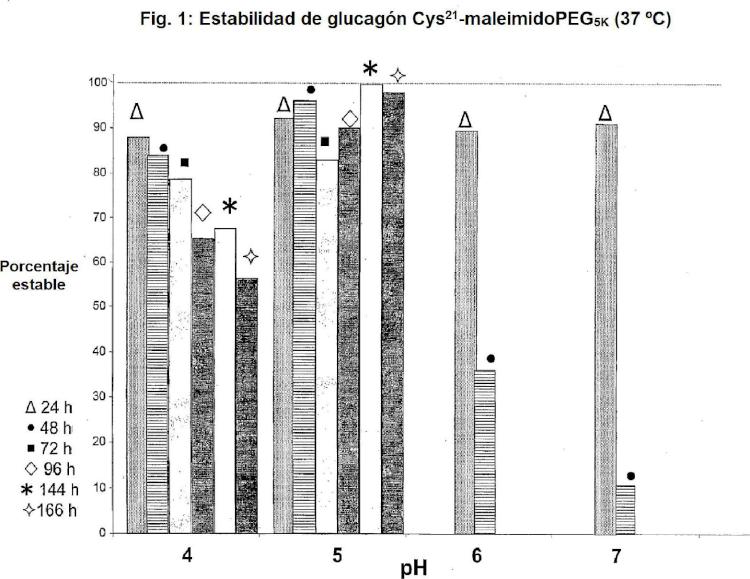
Breve descripción de los dibujos La Fig. 1 es un gráfico de barras que representa la estabilidad de Glucagón Cys21-maleimidoPEG5K a 37 º C incubado durante 24, 48, 72, 96, 144 y 166 horas, respectivamente.
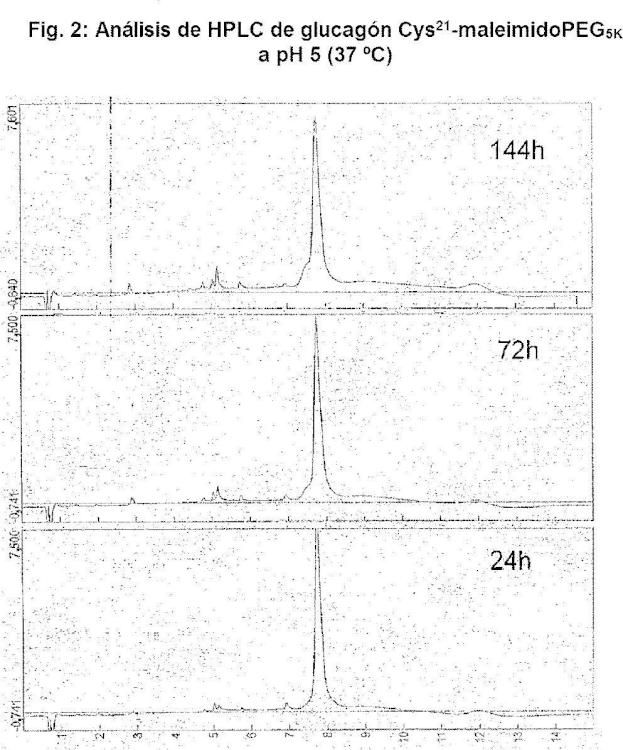
La Fig. 2 representa los datos generados del análisis de HPLC de Glucagón Cys21-maleimidoPEG5K a pH 5 incubado a 37 º C durante 24, 72 o 144 horas, respectivamente.
Descripción detallada
Definiciones Al describir y reivindicar la invención, se usará la siguiente terminología de acuerdo con las definiciones expuestas a continuación.
Como se usa en el presente documento, la expresión “vehículo farmacéuticamente aceptable” incluye cualquiera de los vehículos farmacéuticos convencionales, tales como una solución salina tamponada con fosfato, agua, emulsiones tales como emulsión de aceite/agua o agua/aceite y diversos tipos de agentes humectantes. La expresión también abarca cualquiera de los agentes aprobados por una agencia reguladora del Gobierno Federal de los Estados Unidos o enumerado en la Farmacopea de los Estados Unidos para su uso en animales, incluyendo seres humanos.
Como se usa en el presente documento la expresión “sal farmacéuticamente aceptable” se refiere a sales de compuestos que conservan la actividad biológica del compuesto parental, y que no son indeseables biológicamente o de otro modo. Muchos de los compuestos desvelados en el presente documento son capaces de formar sales de 40 ácidos y/o bases en virtud de la presencia de grupos amino y/o carboxilo o grupos similares a los mismos.
Pueden prepararse sales de adición de bases farmacéuticamente aceptables a partir de bases inorgánicas y orgánicas. Las sales derivadas de bases inorgánicas, incluyen solamente como ejemplo sales de sodio, potasio, litio, amonio, calcio y magnesio. Las sales derivadas de bases orgánicas incluyen, pero sin limitación, sales de aminas 45 primarias, secundarias y terciarias.
Pueden prepararse sales de adición de ácidos farmacéuticamente aceptables a partir de ácidos inorgánicos y orgánicos. Las sales derivadas de ácidos inorgánicos incluyen ácido clorhídrico, ácido bromhídrico, ácido sulfúrico, ácido nítrico, ácido fosfórico y similares. Las sales derivadas de ácidos orgánicos incluyen ácido acético, ácido 50 propiónico, ácido glicólico, ácido pirúvico, ácido oxálico, ácido málico, ácido malónico, ácido... [Seguir leyendo]
Reivindicaciones:
1. Un péptido que comprende (i) SEC ID Nº : 1 sustituida con una cisteína en la posición 24 en la que una cadena de polietilenglicol (PEG) está unida covalentemente a la cadena lateral de la Cys en la posición 24 del péptido o (ii) SEC ID Nº : 1 sustituida con una cisteína en la posición 24 en la que una cadena de PEG está unida covalentemente a la cadena lateral de la Cys en la posición 24 del péptido y una, dos o tres sustituciones de aminoácidos en posiciones seleccionadas de las posiciones 5, 7, 10, 12, 13, 14, 17, 18, 19, 20, 21, 28 y 29, en las que las una, dos o tres sustituciones de aminoácidos se seleccionan de
a. Ala, Ser, Pro o Gly en la posición 5;
b. Ala, Ser, Pro o Gly en la posición 7;
c. Fe, Trp o acetil fenilalanina en la posición 10;
d. His, Arg u Orn en la posición 12;
e. Phe, Trp o acetil fenilalanina en la posición 13;
f. Met, Ile, Val, Cys, Nle u homocisteína en la posición 14;
g. His, Lis u Orn en la posición 17;
h. His, Lis u Orn en la posición 18;
i. Ser, Thr, Pro, o Gly en la posición 19;
j. Asp, Asn o Glu en la posición 20;
k. Asn, Glu o Gln en la posición 21;
l. Asp, Glu o Aln en la posición 28; y
m. Ala, Ser, Pro o Gly en la posición 29
en donde el péptido estimula la actividad del receptor de glucagón, como se mide por la producción de AMPc usando el ensayo descrito en el Ejemplo 13, y sales farmacéuticamente aceptables de dicho péptido.
2. El péptido de la reivindicación 1, en el que la cadena de polietilenglicol tiene un peso molecular seleccionado del intervalo de 1.000 a 5.000 Dalton.
3. El péptido de la reivindicación 1, en el que la cadena de polietilenglicol tiene un peso molecular mayor de 5.000 Dalton, opcionalmente mayor de 10.000 Dalton.
4. El péptido de la reivindicación 1, en el que el aminoácido en la posición 12 es Arg y el aminoácido en la posición 17 es Lys.
5. El péptido de una cualquiera de las reivindicaciones 1 a 4, en el que el aminoácido C-terminal del péptido comprende un grupo amida en lugar del grupo de ácido carboxílico del aminoácido nativo.
6. El péptido de cualquiera de las reivindicaciones 1 a 5, en el que el aminoácido 29 del péptido está unido covalentemente con un segundo péptido que comprende una secuencia seleccionada del grupo que consiste en SEC ID Nº : 19, SEC ID Nº : 20 y SEC ID Nº : 21.
7. El péptido de la reivindicación 6, en donde el segundo péptido es SEC ID Nº : 19 y el aminoácido terminal del péptido comprende un grupo amida en lugar del grupo de ácido carboxílico del aminoácido nativo.
8. El péptido de una cualquiera de las reivindicaciones 1 a 7, que comprende una secuencia de aminoácidos de SEC ID Nº : 8.
9. Un multímero, opcionalmente un homodímero, en el que el multímero u homodímero comprenden dos o más péptidos de una cualquiera de las reivindicaciones anteriores unidos entre sí mediante un enlazador.
10. Una composición farmacéutica que comprende un péptido de una cualquiera de las reivindicaciones anteriores, un multímero de la reivindicación 9, o sal farmacéuticamente aceptable del mismo, y un vehículo farmacéuticamente aceptable.
11. La composición farmacéutica de la reivindicación 10, que comprende además insulina, para regular los niveles de glucosa en sangre en pacientes insulinodependientes.
12. La composición farmacéutica de la reivindicación 11, en donde la composición farmacéutica es una solución acuosa pre-formulada para el tratamiento de hipoglucemia, opcionalmente, estando la composición pre-envasada en una jeringa para administración parenteral.
13. Un kit adecuado para administrar un agonista de glucagón a un paciente que lo necesite, comprendiendo dicho kit un péptido o una composición de cualquiera de las reivindicaciones anteriores, instrucciones para su uso y opcionalmente una jeringa y una aguja, un recipiente o un dispositivo dosificador de aerosol, en donde la composición está pre-envasada dentro del dispositivo de aerosol.
14. El péptido o composición de una cualquiera de las reivindicaciones anteriores para uso en el tratamiento de la hipoglucemia, para inducir la parálisis temporal del tracto intestinal, o para reducir o mantener el peso corporal, opcionalmente, en donde el péptido está unido covalentemente con un PEG que tiene un peso molecular de más de
10.000 Dalton y opcionalmente en donde el péptido se usa junto con insulina.
Patentes similares o relacionadas:
Agonistas del receptor de glucagón, del 24 de Junio de 2020, de ELI LILLY AND COMPANY: Un compuesto agonista del receptor de glucagón que comprende la fórmula: YX1QGTFX2SDYSKYLDX3KKAX4EFVX5WLLEX6X7 en la que X1 es Aib; X2 es T o L; X3 es Aib; […]
Profármacos de GLP-1, del 17 de Junio de 2020, de NOVO NORDISK A/S: Un compuesto de GLP-1 de la fórmula general I: R1 -(NHXaa1)-Xaa2-(OHis)-(péptido GLP-1) (Fórmula I) en donde el péptido GLP-1 es […]
Coagonistas estables del receptor de GLP-1/glucagón basados en GLP-1, del 6 de Mayo de 2020, de NOVO NORDISK A/S: Un derivado de GLP-1 caracterizado por tener la fórmula: amida de Nε34-[2-[2-[2-[[2-[2-[2-[[(4S)-4-carboxi-4- [[(4S)-4-carboxi-4-(17- carboxiheptadecanoilamino)butanoil]amino]butanoil]amino]etoxi]etoxi]acetil]amino]etoxi]etoxi]acetil]- […]
Combinación de canrenoato y exenatida, del 8 de Abril de 2020, de Genesis Pharma SA: Una combinación que comprende un modulador de insulina, en donde el modulador de insulina es exenatida o una sal farmacéuticamente aceptable de la misma, y […]
Uso de péptidos GLP-1 de acción prolongada, del 8 de Abril de 2020, de NOVO NORDISK A/S: Una composición que comprende el agonista del GLP-1 semaglutida y uno o más excipientes farmacéuticamente aceptables para usar en la prevención o el tratamiento de la […]
Formulaciones liofilizadas, del 18 de Marzo de 2020, de GLAXOSMITHKLINE LLC: Un procedimiento de producción de una composición de polipéptido liofilizado que comprende: combinar un polipéptido con un aditivo volátil para formar una mezcla líquida […]
Tratamiento de diabetes mediante el uso de GLP-1 y anti-IL-21, del 4 de Marzo de 2020, de NOVO NORDISK A/S: Un agonista de GLP-1 y un inhibidor de la función de IL-21 para usar en un método para el tratamiento de la diabetes tipo 1, en donde dicho inhibidor de la función de […]
Composiciones sólidas que comprenden un agonista del GLP-1 y una sal del ácido N-(8-(2-hidroxibenzoil)amino)caprílico, del 4 de Marzo de 2020, de NOVO NORDISK A/S: Una composición sólida para administración oral que comprende semaglutida y una sal del ácido N-(8-(2- hidroxibenzoil)amino)caprílico, en donde dicha composición comprende […]