LA A-AMILASA DE TRICHODERMA REESEI FOMENTA LA SACARIFICACIÓN DE ALMIDÓN DE MAÍZ.
Un polipéptido aislado que comprende o se compone de (i) los restos 21 a 463 de la SEQ ID NO:
3 mostrada en la fig. 7B o (ii) una variante de la α-amilasa de Trichoderma reesei (TrAA), presentando la variante actividad α-amilasa y una identidad de secuencia de aminoácidos de al menos 90% con los restos 21 a 463 de la SEQ ID NO:3 mostrada en la fig. 7B.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/056597.
Solicitante: DANISCO US INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 925 PAGE MILL ROAD PALO ALTO, CA 94304 ESTADOS UNIDOS DE AMERICA.
Inventor/es: VAN SOLINGEN, PIETER, SHETTY, JAYARAMA K., DUAN,Gang, QIAN,Kathy, SCHEFFERS,Martijn.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N9/30 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › de origen fúngico.
PDF original: ES-2376064_T3.pdf
Fragmento de la descripción:
La a-amilasa de Trichoderma reesei fomenta la sacarificación de almidón de maíz
ANTECEDENTES
El jarabe de maíz con alto contenido en fructosa (HFCS) es una forma procesada del jarabe de maíz que presenta un alto contenido en fructosa y un dulzor comparable al del azúcar, lo que hace que el HFCS sea útil como sustituto de azúcar en refrescos y otros alimentos procesados. El HFCS supone actualmente una industria de mil millones de dólares. El proceso de producción de HFCS ha evolucionado a lo largo de los años desde la hidrólisis ácida hasta una secuencia de reacciones catalizadas por enzimas:
(1) Licuefacción: Las a-amilasas (EC 3.2.1.1) se usan primero para degradar una suspensión de almidón que contiene entre 30 y 40% p/p de sólidos secos (ss) a maltodextranos. Las a-amilasas son endohidrolasas que catalizan la rotura aleatoria de enlaces a-1, 4-D-glucosídicos internos. Puesto que la licuefacción se realiza típicamente a temperaturas elevadas, por ejemplo de 90 a 100º C, se prefieren para este paso a-amilasas termoestables, tales como una a-amilasa de Bacillus sp.
(2) Sacarificación: Habitualmente se usan glucoamilasas y/o a-amilasas maltogénicas para catalizar la hidrólisis de los extremos no reductores de los maltodextranos formados después de la licuefacción, liberando D-glucosa, maltosa e isomaltosa. Se pueden usar enzimas desramificantes, tales como la pululanasa, para apoyar la sacarificación. La sacarificación transcurre típicamente en condiciones ácidas y a temperaturas elevadas, por ejemplo a 60º C y pH 4, 3. Las glucoamilasas usadas en este proceso se obtienen típicamente de hongos, por ejemplo la glucoamilasa de Aspergillus niger (AnGA) usada en Optidex® LAOO o la glucoamilasa de Humicola grisea (HgGA) . Las a-amilasas maltogénicas usadas actualmente para esta aplicación incluyen amilasas de plantas y la aamilasa de Aspergillus or y zae, el ingrediente activo de Clarase® L. La sacarificación se puede usar para producir jarabes o bien con alto contenido en maltosa o bien ricos en glucosa.
(3) Isomerización: Un jarabe rico en glucosa se puede procesar posteriormente para producir fructosa si se desean productos más dulces. La isomerización de glucosa a fructosa es catalizada por la glucosa isomerasa y proporciona aproximadamente un 42% (p/v) de fructosa, entre 50 y 52% de glucosa y una mezcla de otros azúcares. Manipulaciones adicionales pueden proporcionar finalmente un HFCS de calidad comercial con un contenido en fructosa del 42%, 55% o 90%, por ejemplo.
Las a-amilasas y las glucoamilasas se añaden directamente a un lote de procesamiento del jarabe de maíz y no se reutilizan. Las glucosa isomerasa, por otra parte, se inmovilizan en columnas a través de las cuales se pasa la mezcla de azúcares. Las columnas con glucosa isomerasa se reutilizan hasta que las enzimas hayan perdido la mayor parte de su actividad.
El paso de sacarificación es el paso limitante de la velocidad de producción de HFCS. La sacarificación dura típicamente entre 48 y 72 horas, periodo durante el cual muchas glucoamilasas fúngicas han perdido actividad significativa. Además, aunque se pueden usar tanto las a-amilasas maltogénicas como las glucoamilasas para catalizar la sacarificación, las enzimas trabajan típicamente a diferentes pH y temperaturas óptimos. Por ejemplo, las a-amilasas maltogénicas presentan típicamente un pH óptimo de al menos pH 5, 0 y una temperatura óptima inferior a 55º C, mientras que la AnGA presenta típicamente un pH óptimo de pH 4, 0 a 4, 5 y una temperatura óptima de aproximadamente 60º C. La diferencia en las condiciones de reacción entre las dos enzimas requiere ajustar el pH y la temperatura, lo que ralentiza el proceso global y puede dar lugar a la formación de agregados de amilosa insolubles. Cualquier a-amilasa bacteriana residual se inactivará si se baja el pH; sin embargo, la a-amilasa bacteriana se puede sustituir posteriormente por una a-amilasa estable a ácido.
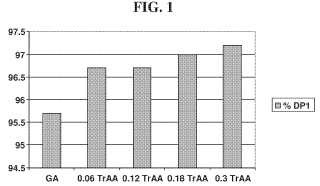
De forma ideal, el paso de sacarificación proporciona un jarabe con una composición de aproximadamente 95 a 97% p/p de glucosa, 1 a 2% p/p de maltosa y 0, 5 a 2% p/p de isomaltosa. Este jarabe rico en glucosa se puede usar en la reacción de isomerización (paso (3) anterior) o bien se puede usar para la producción de glucosa cristalina. Estas concentraciones tan elevadas de glucosa no son fáciles de conseguir. Por ejemplo, la glucoamilasa de Trichoderma reesei (TrGA) ofrece una actividad específica mejorada en relación con AnGA o HgGA; sin embargo, la TrGA proporciona un producto que presenta típicamente una concentración final de glucosa de aproximadamente 88% p/v. Además, las concentraciones elevadas de glucosa en el jarabe promueven la conversión de glucosa en maltosa y maltotriosa.
Por consiguiente, existe en la técnica la demanda de un procedimiento mejorado para preparar HFCS que incluya un paso de sacarificación que use una a-amilasa con un pH óptimo y una temperatura óptima compatibles con el uso de glucoamilasas fúngicas. Existe además la demanda de una a-amilasa que pueda catalizar la sacarificación en menos tiempo. Asimismo existe la demanda de una a-amilasa que pueda lograr estos objetivos produciendo al mismo tiempo, después de la sacarificación, un jarabe que presente una concentración de glucosa de aproximadamente 96% p/p.
RESUMEN
Estas y otras demandas de la técnica se satisfacen mediante una a-amilasa maltogénica de Trichoderma reesei (TrAA) . Se proporcionan la enzima, variantes de la enzima y ácidos nucleicos codificantes. Igualmente se proporcionan células huésped que expresan la TrAA.
La TrAA se usa ventajosamente en diversos procesos, en particular en la sacarificación de maltodextranos formados después de la licuefacción. En una realización, una TrAA se usa en un proceso de producción de maltosa, bien sola o bien en combinación con otras enzimas, tales como la pululanasa. La TrAA cataliza ventajosamente la producción de maltosa a un pH relativamente bajo y una temperatura elevada, lo que permite el uso de condiciones de reacción compatibles con las glucoamilasas fúngicas, por ejemplo la AnGA. Además, la facilidad con la que se produce la TrAA la hace más económica que las a-amilasas usadas actualmente para la producción de maltosa.
En otra realización, la TrAA se usa en un proceso de sacarificación que produce una concentración elevada de glucosa. La TrAA suprime ventajosamente la reacción inversa que forma maltooligosacáridos a partir de glucosa, lo que permite alcanzar concentraciones de glucosa en una mezcla de almidón de maíz procesada tan altas como aproximadamente 96% p/v. Además, esta concentración de glucosa se puede alcanzar en menos tiempo que catalizando la reacción con solo una glucoamilasa. En una realización, se añade una glucoamilasa con la TrAA. La glucoamilasa puede ser una glucoamilasa fúngica, tal como TrGA, o se puede añadir una mezcla de glucoamilasas, por ejemplo una combinación de TrGA, HgGA y AnGA.
Por consiguiente, un objetivo es proporcionar un polipéptido aislado que comprenda (i) los residuos 21 a 463 de la SEQ ID NO:3; o (ii) una variante de la a-amilasa de Trichoderma reesei (TrAA) , presentando la variante actividad a-amilasa y al menos una identidad de secuencia de aminoácidos con los residuos 21 a 463 de la SEQ ID NO:3. Por ejemplo, la variante puede presentar entre 1 y 10 sustituciones, inserciones o deleciones de aminoácidos en comparación con los residuos 21 a 463 de la SEQ ID NO:3. De forma alternativa, el polipéptido puede comprender la secuencia SEQ ID NO:3 o los residuos 21 a 463 de la SEQ ID NO:3, es decir, la secuencia polipeptídica madura sin la secuencia señal. El polipéptido puede comprender una secuencia señal de una especie distinta de Trichoderma reesei. En una realización, el polipéptido está glucosilado. El polipéptido aislado se puede purificar adicionalmente.
Otro objetivo es proporcionar un polinucleótido que codifique el polipéptido anterior. El polinucleótido puede comprender la SEQ ID NO:2, es decir, una secuencia de ADNc. También se proporciona un ARNm aislado, en el que los restos T de la SEQ ID NO:2 están sustituidos por restos U (uracilo) .
Otro objetivo es proporcionar un vector que comprenda el polinucleótido anterior y una célula bacteriana que comprenda este vector. También se proporciona una célula huésped que expresa el polinucleótido, siendo la célula huésped en una realización un Trichoderma sp., en particular T. reesei. El huésped puede ser alternativamente un aislado RL-P37, una célula de hongo filamentoso, un Aspergillus sp., un Fusarium... [Seguir leyendo]
Reivindicaciones:
2. El polipéptido aislado de la reivindicación 1, en el que dicha variante presenta una identidad de secuencia de al menos 95% con los restos 21 a 463 de la SEQ ID NO:3 mostrada en la fig. 7B. 3. El polipéptido aislado de la reivindicación 1, en el que la variante presenta entre 1 y 10 sustituciones, inserciones o deleciones de aminoácidos en comparación con los restos 21 a 463 de la SEQ ID NO:3 mostrada en la fig. 7B. 4. El polipéptido aislado de la reivindicación 1 que comprende la SEQ ID NO:3 mostrada en la fig. 7B. 5. Un polinucleótido que codifica un polipéptido de acuerdo con una cualquiera de las reivindicaciones 1 a 4. 6. El polinucleótido de la reivindicación 5 que comprende la SEQ ID NO:2 mostrada en la fig. 7A. 7. Un vector que comprende el polinucleótido de la reivindicación 5 o la reivindicación 6. 8. Una célula huésped que comprende el vector de la reivindicación 7 o expresa el polinucleótido de la reivindicación 5 o la reivindicación 6 y, opcionalmente, expresa además un ácido nucleico que codifica una glucoamilasa heteróloga. 9. La célula huésped de la reivindicación 8, en la que la célula huésped es una célula bacteriana, un Trichoderma sp., un aislado de RL-P37, una célula de hongo filamentoso, un Aspergillus sp., un Fusarium sp. o un Penicillium sp. 10. Un procedimiento para la sacarificación de almidón licuado para producir un jarabe rico en glucosa, que comprende: añadir un polipéptido de acuerdo con una cualquiera de las reivindicaciones 1 a 4 a una solución de almidón licuado, añadir una glucoamilasa a la solución de almidón licuado y sacarificar la solución de almidón licuado, en el que dicha sacarificación de la solución de almidón licuado produce un jarabe rico en glucosa. 11. El procedimiento de la reivindicación 10, en el que dicho polipéptido se añade a la solución de almidón licuado en una cantidad de aproximadamente 0, 3 a 1 kg por tonelada métrica de sólidos secos. 12. El procedimiento de la reivindicación 10, en el que la solución de almidón licuado es una suspensión de almidón licuado de aproximadamente 20 a 35% p/p de sólidos secos. 13. Una composición para el procesamiento de almidón que comprende el polipéptido de una cualquiera de las reivindicaciones 1 a 4. 14. Un procedimiento de horneado que comprende la adición del polipéptido de una cualquiera de las reivindicaciones 1 a 4 a una sustancia que se ha de hornear y el horneado de la sustancia. 15. Un procedimiento para desencolar productos textiles, que comprende poner el polipéptido de una cualquiera de las reivindicaciones 1 a 4 en contacto con un producto textil durante un tiempo suficiente para desencolar el producto textil. Un polipéptido aislado que comprende o se compone de (i) los restos 21 a 463 de la SEQ ID NO:3 mostrada en la fig. 7B o (ii) una variante de la a-amilasa de Trichoderma reesei (TrAA) , presentando la variante actividad a-amilasa y una identidad de secuencia de aminoácidos de al menos 90% con los restos 21 a 463 de la SEQ ID NO:3 mostrada en la fig. 7B.
Patentes similares o relacionadas:
Variantes de alfa-amilasa y polinucleótidos que codifican las mismas, del 20 de Marzo de 2019, de NOVOZYMES A/S: Variante de alfa-amilasa o fragmento de la misma que tiene una termoestabilidad mejorada, medida como la actividad de amilasa residual después de la incubación […]
Polipéptidos con actividad glucoamilasa y polinucleótidos que los codifican, del 6 de Septiembre de 2017, de NOVOZYMES A/S: Polipéptido aislado que posee actividad glucoamilasa, seleccionado del grupo que consiste en: a) un polipéptido que comprende una secuencia de aminoácidos que presenta al […]
Composiciones que comprenden enzimas con actividad de endo-1,4-beta-xilanasa y enzimas con actividad de endo-1,3(4)-beta-glucanasa, del 16 de Agosto de 2017, de Dupont Nutrition Biosciences ApS: Una composición que comprende una enzima que exhibe actividad de endo-1,4-ß-xilanasa, enzima que comprende un secuencia de aminoácidos que […]
Polipéptidos con actividad de alfa-amilasa y polinucleótidos que codifican los mismos, del 22 de Marzo de 2017, de NOVOZYMES A/S: Polipéptido aislado con actividad de alfa-amilasa, seleccionado del grupo que consiste en: un polipéptido con al menos 90 %, al menos 91 %, al menos 92 %, al menos […]
Enzimas para tratamiento de almidón, del 1 de Marzo de 2017, de NOVOZYMES A/S: Polipéptido híbrido que comprende una primera secuencia de aminoácidos que comprende un módulo catalítico con actividad de alfa-amilasa y una […]
Compuestos flavonoides glicosilados, del 14 de Septiembre de 2016, de SUNTORY HOLDINGS LIMITED: Un compuesto que se selecciona del grupo que consiste en: 3-O-galato de 5-O-a6alpha;-D-glucopiranosil- -epigalocatequina; 3-O-galato […]
Método para producir un compuesto de interés en una célula fúngica filamentosa, del 10 de Agosto de 2016, de DSM IP ASSETS B.V.: Un método para producir una secuencia de nucleótidos que comprende las etapas de: - proporcionar una secuencia codificadora de nucleótidos […]
Procesos para producir productos de fermentación, del 24 de Febrero de 2016, de NOVOZYMES A/S: Proceso para producir productos de fermentación a partir de material que contiene almidón que incluye las etapas de: i) licuefacción del material que contiene […]