ALFA GLUCOSIDASA ACIDA Y FRAGMENTOS DE LA MISMA.
Una proteína de fusión terapéutica dirigida que comprende un agente terapéutico que comprende los restos aminoacídicos 70-952 de la GAA humana,
estando los restos 1-69 delecionados y un marcador peptídico, en el que el marcador peptídico se une directa o indirectamente al resto aminoacídico 70 de la GAA humana y dicho marcador comprende el resto 1 del IGF-II seguido por los restos 8-67, estando los restos 2-7 delecionados
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/004286.
Solicitante: ZYSTOR THERAPEUTICS , INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 10437 INNOVATION DRIVE, SUITE 100,MILWAUKEE, WI 53226-4838.
Inventor/es: LEBOWITZ,JONATHAN, MAGA,JOHN.
Fecha de Publicación: .
Fecha Concesión Europea: 21 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K38/47 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que actúan sobre compuestos glicosílicos (3.2), p. ej. celulosas, lactasas.
- C12N9/26 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre enlaces alfa-glucosídicos-1, 4, p. ej. hialuronidasa, invertasa, amilasa.
Clasificación PCT:
- C12N9/24 C12N 9/00 […] › actúan sobre compuestos glicosílicos (3.2).
Clasificación antigua:
- C12N9/24 C12N 9/00 […] › actúan sobre compuestos glicosílicos (3.2).
Fragmento de la descripción:
Alfa glucosidasa ácida y fragmentos de la misma.
Referencia con solicitudes relacionadas
La presente solicitud reivindica el beneficio del documento de Estados Unidos Nº de Serie 60/543.812 presentado el 10 de febrero de 2004.
Antecedentes
La alfa glucosidasa ácida (GAA) es una enzima lisosomal que hidroliza el enlace alfa 1-4 en maltosa y otros oligosacáridos lineales, incluyendo las ramificaciones externas del glucógeno, degradando de esta manera el exceso de glucógeno en el lisosoma (Hirschhorn y col. (2001) en The Metabolic and Molecular Basis of Inherited Disease, Scriver, y col., eds. (2001), McGraw-Hill: Nueva York, págs. 3389-3420). Al igual que otras enzimas lisosomales de mamíferos, la GAA se sintetiza en el citosol y atraviesa el RE donde se glicosila con carbohidratos de tipo alto contenido en manosa, unidos a N. En el aparato de Golgi, el carbohidrato de alto contenido en manosa se modifica en proteínas lisosomales por la adición de manosa-6-fosfato (M6P) que dirige estas proteínas al lisosoma. Las proteínas modificadas con M6P se suministran al lisosoma mediante la interacción con cada uno de dos receptores de M6P. La forma de modificación más favorable es cuando se añaden dos M6P a un carbohidrato de alto contenido en manosa.
La actividad de GAA insuficiente en el lisosoma da como resultado la enfermedad de Pompe, una enfermedad también conocida como deficiencia de maltasa ácida (AMD), enfermedad de almacenamiento de glucógeno de tipo II (GSDII), glucogénesis de tipo II o deficiencia de GAA. La actividad enzimática disminuida se produce debido a una diversidad de mutaciones erróneas y sin sentido en el gen que codifica la GAA. Por consiguiente, el glucógeno se acumula en los lisosomas de todas las células en pacientes con la enfermedad de Pompe. En particular, la acumulación de glucógeno es más pronunciada en los lisosomas del músculo cardiaco y esquelético, hígado y otros tejidos. El glucógeno acumulado en última instancia perjudica la función muscular. En las formas más graves de la enfermedad de Pompe, la muerte se produce después de dos años de edad debido a fallos cardiorrespiratorios.
Actualmente, no se ha aprobado ningún tratamiento disponible para curar o retrasar el progreso de la enfermedad de Pompe. Las terapias de reemplazo enzimático actualmente en ensayos clínicos requieren que las células del los tejidos muscular y hepático capten la GAA administrada recombinante y se transporten a los lisosomas en estas células de una manera dependiente de M6P. Sin embargo, la GAA recombinante producida en células CHO modificadas por ingeniería genética y en la leche de conejos transgénicos, dos fuentes de enzimas usadas en ensayos recientes de terapia de reemplazo enzimático de Pompe, contiene muy poca M6P (Van Hove y col. (1996) Proc Natl Acad Sci USA, 93 (1): 65-70; y en la Patente de Estados Unidos Nº 6.537.785). Por lo tanto, el suministro dependiente de M6P de la GAA recombinante a los lisosomas no es eficaz, necesitando dosis elevadas e infusiones frecuentes. Por consiguiente, sigue existiendo una necesidad de procedimientos nuevos, más simples, más eficaces y más rentables para dirigir la enzima GAA terapéutica a los lisosomas de los pacientes.
Sumario de la invención
La presente invención permite el direccionamiento independiente de MP6 de las enzimas GAA o de tipo GAA humanas a los lisosomas del paciente usando una estrategia de direccionamiento basada en marcadores peptídicos. Como resultado, la presente invención proporciona el suministro eficaz de las enzimas GAA o de tipo GAA hacia las células diana.
La invención se refiere, en parte, al descubrimiento de que la GAA puede expresarse de manera recombinante usando una pluralidad de fases de lectura abierta que codifican polipéptidos que representan diferentes partes de la proteína GAA. Cuando se proporcionan juntas, los polipéptidos resultantes pueden cooperar para proporcionar la actividad enzimática deseada.
Por consiguiente, la presente invención se refiere en un aspecto a una proteína de fusión terapéutica dirigida como se define en las reivindicaciones.
Breve descripción de los dibujos
Las Figuras 1-1 a 1-14 representan un alineamiento de secuencias de aminoácidos de los miembros seleccionados de 31 familias de glucósido hidrolasas.
La Figura 2 es una representación esquemática de la proteína GAA.
La Figura 3 representa estrategias ejemplares para la creación de una GAA marcada con péptidos.
La Figura 4 representa un experimento de captación ejemplar usando GAA de tipo silvestre y SS-GAA?1-69.
La Figura 5 representa un experimento de captación ejemplar usando SS-GAA?1-69 y SS-GILT?2-7-GAA?1-69.
La Figura 6 representa un análisis de transferencia de Western ejemplar de las proteínas GAA marcadas con 1-87-IGF-II; el panel de la izquierda se probó con un anticuerpo anti-GAA; el panel de la derecha se probó con un anticuerpo anti-IGF-II. Carril 1: pCEP-GILT1-87-GAA56-952; carril 2: pCEP-GILT1-87-R68A-GAA56-952-1; carril 3: pCEP-GILT1-87-R68A-?GS-GAA56-952-1; carril 4: pCEP-GILT?2-7-spcr1-GAA70-952-1; carril 5: pCEP-GAA; carril 6: pCEP-GILT-GAA29-952.
La Figura 7 representa un análisis de transferencia de Western ejemplar comparando la proteolisis de la GAA de tipo silvestre con la GAA-791Asc.
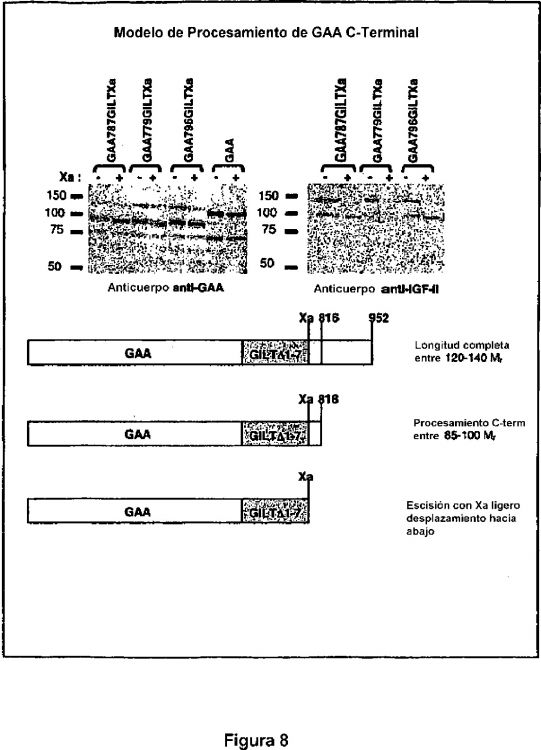
La Figura 8 representa un análisis de transferencia de Western ejemplar de construcciones de la GAA de tipo silvestre y de la GAA con un marcador GILT modificado por ingeniería genética con un sitio proteasa de Factor X corriente abajo, GAA787GILTXa, GAA779GILTXa y GAA796GILTXa. También representa un modelo de procesamiento de GAA C-terminal.
Descripción detallada de la invención
La presente invención proporciona un medio para la producción de GAA que es más eficaz dirigiendo a los lisosomas de las células de mamíferos, por ejemplo, células del músculo cardíaco y esquelético humano. La GAA es un miembro de 31 familias de glucósido hidrolasas (Figuras 1-1 a 1-14). La GAA humana se sintetiza como un precursor de 110 kDal (Wisselaar y col. (1993) J. Biol. Chem. 268 (3): 2223-31). La forma madura de la enzima es una mezcla de monómeros de 70 y 76 kDal (Wisselaar y col. (1993) J. Biol. Chem. 268(3): 2223-31). La enzima precursora tiene siete sitios potenciales de glicosilación y cuatro de éstos se conservan en la enzima madura (Wisselaar y col. (1993) J. Biol. Chem. 268(3): 2223-31). Los eventos de escisión proteolítica que producen la enzima madura ocurren en endosomas tardíos o en el lisosoma (Wisselaar y col. (1993) J. Biol. Chem. 268(3): 2223-31).
Los 160 aminoácidos C-terminal no se encuentran en la especie madura de 70 y 76 kDal. Sin embargo, determinados alelos de Pompe que dan como resultado la pérdida completa de la actividad de GAA mapean en esta región, por ejemplo Val949Asp (Becker y col. (1998) J. Hum. Genet. 62: 991). El fenotipo de este mutante indica que la parte C-terminal de la proteína, aunque no la parte de la especie de 70 ó 76 kDal, desempeña un papel importante en la función de la proteína. Se ha descrito recientemente que la parte C-terminal de la proteína, aunque se escinde del resto de la proteína durante el procesamiento, permanece asociada con la especie principal (Moreland y col. (1 de nov, 2004) J. Biol. Chem., Manuscript 404008200). Por consiguiente, los restos C-terminal podrían desempeñar una función directa en la actividad catalítica de la proteína. De manera alternativa, los restos C-terminal pueden estar implicados en promover el plegamiento adecuado de las partes N-terminal de la proteína.
Esta última posibilidad se sustenta por el comportamiento de determinados alelos de sacarasa-isomaltasa, una proteína relacionada. Esta familia incluye la proteína sacarasa-isomaltasa (SI) que contiene los dos dominios catalíticos glucósido hidrolasa homólogos, pero distintos, en tándem en un sólo polipéptido. Cada uno de éstos es similar en tamaño al polipéptido GAA completo y los dos dominios comparten una identidad del 36 y del 39% con GAA. La SI se expresa en las células intestinales de borde en cepillo y se localiza en la membrana apical de estas células polarizadas con los dominios catalíticos orientados hacia el lumen intestinal debido a un dominio transmembrana amino-terminal. Una vez que llega a la membrana apical, el dominio sacarasa se escinde del dominio isomaltasa amino-proximal por tripsina, mientras que el dominio isomaltasa permanece asociado a la membrana. Recientes estudios indican que el dominio sacarasa es necesario para el plegamiento adecuado...
Reivindicaciones:
1. Una proteína de fusión terapéutica dirigida que comprende un agente terapéutico que comprende los restos aminoacídicos 70-952 de la GAA humana, estando los restos 1-69 delecionados y un marcador peptídico, en el que el marcador peptídico se une directa o indirectamente al resto aminoacídico 70 de la GAA humana y dicho marcador comprende el resto 1 del IGF-II seguido por los restos 8-67, estando los restos 2-7 delecionados.
2. El terapéutico dirigido de la reivindicación 1 que comprende adicionalmente un espaciador entre el agente terapéutico y el marcador peptídico.
3. El terapéutico dirigido de la reivindicación 2 en el que el espaciador es un engarce Gly-Ala-Pro.
4. El terapéutico dirigido de una cualquiera de las reivindicaciones anteriores para su uso en el tratamiento de la enfermedad de Pompe.
Patentes similares o relacionadas:
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Composiciones farmacéuticas para uso tópico basadas en ácido hialurónico sulfatado como promotor de absorción de la piel, del 1 de Julio de 2020, de FIDIA FARMACEUTICI S.P.A.: Una composición farmacéutica para uso tópico que contiene ácido hialurónico sulfatado como promotor de absorción de la piel de diclofenaco, ketoprofeno, ibuprofeno […]
Compuestos para el tratamiento de Trastornos Neuropsiquiátricos, del 24 de Junio de 2020, de Curemark LLC: Una composición que comprende enzimas digestivas para uso en el tratamiento del Trastorno Esquizofreniforme, en donde las enzimas digestivas comprenden amilasa, lipasa […]
Tratamiento de glucogenosis de tipo II, del 20 de Mayo de 2020, de DUKE UNIVERSITY: α-Glucosidasa ácida (GAA) humana recombinante producida en un cultivo de células de ovario de hámster chino para uso en un método de tratamiento de glucogenosis […]
Regímenes de dosificación para el tratamiento de la enfermedad de Fabry, del 22 de Abril de 2020, de AMICUS THERAPEUTICS, INC: 1-desoxigalactonojirimicina para su uso en el tratamiento de enfermedad de Fabry, en donde el tratamiento comprende administrar a un paciente desde aproximadamente 50 mg hasta […]
Reticuladores químicos, del 22 de Abril de 2020, de AMICUS THERAPEUTICS, INC: Un método de realización de un péptido de direccionamiento lisosomal modificado que comprende: a. poner en contacto el factor de crecimiento similar […]
Proteína, del 18 de Diciembre de 2019, de Dupont Nutrition Biosciences ApS: Un polipéptido aislado que presenta actividad de xilanasa, seleccionado del grupo que consiste en: (a) un polipéptido que comprende una secuencia de aminoácido que tiene […]
Composiciones de alfa-galactosidasa, del 18 de Diciembre de 2019, de PROTALIX LTD. (100.0%): Una proteína α-galactosidasa humana que comprende una glicina como el resto N-terminal en donde dicha proteína α-galactosidasa humana se fusiona traduccionalmente […]