USO DE INHIBIDORES DE IL-18 PARA EL TRATAMIENTO O PREVENCION DE LA SEPSIS.
El uso de un inhibidor de IL-18 en la fabricación de un medicamento para el tratamiento y/o la prevención de disfunción cardíaca relacionada con sepsis,
en donde el inhibidor se selecciona a partir de anticuerpos contra IL-18 y las proteínas de unión a IL-18, IL-18BPa e IL-18BPc
Tipo: Resumen de patente/invención. Número de Solicitud: W0215556US.
Solicitante: YEDA RESEARCH AND DEVELOPMENT CO. LTD..
Nacionalidad solicitante: Israel.
Dirección: WEIZMANN INSTITUTE OF SCIENCE P.O. BOX 95,76100 REHOVOT.
Inventor/es: NOVICK, DANIELA, RUBINSTEIN, MENACHEM, KIM, SOO-HYUN, REZNIKOV,LEONID, SCHWARTSBURD,BORIS, FANTUZZI,GIAMILA, DINARELLO,CHARLES,A.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61K38/17C
- A61K38/21 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Interferones.
- A61K38/55 A61K 38/00 […] › Inhibidores de proteasas.
- A61K47/48H4P
- C07K16/24F
- C07K16/28H
Clasificación PCT:
- A61K38/17 A61K 38/00 […] › que provienen de animales; que provienen de humanos.
- A61K39/395 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- A61P31/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos.
Clasificación antigua:
- A61K38/00 A61K […] › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K39/00 A61K […] › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/85 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › para células animales.
Fragmento de la descripción:
Uso de inhibidores de IL-18 para el tratamiento o prevención de la sepsis.
Campo de la invención
La siguiente solicitud reivindica los beneficios de la Solicitud Provisional de los EE.UU. Nº 60/291.463 presentada el 16 de mayo de 2001.
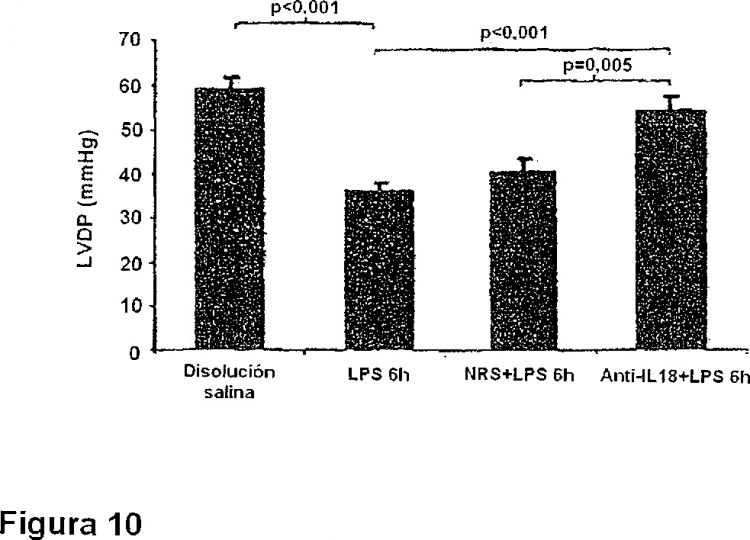
La presente invención se refiere al uso de inhibidores de IL-18 para el tratamiento y/o la prevención de la disfunción cardíaca relacionada con sepsis.
Antecedentes de la invención
En 1989 se detectó un factor inducido en el suero procedente de ratones infectados con mycobacterium bovis y expuestos a LPS. Este factor fue capaz de inducir interferón ? (IFN-?) en cultivos de células de bazo de ratones normales en presencia de interleuquina-2 (IL-2) (Nakamura y col., 1989). Este factor no funcionó como un inductor directo de IFN-? sino más bien como un co-estimulante junto con IL-2, anti-CD3 o mitógenos. Un intento por identificar mejor esta actividad de suero de ratón tratado con post-endotoxina reveló una proteína de 50-55 kDa aparentemente homogénea, asociada a la anterior actividad (Nakamura y col., 1993). Puesto que otras citoquinas pueden actuar como co-estimulantes para la producción de IFN-?, el fallo de los anticuerpos neutralizantes de IL-1, IL-4, IL-5, IL-6 ó TNF en el bloqueo de la actividad en suero sugería que se trataba de un factor distinto. Los mismos autores documentaron que el co-estimulante inducido por endotoxina para la producción de IFN-? estaba presente en extractos de hígado de ratones preacondicionados con P. acnes (Okamura y col., 1995). De acuerdo con este modelo experimental, la población de macrófagos hepáticos (células Kupffer) se expande, y por tanto una dosis baja de lipopolisacáridos bacterianos (LPS) se vuelve letal. Un tratamiento similar no es letal para ratones no preacondicionados. El factor, denominado factor inductor de IFN-? (IGIF) y posteriormente designado como interleuquina-18 (IL-18), fue purificado hasta homogeneidad a partir de hígados de ratón tratados con P. acnes y se obtuvo una secuencia parcial de aminoácidos. Se usaron oligonucleótidos degenerados derivados de secuencias de aminoácidos de IL-18 purificada para clonar un ADNc de IL-18 murino (Okamura y col., 1995). La secuencia de ADNc humano para la IL-18 se publicó en 1996 (Ushio y col., 1996).
La interleuquina IL-18 (Tsutsui y col., 1996, Nakamura y col., 1993, Okamura y col., 1995, Ushio y col., 1996), comparte características estructurales con la familia de proteínas IL-1 (Bazan y col., 1996), que tiene un estructura de lámina de pliegue ß diferente a la de la mayoría de las citoquinas, que exhiben una estructura de haz de cuatro hélices. De forma similar a la IL-1ß, la IL-18 se sintetiza como un precursor biológicamente inactivo (proIL-18) y carece de péptido señal (Ushio y col., 1996). Los precursores de IL-1ß e IL-18 son atacados por caspasa 1 (enzima convertidora de IL-1ß, o ICE), que ataca a los precursores justo detrás de un residuo de ácido aspártico en la posición P1. Las citoquinas maduras resultantes son liberadas de la célula (Ghayur y col., 1997, y Gu y col., 1997), a pesar de la falta de péptido señal.
Se sabe que la IL-18 actúa como co-estimulante en la producción de citoquinas (IFN-?, IL-2 y factor estimulante de colonia de granulocito-macrófagos) mediante células T colaboradoras tipo 1 (Th1) (Kohnoet y col., 1997) y también como co-estimulante para la citotoxicidad mediada por ligando mediante clones de células asesinas naturales murinas (Tsutsui y col., 1996).
La interleuquina-12 (IL-12) es una citoquinas inmunorreguladora producida mediante monocito/macrófagos y otras células presentadoras de antígenos. Es básica en la orquestación de inmunorrespuestas mediadas por células tanto innatas como adquiridas (Trinchieri, 1998). Consiste en un heterodímero compuesto de los productos ligados covalentemente de dos genes separados: una cadena pesada (p40) y una cadena ligera (p35). La producción de IL-12 se estimula en respuesta a determinadas bacterias, productos bacterianos, parásitos intracelulares y virus. Las siguientes funciones se han atribuido a IL-12: 1) es un potente inductor de IFN-? a partir de células T y células asesinas naturales (NK), 2) es co-mitogénica para dichas células, 3) es crítica para el desarrollo de respuesta Th1 en la mayoría de los sistemas (conduciendo de este modo y de forma secundaria a aumentos en la producción de IFN-? y TNF, a la activación de macrófagos, etc.), 4) potencia los linfocitos T citotóxicos y la citotoxicidad de células NK, y 5) es necesaria para respuestas de hipersensibilidad de tipo retardado. Se demostró que la producción de IL-12 en leucocitos esplénicos murinos aislados tratados con la cepa Cowan 1 de Staphylococcus aureus se veía suprimida por IFN-a ó IFN-ß (Karp y col., 2000).
Recientemente se ha publicado que la IL-12 está implicada en la patogénesis de enfermedades inflamatorias autoinmunes específicas de órgano tales como la esclerosis múltiple (MS) (Karp y col., 2000) y la enfermedad inflamatoria del intestino (IBD) (Blumberg y Strober, 2001, y Fiocchi, 1999), y por tanto es considerada como una diana potencial para fármacos en el tratamiento de estas afecciones.
La IL-18 y la IL-12 exhiben un marcado sinergismo en la inducción de IFN-? en células T (Okamura y col., 1998). La investigaciones sobre el mecanismo de este sinergismo han revelado que la IL-12 regula al alza la expresión de ambas cadenas del receptor de IL-18 en células productoras de IFN-? (Kim y col., 2001). Aunque la IL-12 y la IL-18 activan la inmunidad tanto innata como inducida, una producción excesiva mediante macrófagos activados puede inducir múltiples trastornos en órganos, incluyendo la malfunción del sistema inmune (Seki y col., 2000).
Las proteínas de unión de citoquina (receptores de citoquina solubles) normalmente son los dominios de unión de ligando extracelular de sus respectivos receptores de citoquina de superficie celular. Se producen mediante división alternativa o mediante ruptura proteolítica del receptor de superficie celular. Estos receptores solubles se han descrito en el pasado: por ejemplo, los receptores solubles para IL-6 e IFN-? (Novick y col., 1989), TNF (Engelmann y col., 1989, y Engelmann y col., 1990), IL-1 e IL-4 (Maliszewski y col., 1990) e IFN-a/ß (Novick y col., 1994, Novick y col., 1992). Una proteína de unión de citoquina, denominada osteoprotegerina (OPG, también conocida como factor inhibidor de osteoclasto, OCIF), un miembro de la familia TNFR/Fas, parece ser el primer ejemplo de un receptor soluble que existe sólo como proteína secretada (Anderson y col., 1997, Simonet y col., 1997, Yasuda y col., 1998).
Se purificó mediante afinidad una proteína de unión de interleuquina-18 (IL-18BP) en una columna de IL-18, a partir de orina (Novick y col., 1999). La IL-18BP elimina la inducción de IL-18 de IFN-?, y la activación de IL-18 de NF-kB in vitro. Además, la IL-18BP inhibe la inducción de IFN-? en ratones inyectados con LPS. El gen de IL-18BP se localizó en el cromosoma humano 11, y no se pudo descubrir ningún exón que codifique para un dominio transmembrana en la secuencia genómica de 8,3 kb que comprende el gen de IL-18BP. Hasta la fecha se han descubierto cuatro isoformas de IL-18BP generada mediante división alternativa de ARNm en humanos. Se designaron como IL-18BP a, b, c y d, compartiendo todas ellas el mismo extremo N y diferenciándose en el extremo C (Novick y col., 1999). Estas isoformas varían en su capacidad para unirse a IL-18 (Kim y col., 2000). De las cuatro isoformas de IL-18BP humanas (hIL-18BP), se sabe que la a y la c tienen una capacidad de neutralización de IL-18. La isoforma de IL-18BP más abundante, la variante de división isoforma a, exhibe una elevada afinidad por la IL-18 con un rápido inicio y un lento decaimiento, y una constante de disociación (Kd) de aproximadamente 0,4 nM (Kim y col., 2000). La IL-18BP se expresa de forma constitutiva en el bazo, y pertenece a la superfamilia de las inmunoglobulinas. Los residuos implicados en la interacción de IL-18 con IL-18BP han sido descritos mediante el uso de modelización computerizada (Kim y col., 2000) y en base a la interacción entre la proteína similar IL-1ß y la IL-1R de tipo I (Vigers y col., 1997). De acuerdo con el modelo de la IL-18 que se une a la IL-18BP, el residuo Glu de la posición 42 y el residuo Lys de la posición 89 de la IL-18 han sido propuestos como uniones con el Lys-130 y el Glu-114 de la IL-18BP, respectivamente (Kim y col., 2000).
La IL-18BP está presente constitutivamente en muchas células (Puren y col., 1999) y circula en humanos saludables (Urushihara...
Reivindicaciones:
1. El uso de un inhibidor de IL-18 en la fabricación de un medicamento para el tratamiento y/o la prevención de disfunción cardíaca relacionada con sepsis, en donde el inhibidor se selecciona a partir de anticuerpos contra IL-18 y las proteínas de unión a IL-18, IL-18BPa e IL-18BPc.
2. El uso de acuerdo con la reivindicación 1, en el que la proteína de unión a IL-18 está conjugada con PEG.
3. El uso de acuerdo con la reivindicación 1, en el que el inhibidor de IL-18 es un anticuerpo específico anti-IL-18 seleccionado entre anticuerpos quiméricos, humanizados y humanos.
4. El uso de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que el medicamento comprende además un inhibidor de una citoquina, en donde la citoquina se selecciona entre factor a (TNF-a) e IL-1ß, y en donde dicho inhibidor de TNF-a es la porción soluble de TNFRI o de TNFRII y el inhibidor de IL-1ß es el antagonista de receptor de IL-1.
5. El uso de un vector de expresión que comprende la secuencia de codificación de un inhibidor de IL-18 seleccionado entre anticuerpos contra IL-18, y las proteínas de unión a IL-18 IL-18BPa e IL-18BPc, en la fabricación de un medicamento para el tratamiento y/o la prevención de disfunción cardíaca relacionada con sepsis.
6. El uso de un vector de expresión, que se define como en la reivindicación 5, para la fabricación de un medicamento para el tratamiento y/o la prevención de la disfunción cardíaca relacionada con sepsis mediante terapia génica.
7. El uso de una célula que ha sido modificada genéticamente para producir un inhibidor de IL-18 seleccionado entre anticuerpos contra IL-18 y las proteínas de unión de IL-18 IL-18BPa e IL-18BPc en la fabricación de un medicamento para el tratamiento y/o la prevención de la disfunción cardíaca relacionada con sepsis.
Patentes similares o relacionadas:
INHIBIDORES DE LA CASPASA 1 PARA USO EN EL TRATAMIENTO DE LA ANEMIA, del 2 de Julio de 2020, de UNIVERSIDAD DE MURCIA: La presente invención se refiere a una composición que comprende al menos un inhibidor de caspasa-1 para su uso en un método de tratamiento de una enfermedad […]
Composición farmacéutica para el tratamiento o la paliación de pacientes con cáncer ancianos o en estado terminal, del 6 de Mayo de 2020, de Delta-Fly Pharma, Inc: Una composición farmacéutica para su uso en el tratamiento de cáncer, que comprende, como principio activo, ácido (2S)-2-(2S,3R)-3-amino-2-hidroxi-4-fenilbutanoilamino]-4-metilpentanoico […]
Nuevo tripéptido, del 19 de Febrero de 2020, de SUNSTAR INC.: Tripéptido que consiste en Leu-Arg-Ala. Composición que comprende el tripéptido según la reivindicación 1.
Preparaciones enzimáticas estables y métodos de uso de las mismas, del 6 de Noviembre de 2019, de RAMOT AT TEL AVIV UNIVERSITY LTD.: Una composición que comprende un concentrado no activo de una tiol-proteasa, siendo dicho concentrado un concentrado hipertónico y comprendiendo al menos 20 mg/ml de una […]
Agente para prevenir y/o tratar dolor neuropático periférico causado por un fármaco anticancerígeno, del 26 de Junio de 2019, de Kinki University: Un medicamento que comprende trombomodulina como principio activo para uso en el tratamiento profiláctico y/o terapéutico de dolor neuropático periférico inducido por quimioterapia.
Polipéptidos de fusión de serpina y métodos de uso de los mismos, del 19 de Junio de 2019, de Inhibrx, LP: Una proteína de fusión aislada que comprende al menos un polipéptido de alfa-1 antitripsina humana (AAT) que comprende una secuencia de aminoácidos […]
Uso de polipéptidos de aprotinina como portadores en conjugados farmacéuticos, del 5 de Junio de 2019, de ANGIOCHEM INC: Un conjugado, o una sal farmacéuticamente aceptable de este, que comprende: (a) un polipéptido que comprende un análogo biológicamente activo de […]
Terapia de combinación que usa inmunoglobulina e inhibidor de C1, del 31 de Mayo de 2019, de CSL BEHRING GMBH: Una composición para su uso en la prevención, el tratamiento o la reducción de los efectos de daño por inflamación o lesión por reperfusión tras isquemia cerebral, […]