Anticuerpos anti-CD19 y usos en oncología.
Una composición farmacéutica que comprende un anticuerpo monoclonal anti-CD19 quimerizado,
o humanizado que (a) es del isotipo humano IgG1 o IgG3, o (b) media la citotoxicidad humana celular dependiente de anticuerpo (ADCC), en un vehículo farmacéuticamente aceptable, en la que el anticuerpo comprende las secuencias expuestas como los aminoácidos 33 a 37, los aminoácidos 51 a 68 y los aminoácidos 101 a 115 de la SEC ID Nº 2 y las secuencias expuestas como los aminoácidos 43 a 58, los aminoácidos 74 a 80 y los aminoácidos 113 a 121 de la SEC ID Nº 16, o las secuencias expuestas como los aminoácidos 33 a 37, los aminoácidos 51 a 68 y los aminoácidos 101 a 114 de la SEC ID Nº 4 y las secuencias expuestas como los aminoácidos 44 a 58, los aminoácidos 74 a 80 y los aminoácidos 113 a 121 de la SEC ID Nº 18, en la que se introduce una sustitución de aminoácido en una o más de dichas secuencias y en la que el anticuerpo es capaz de reducir las células B que expresan CD19 de la médula ósea.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/005676.
Solicitante: DUKE UNIVERSITY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 230 North Building, Research Drive, Box 90083 Durham North Carolina 27708-0083 ESTADOS UNIDOS DE AMERICA.
Inventor/es: TEDDER, THOMAS F., YAZAWA,NORIHITO, GRON,HANNE, HAMAGUCHI,YASUHITO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C07K16/28 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12P21/08 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › Anticuerpos monoclonales.
PDF original: ES-2550621_T3.pdf



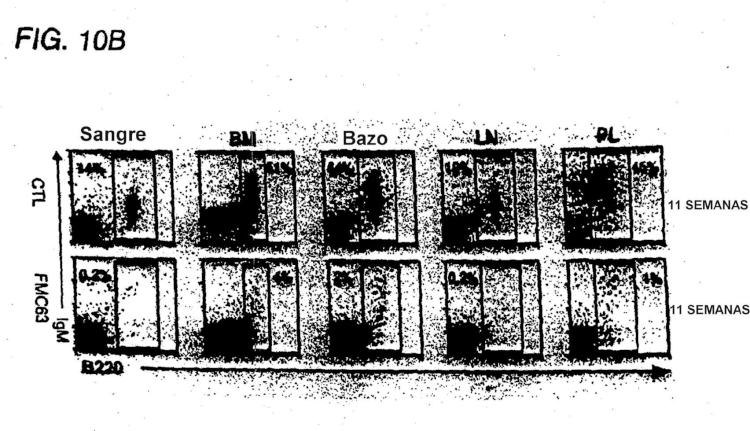
Fragmento de la descripción:
Anticuerpos anti-CD19 y usos en oncología
1. Introducción
La presente invención se refiere a un anticuerpo anti-CD 19 para su uso en métodos para el tratamiento de trastornos o enfermedades de células B en sujetos humanos, incluyendo neoplasias de células B, usando anticuerpos terapéuticos que se unen al antígeno CD19 humano. En una realización preferida, los anticuerpos anti- CD19 terapéuticos de las composiciones y para su uso en los métodos de la invención preferiblemente median la cltotoxlcldad humana mediada por células dependiente de antígeno (ADCC). La presente Invención se refiere adlclonalmente a composiciones que comprenden anticuerpos anti-CD19 humanizados o quiméricos del isotipo humano lgG1 y/o lgG3. La presente invención se refiere adicionalmente a dichas composiciones que preferiblemente mediante ADCC humana. La presente invención también abarca anticuerpos anti-CD 19 monoclonales humanizados, o quiméricos.
2. Antecedentes de la invención
Los marcadores de superficie de células B se han sugerido en líneas generales como dianas para el tratamiento de trastornos o enfermedades de células B, enfermedad autoinmune, y rechazo de trasplantes. Ejemplos de marcadores de superficie de células B incluyen marcadores de superficie de leucocitos CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD53, CD72, CD74, CD75, CD77, CD79a, CD79b, CD80, CD81, CD82, CD83, CD84, CD85, y CD86. Se han desarrollado anticuerpos que se unen específicamente a algunos de estos marcadores, y algunos se han ensayado para el tratamiento de enfermedades y trastornos.
Por ejemplo, terapias basadas en anticuerpo monoclonal (mAb) quimérico o radiomarcado dirigidas contra la molécula de superficie celular CD20 específica para células B maduras y sus equivalentes malignos han demostrado ser un tratamiento eficaz in vivo para linfoma no Hodgkin (Tedder et al., Immunol. Today 15:450-454 (1994); Press et al., Hematology, 221-240 (2001); Kaminski et al., N. Engl. J. Med., 329:459-465 (1993); Weiner, Semin. Oncol., 26:43-51 (1999); Onrust et al., Drugs, 58:79-88 (1999); McLaughlin etal., Oncology, 12:1763-1769(1998); Reffetal., Blood, 83:435-445 (1994); Maloney etal., Blood, 90:2188-2195 (1997); Maloney et al., J. Clin. Oncol., 15:3266-3274 (1997); Anderson et al., Blochem. Soc. Transac., 25:705-708 (1997)). También se ha descubierto que la terapia con anticuerpo monoclonal antl-CD20 mejora las manifestaciones de artritis reumatoide, lupus sistémico eritematoso, púrpura trombocitopénlca ¡dlopátlca y anemia hemolítlca, así como otras enfermedades mediadas por el sistema inmune (Silverman et al, Arthrltls Rheum., 48:1484-1492 (2002); Edwards et al., Rheumatology, 40:1-7 (2001); De Vita et al., Arthritls Rheumatlsm, 46:2029-2033 (2002); Leandro et al., Ann. Rheum. Dis., 61:883-888 (2002); Leandro et al., Arthrltls Rheum., 46:2673-2677 (2001)). El anticuerpo monoclonal anti-CD22 LL-2 demostró ser eficaz en el tratamiento de pacientes con linfoma agresivo y recidivante que experimentan tratamiento quimioterapéutico (Goldenberg patentes de Estados Unidos N° 6.134.982 y 6.306.393). El anticuerpo anti-CD20 (lgG1), RITUXAN, se ha usado satisfactoriamente en el tratamiento de ciertas enfermedades tales como púrpura trombocitopénica inmune en el adulto, artritis reumatoide, y anemia hemolítlca autoinmune (Cured et al., documento WO 00/67796). A pesar de la eficacia de esta terapia, la mayoría de las leucemias linfoblásticas agudas (ALL) y muchas otras neoplasias de células B no expresan CD20, expresan CD20 a bajos niveles, o han perdido la expresión de CD20 después de inmunoterapla con CD20 (Smlth et al., Oncogene, 22:7359-7368 (2003)). Además, la expresión de CD20 no es predictiva de respuesta a una terapia antl-CD20 ya que solamente la mitad de los pacientes con linfoma no Hodgkin responden a Inmunoterapla dirigidas a CD20.
La molécula CD19 humana es un receptor de superficie celular estructuralmente distinto expresado en la superficie de células B humanas Incluyendo, aunque sin limitación, células pre-B, células B en desarrollo temprano (es decir, células B Inmaduras), células B maduras a través de diferenciación terminal en células plasmáticas, y células B malignas. CD19 se expresa por la mayoría de leucemias linfoblásticas agudas pre-B (ALL), linfomas no Hodgkin, leucemias linfocíticas crónicas de células B (CLL), leucemias pro-linfocíticas, leucemias de células capilares, leucemias linfocíticas agudas comunes, y algunas leucemias linfoblásticas nulas-agudas (Nadler et al., J. immunol., 131:244-250 (1983), Loken etal., Blood, 70:1316-1324 (1987), Uckun etal., Blood, 71:13-29 (1988), Anderson etal., 1984, Blood, 63:1424-1433 (1984), Scheuermann, Leuk. Lymphoma, 18:385-397(1995)). La expresión de CD19 en células plasmáticas sugiere adicionalmente que puede expresarse en tumores de células B diferenciados tales como mleloma múltiple, plasmacltomas, tumores de Waldenstrom (Grossbard et al., Br. J. Haematol., 102:509-15(1998); Treon et al., Semin. Oncol., 30:248-52(2003)). A diferencia de CD20, se cree que el antígeno CD19 se expresa a niveles mayores y que las células lo internalizan cuando se une mediante un anticuerpo antl-CD19.
El antígeno CD19 también ha sido una de las muchas dianas propuestas para inmunoterapla. Sin embargo, se cree que la indisponibilidad percibida como diana debido a la internalización celular, ha presentado obstáculos al desarrollo de protocolos terapéuticos que podrían usarse satisfactoriamente en sujetos humanos. El anticuerpo CLB- CD19 (mAb murlno lgG2a anti-CD19) demostró inhibir el crecimiento de tumores humanos Implantados en ratones atímicos (Hooijberg et al., Cáncer Research, 55:840-846 (1995)). En otro estudio, el anticuerpo murlno monoclonal FMC63 (lgG2a) se quimerizó usando una región Fe de lgG1 humana. La administración de este anticuerpo
quimérico a ratones SCID que albergan un linfoma de células B humanas (modelo de xenotrasplante) no indujo citotoxicidad mediada por el complemento o ADCC, pero provocó eliminación significativa de las células tumorales trasplantadas (Geoffrey et al., Cáncer Immunol. Immunother., 41:53-60 (1995)).
Los resultados obtenidos usando modelos de ratón de xenotrasplante de implante de tumor condujeron a estudios usando anticuerpos murinos anti-CD19 en pacientes humanos. El anticuerpo murino CLB-CD19 se administró a seis pacientes diagnosticados con un linfoma no Hodgkin progresivo en los que había fracasado la terapia convencional previa (quimioterapia o radioterapia). A estos pacientes se les dieron dosis totales de anticuerpo que variaban de 225 a 1.000 mg (Hekman et al., Cáncer Immunol. immunotherapy, 32:364-372 (1991)). Aunque las células tumorales en circulación se redujeron temporalmente en dos pacientes después de la infusión del anticuerpo, solamente un paciente consiguió remisión parcial después de dos periodos de tratamiento con anticuerpo. No pudieron extraerse conclusiones respecto a la eficacia terapéutica a partir de este pequeño grupo de pacientes refractarios.
Posteriormente, estos investigadores demostraron que los efectos anti-tumorales de mAb contra CD20 conjugados son bastante superiores a los de mAb contra CD19 en modelos de trasplante (Hooijberg et al., Cáncer Res., 55:840- 846 (1995); y Hooijberg et al., Cáncer Res., 55:2627-2634 (1995)). Además, no observaron efectos aditivos o sinérgicos sobre la incidencia del tumor cuando se usaron mAb contra CD19 y CD20 en combinación (Hooijberg et al., Cáncer Res., 55:840-846 (1995)). Aunque los modelos de xenotrasplante en animales se reconocieron como malos indicadores de pronóstico para la eficacia en sujetos humanos, los resultados negativos en estos estudios en animales desalentaron el interés en la terapia con anticuerpos anti-CD 19 desnudos.
El uso de inmunotoxinas basadas en anticuerpo anti-CD19 produjo resultados igualmente desalentadores. En ensayos clínicos iniciales, el anticuerpo anti-CD19 B4 (mAb lgG1 murino) se conjugó con la toxina vegetal ricina y se administró a pacientes humanos que tenían mieloma múltiple en los que falló la terapia convencional previa (Grossbard et al., British Journal of Haematology, 102:509-515(1998)), linfoma no Hodgkin avanzado (Grossbard et al., Clinical Cáncer Research, 5:2392-2398 (1999)), y neoplasias refractarias de células B (Grossbard et al., Blood, 79:576-585 (1992)). Estos ensayos demostraron en líneas generales la seguridad de administrar el conjugado B4- ricina a seres humanos; sin embargo, los resultados fueron mixtos y las tasas de respuesta fueron desalentadoras en comparación con los ensayos clínicos con RITUXAN (Grossbard et al., Clinical Cáncer Research, 5:2392-2398 (1999)). Además, una parte significativa de los paciente desarrolló una respuesta de anticuerpo humano... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica que comprende un anticuerpo monoclonal anti-CD19 quimerizado, o humanizado que (a) es del isotipo humano lgG1 o lgG3, o (b) media la citotoxlcldad humana celular dependiente de anticuerpo (ADCC), en un vehículo farmacéuticamente aceptable, en la que el anticuerpo comprende las secuencias expuestas como los aminoácidos 33 a 37, los aminoácidos 51 a 68 y los aminoácidos 101 a 115 de la SEC ID N° 2 y las secuencias expuestas como los aminoácidos 43 a 58, los aminoácidos 74 a 80 y los aminoácidos 113 a 121 de la SEC ID N° 16, o las secuencias expuestas como los aminoácidos 33 a 37, los aminoácidos 51 a 68 y los aminoácidos 101 a 114 de la SEC ID N° 4 y las secuencias expuestas como los aminoácidos 44 a 58, los aminoácidos 74 a 80 y los aminoácidos 113 a 121 de la SEC ID N° 18, en la que se introduce una sustitución de aminoácido en una o más de dichas secuencias y en la que el anticuerpo es capaz de reducir las células B que expresan CD19 de la médula ósea.
2. La composición farmacéutica de la reivindicación 1, en la que una cantidad terapéuticamente eficaz del anticuerpo monoclonal anti-CD19 quimerizado del isotipo humano lgG1 o lgG3 es menor de aproximadamente 1 mg/kg de peso corporal del paciente.
3. La composición farmacéutica de la reivindicación 1, en la que una cantidad terapéuticamente eficaz de un anticuerpo monoclonal anti-CD19 quimerizado del isotipo humano lgG1 o lgG3 es mayor de aproximadamente 2 mg/kg de peso corporal del paciente.
4. La composición de la reivindicación 1, en la que el anticuerpo anti-CD19 que media la ADCC es del isotipo humano lgG1, o lgG3.
5. La composición farmacéutica de cualquier reivindicación precedente, en la que el anticuerpo anti-CD19 tiene una vida media de al menos 4 a 7 días.
6. La composición farmacéutica de cualquier reivindicación precedente, en la que la composición comprende una dosis de 1500 mg/m2 o menos del anticuerpo anti-CD19 y en la que el anticuerpo anti-CD19 se administra por vía parenteral, intraperitoneal, intramuscular, intravenosa o subcutánea.
7. La composición farmacéutica de la reivindicación 6, en la que la composición comprende una dosis de 375 mg/m2 o menos del anticuerpo anti-CD19 y en la que el anticuerpo anti-CD19 se administra por vía parenteral, intraperitoneal, intramuscular, intravenosa o subcutánea.
8. La composición farmacéutica de la reivindicación 7, en la que la composición comprende una dosis de 1,5 mg/m2 o menos del anticuerpo anti-CD19 y en la que el anticuerpo anti-CD19 se administra por vía parenteral, intraperitoneal, intramuscular, intravenosa o subcutánea.
9. La composición farmacéutica de la reivindicación 8, en la que la composición comprende una dosis de 0,5 ug/m2 o menos del anticuerpo anti-CD19 y en la que el anticuerpo anti-CD19 se administra por vía parenteral, intraperitoneal, intramuscular, intravenosa o subcutánea.
10. La composición farmacéutica de cualquier reivindicación precedente, en la que el anticuerpo anti-CD19 está marcado de forma detectable, es un anticuerpo desnudo, está conjugado con un compuesto terapéutico, está conjugado con un agente citotóxico, o está conjugado con un agente de diagnóstico.
11. La composición farmacéutica de cualquier reivindicación precedente, en la que el anticuerpo anti-CD19 es biespecífico.
12. La composición farmacéutica de la reivindicación 11, en la que el anticuerpo anti-CD19 biespecífico tiene especificidad por la unión a células efectoras.
13. La composición farmacéutica de cualquier reivindicación precedente, en la que la función ADCC del anticuerpo anti-CD19 se evalúa midiendo la capacidad del anticuerpo anti-CD19 de mediarla lisis de células diana por células efectoras in vitro.
14. La composición farmacéutica de cualquier reivindicación precedente, en la que el anticuerpo anti-CD19 comprende una cadena pesada que consiste en una secuencia que tiene al menos un 90% de identidad con la SEC ID N°2 o SEC ID N° 4.
15. La composición farmacéutica de cualquier reivindicación precedente, en la que el anticuerpo anti-CD19 comprende la cadena ligera que consiste en una secuencia que tiene al menos un 95% de identidad con la SEC ID N° 16 o SEC ID N° 18.
16. Un anticuerpo monoclonal anti-CD19 humanizado que (a) es del isotipo humano lgG1 o lgG3, o (b) media la citotoxicidad humana celular dependiente de anticuerpo (ADCC), en el que el anticuerpo comprende las secuencias expuestas como los aminoácidos 33 a 37, 51 a 68 y 101 a 115 de la SEC ID N° 2 y las secuencias expuestas como los aminoácidos 43 a 58, 74 a 80 y 113 a 121 de la SEC ID N° 16, o las secuencias expuestas como los aminoácidos 33 a 37, 51 a 68 y 101 a 114 de la SEC ID N° 4 y las secuencias expuestas como los aminoácidos 44 a 58, 74 a 80 y 113 a 121 de la SEC ID N° 18, en el que se introduce una sustitución de aminoácido en una o más de dichas secuencias, para su uso en el tratamiento de una neoplasia de células B en un paciente humano, en el que el anticuerpo es capaz de reducir las células B que expresan CD19 de la médula ósea.
17. El anticuerpo para su uso de acuerdo con la reivindicación 16, en el que el anticuerpo anti-CD19 comprende una cadena pesada que consiste en una secuencia que tiene al menos un 90% de identidad con la SEC ID N° 2 o SEC ID N° 4.
18. El anticuerpo para su uso de acuerdo con la reivindicación 16 o 17, en el que el anticuerpo comprende la cadena ligera que consiste en una secuencia que tiene al menos un 95% de identidad con la SEC ID N° 16 o SEC ID N° 18.
19. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 16 a 18, en el que el anticuerpo es capaz de reducir las células B en circulación.
20. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 16 a 19, en el que la neoplasia de células B es leucemia linfoblástica aguda, linfoma de células del manto, leucemia linfoblástica aguda de células pre-B, o linfoma llnfoblástico de células B precursoras.
21. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 16 a 20, en el que el anticuerpo anti-CD19 que media la ADCC es del isotipo humano lgG1 o lgG3.
22. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 16 a 20, en el que la neoplasia de células B se trata antes de la administración del anticuerpo antl-CD19.
23. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 16 a 20, en el que la neoplasia de células B se trata con una terapia diferente a una terapia con anticuerpo anti-CD19 posterior a la administración del anticuerpo anti-CD19.
24. El anticuerpo para su uso de acuerdo con la reivindicación 22 o reivindicación 23, en el que el tratamiento para la neoplasia es quimioterapia, radioinmunoterapia, terapia con toxinas, terapia con enzimas activadoras de profármacos, terapia de anticuerpos, terapia de potenciación de monocitos o macrófagos, terapia inmunorreguladora, terapia con estatina de neovasculatura tumoral, terapia con caliceamicina; terapia quirúrgica, o cualquier combinación de las mismas.
25. Un anticuerpo monoclonal anti-CD19 que media la citotoxicidad humana celular dependiente de anticuerpo (ADCC) que comprende las secuencias expuestas como los aminoácidos 33 a 37, los aminoácidos 51 a 68 y los aminoácidos 101 a 115 de la SEC ID N° 2 y las secuencias expuestas como los aminoácidos 43 a 58, los aminoácidos 74 a 80 y los aminoácidos 113 a 121 de la SEC ID N° 16, o las secuencias expuestas como los aminoácidos 33 a 37, los aminoácidos 51 a 68 y los aminoácidos 101 a 114 de la SEC ID N° 4 y las secuencias expuestas como los aminoácidos 44 a 58, los aminoácidos 74 a 80 y los aminoácidos 113 a 121 de la SEC ID N° 18, en el que se introduce una sustitución de aminoácido en una o más de dichas secuencias y en el que el anticuerpo es capaz de reducir las células B que expresan CD19 de la médula ósea para su uso en un régimen para (a) tratar una enfermedad en fase temprana resultante de una neoplasia de células B en un paciente humano, o (b) tratar una neoplasia de células B en un sujeto humano en el que el sujeto humano no ha recibido previamente tratamiento para la neoplasia, la neoplasia de células B es CD19 positiva o el ser humano tiene un recuento de monocitos de al menos 1 por di, en el que el régimen administrado reduce las células B en circulación.
26. El anticuerpo para su uso de acuerdo con la reivindicación 25, en el que el anticuerpo comprende una cadena pesada que consiste en una secuencia que tiene al menos un 90% de identidad con la SEC ID N° 2 o SEC ID N° 4.
27. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 25 a 26, en el que el anticuerpo anti-CD19 comprende la cadena ligera que consiste en una secuencia que tiene al menos un 95% de identidad con la SEC ID N° 16 o SEC ID N° 18.
28. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 25 a 27, en el que posteriormente se administra una terapia diferente a una terapia con anticuerpo antl-CD19 al ser humano.
29. El anticuerpo para su uso de acuerdo con la reivindicación 28, en el que la terapia es quimioterapia, radioterapia, terapia basada en toxinas, terapia basada en agentes radloquímicos o terapia quirúrgica.
30. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 25 a 29, en el que el régimen comprende la administración del anticuerpo como un único agente terapéutico, en combinación con otro agente terapéutico, o en combinación con un agente que reduce los efectos secundarios tóxicos.
31. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 25 a 30, en el que el régimen comprende la administración repetida del anticuerpo.
32. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 25 a 30, en el que el anticuerpo anti-CD19 tiene una vida media que es de al menos 4 a 7 días.
33. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 25 a 32, en el que el anticuerpo anti-CD19 es un anticuerpo de isotipo humano lgG1 o lgG3.
34. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 25 a 33, en el que el anticuerpo anti-CD19 es un anticuerpo humanizado.
35. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 16 a 34, en el que la neoplasia de células B es un linfoma no Hodgkin de subtipo de células B (NHL) incluyendo NHL de grado bajo/folicular, NHL linfocítico pequeño (SL), NHL de grado intermedio/folicular, NHL difuso de grado intermedio, NHL inmunoblástico de grado alto, NHL linfoblástico de grado alto, NHL de células no escindidas pequeñas de grado alto y NHL de enfermedad voluminosa; linfoma de Burkitt; mieloma múltiple; leucemia linfoblástica aguda de pre-B y otras neoplasias que derivan precursores tempranos de células B; leucemia linfocítica aguda común; leucemia linfocítica crónica; leucemia de células capilares; leucemia linfoblástica nula-aguda; macroglobulinemia de Waldenstrom; y leucemia pro-linfocítica; enfermedad de cadena ligera; plasmacitoma; mieloma osteosclerótico; leucemia de células plasmáticas; gammapatía monoclonal de importancia indeterminada (MGUS); mieloma múltiple asintomático (SMM); mieloma múltiple indolente (IMM); o linfoma de Hodgkin.
36. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 25 a 35, en el que el régimen comprende adicionalmente administrar un compuesto que potencia la función de monocitos o macrófagos.
37. El anticuerpo para su uso de acuerdo con la reivindicación 28, en el que el ser humano está inmunocomprometido.
38. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 16 a 35, en el que el anticuerpo anti-CD19 se administra por vía parenteral, intraperitoneal, o intramuscular.
39. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 16 a 35, en el que el anticuerpo anti-CD19 se administra por vía intravenosa o subcutánea.
40. El anticuerpo para su uso de acuerdo con la reivindicación 39, en el que el anticuerpo anti-CD19 se administra por vía subcutánea en una dosis de 37,5 mg/m2 o menos.
41. El anticuerpo para su uso de acuerdo con la reivindicación 40, en el que el anticuerpo anti-CD19 se administra en una dosis de 1,5 mg/m2 o menos.
42. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 25 a 41, en el que el régimen comprende más de una administración del anticuerpo anti-CD19 al ser humano.
43. El anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 25 a 42, en el que el régimen comprende adicionalmente administrar un anticuerpo anti-CD20, un anticuerpo anti-CD22, un anticuerpo anti-CD52, o cualquier combinación de los mismos.
Patentes similares o relacionadas:
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Conectores autoinmolativos no lineales y conjugados de los mismos, del 22 de Julio de 2020, de Byondis B.V: Compuesto conector-farmaco con la formula (I) **(Ver fórmula)** o sal, hidrato o solvato farmaceuticamente aceptables del mismo, donde […]