Prevención y tratamiento de una enfermedad sinucleinopática.
Una composición farmacéutica que comprende un agente que induce una respuesta inmunógena contra alfa-sinucleína,
para el uso en la profilaxis o el tratamiento de una enfermedad caracterizada por los cuerpos de Lewy o la agregación de alfa-sinucleína en el cerebro, en la que el agente es alfa-sinucleína o un fragmento inmunógeno de la misma o un anticuerpo hacia alfa-sinucleína o un fragmento inmunógeno de la misma, y en la que la enfermedad es la enfermedad de Parkinson, demencia con cuerpos de Lewy, enfermedad con cuerpos de Lewy difusos, disautonomía pura, disfagia con cuerpos de Lewy, enfermedad con cuerpos de Lewy incidentales, enfermedad con cuerpos de Lewy hereditaria o atrofia de múltiples sistemas.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/034527.
Solicitante: Prothena Biosciences Limited.
Nacionalidad solicitante: Irlanda.
Dirección: 25-28 North Wall Quay Dublin 1 IRLANDA.
Inventor/es: SCHENK, DALE, B., MASLIAH,ELIEZER.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/17 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- A61K39/00 A61K […] › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61K51/10 A61K […] › A61K 51/00 Preparaciones que contienen sustancias radioactivas utilizadas para la terapia o para el examen in vivo. › Anticuerpos o inmunoglobulinas; Sus fragmentos.
PDF original: ES-2549070_T3.pdf


Fragmento de la descripción:
Prevención y tratamiento de una enfermedad sinucleinopática Antecedentes de la invención
La patología cerebral por alfa-sinuclelna (alfaSN) es una característica llamativa de varias enfermedades neurodegenerativas, que incluyen la enfermedad de Parkinson (PD), demencia con cuerpos de Lewy (DLB), la variante con cuerpos de Lewy de la enfermedad de Alzheimer (LBVAD), atrofia de múltiples sistemas (MSA), y neurodegeneración con acumulación de hierro en el cerebro de tipo 1 (NBIA-1). Son comunes a todas estas enfermedades, denominadas sinucleinopatlas, las inclusiones proteicas insolubles en las neuronas y en la neuroglia que están compuestas principalmente de alfaSN.
Los cuerpos de Lewy y las neuritas de Lewy son inclusiones intraneuronales que están compuestas principalmente de alfaSN. Los cuerpos de Lewy y las neuritas de Lewy son las marcas distintivas neuropatológicas de la enfermedad de Parkinson (PD). PD y otras enfermedades sinucleinopáticas se han denominado colectivamente enfermedad con cuerpos de Lewy (LBD). LBD se caracteriza por la degeneración del sistema dopaminérgico, alteraciones motoras, deterioro cognitivo, y formación de cuerpos de Lewy (LBs). (McKeith et al., Clinical and pathological diagnosis of dementia with Lewy bodies (DLB): Report of the CDLB International Workshop, Neurology (1996) 47:1113-24). Otras LBDs incluyen la enfermedad con cuerpos de Lewy difusos (DLBD), la variante con cuerpos de Lewy de la enfermedad de Alzheimer (LBVAD), PD y enfermedad de Alzheimer (AD) combinada, y atrofia de múltiples sistemas. La demencia con cuerpos de Lewy (DLB) es un término acuñado para conciliar las diferencias en la terminología de las LBDs.
Los trastornos con LBs continúan siendo una causa habitual de trastornos del movimiento y deterioro cognitivo en la población anciana (Galasko et al., Clinical-neuropathological correlations in Alzheimer's disease and related dementias. Arch. Neurol. (1994)51:888-95). Aunque su incidencia continúa incrementándose, creando un problema grave de salud pública, hasta la fecha estos trastornos no son ni curables ni prevenibles, y la comprensión de las causas y la patogénesis de PD es crucial para el desarrollo de tratamientos nuevos (Tanner et al., Epidemiology of Parkinson's disease and akinetic syndromes, Curr. Opin. Neurol. (2000) 13:427-30). La causa de PD es controvertida, y se ha propuesto que múltiples factores desempeñan un papel, que incluyen diversas neurotoxinas y factores de susceptibilidad genética.
En los últimos años, han surgido nuevas esperanzas para la comprensión de la patogénesis de PD. De manera específica, varios estudios han demostrado que la proteína sinóptica alfa-SN desempeña un papel clave en la patogénesis de PD debido a que: (1) esta proteína se acumula en LBs (Spillantini et al., Nature (1997) 388:839-40; Takeda et al., AM. J. Pathol. (1998) 152:367-72; Wakabayashi et al., Neurosa. Lett. (1997) 239:45-8), (2) las mutaciones en el gen de alfa-SN co-segregan con formas familiares poco frecuentes de parkinsonismo (Kruger etal., Nature Gen. (1998) 18:106-8; Polymeropoulos MH, et al., Science (1997) 276:2045-7) y, (3) su sobreexpresión en ratones transgénicos (Masliah et al., Science (2000) 287:1265-9) y Drosophila (Feany et al., Nature (2000) 404:394-8) imita varios aspectos patológicos de PD. Así, el hecho de que la acumulación de alfa-SN en el cerebro esté asociada a alteraciones morfológicas y neurológicas similares en especies tan diversas como seres humanos, ratones y moscas sugiere que esta molécula contribuye al desarrollo de PD.
Un fragmento de alfa-SN, que previamente se determinó que era un constituyente de las placas amiloides de AD, se denominó componente no amiloide-beta (no A(3) del amiloide de AD (NAC) (Iwai A., Biochim. Biophys. Acta (2000) 1502:95-109); Masliah et al., AM. J. Pathol (1996) 148:201-10; Ueda et al., Proc. Nati. Acad. Sci. USA (1993) 90:11282-6). Aunque no se conoce la función exacta de NAC, puede desempeñar un papel crucial en los sucesos sinópticos, tales como la neuroplasticidad durante el desarrollo, y el aprendizaje y la degeneración de las terminaciones nerviosas en condiciones patológicas en LBD, AD, y otros trastornos (Hasimoto et al., Alpha-Synuclein in Lewy body disease and Alzheimer's disease, Brain Pathol (1999) 9:707-20; Masliah, et al., (2000).
AD, PD, y la demencia con cuerpos de Lewy (DLB) son los trastornos neurodegenerativos hallados más habitualmente en ancianos. Aunque su incidencia continúa incrementándose, lo que está creando un problema grave de salud pública, hasta la fecha estos trastornos no son ni curables ni prevenibles. Los estudios epidemiológicos recientes han demostrado una estrecha relación clínica entre AD y PD, ya que alrededor de un 30% de los pacientes de Alzheimer también tienen PD. En comparación con el resto de la población anciana, los pacientes de AD son, así, más propensos a desarrollar una PD concomitante. Además, los pacientes de PD que llegan a tener demencia normalmente han desarrollado AD clásica. Aunque cada enfermedad neurodegenerativa parece tener una predilección por regiones cerebrales y poblaciones celulares específicas, lo que da como resultado diferentes características patológicas, PD, AD, DLB y LBD también comparten marcas distintivas patológicas comunes. Los pacientes con AD familiar, síndrome de Down, o AD esporádica desarrollan LBs en el cuerpo amigdalino, los cuales son las marcas distintivas neuropatológicas clásicas de PD. Además, cada enfermedad está asociada a la degeneración de neuronas, conexiones sinópticas interneuronales y finalmente a la muerte celular, la reducción de neurotransmisores, y la acumulación anormal de proteínas mal plegadas, cuyos precursores participan en la función normal del sistema nervioso central. Los estudios bioquímicos han confirmado la asociación entre AD, PD y DLB.
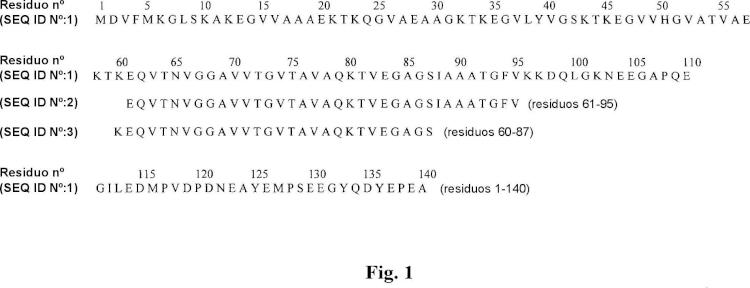
Las placas neuríticas, que son la marca distintiva patológica clásica de AD, contienen péptido beta-amiloide (A(3) y péptido del componente no beta-amiloide (NAC). A(3 procede de una proteína precursora mayor denominada proteína precursora amiloide (APP). NAC procede de una proteína precursora mayor denominada componente no beta-amiloide de APP, actualmente denominada más habitualmente alfa-SN. NAC comprende los residuos de aminoácidos 60-87 ó 61-95 de alfa-SN. Tanto A(3 como NAC se identificaron primero en las placas amlloldes como fragmentos proteolíticos de sus respectivas proteínas de longitud completa, para las cuales se Identificaron y se clonaron los cADNs de longitud completa.
Alfa-SN es parte de una gran familia de proteínas que incluyen beta- y gamma-sinucleína y slnoretlna. Alfa-SN se expresa en el estado normal asociado con las sinapsis, y se cree que desempeña un papel en la neuroplasticidad, el aprendizaje y la memoria. Se han identificado mutaciones en la alfa-SN humana (h) que aumentan la agregación de alfa-SN (Ala30Pro y Ala53Thr), y están asociadas a formas poco frecuentes de formas autosómicas dominantes de PD. Se desconoce el mecanismo mediante el cual estas mutaciones incrementan la propensión de la alfa-SN a agregarse.
A pesar del hecho de que se pueden hallar varias mutaciones en APP y alfa-SN en la población, la mayoría de los casos de AD y PD son esporádicos. Las formas esporádicas más frecuentes de estas enfermedades están asociadas a una acumulación anormal de Ap y alfa-SN, respectivamente. Sin embargo, se desconocen las razones de la acumulación excesiva de estas proteínas. A(3 se secreta en las neuronas y se acumula en las placas amiloides extracelulares. Además, se puede detectar A(3 dentro de las neuronas. Alfa-SN se acumula en las inclusiones intraneuronales denominadas LBs. Aunque las dos proteínas se hallan en general juntas en las placas de AD neuríticas extracelulares, también se hallan ocasionalmente juntas en inclusiones intracelulares.
No están claros los mecanismos mediante los cuales la acumulación de alfa-SN conduce a la neurodegeneración y a los síntomas característicos de PD. Sin embargo, la identificación del papel de los factores que estimulan y/o bloquean la agregación de alfa-SN es crucial para entender la patogénesis de LBD y el desarrollo de nuevos tratamientos para sus trastornos asociados. La investigación para identificar los tratamientos se ha dirigido a la búsqueda de compuestos que reducen la agregación de alfa-SN (Hashimoto, et al.) o a ensayar factores de crecimiento que estimularán la regeneración y/o la supervivencia de las neuronas dopaminérgicas, que son las células principalmente afectadas (Djaldetti et al., New therapies for Parkinson's disease, J. Neurol (2001) 248:357-62; Kirik et al., Long-term rAAV-mediated gene transfer of GDNF in the rat Parkinson's model: intrastriatal but not intranigral... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica que comprende un agente que induce una respuesta inmunógena contra alfa-sinucleína, para el uso en la profilaxis o el tratamiento de una enfermedad caracterizada por los cuerpos de Lewy o la agregación de alfa-sinucleína en el cerebro, en la que el agente es alfa-sinucleína o un fragmento inmunógeno de la misma o un anticuerpo hacia alfa-sinucleína o un fragmento inmunógeno de la misma, y en la que la enfermedad es la enfermedad de Parkinson, demencia con cuerpos de Lewy, enfermedad con cuerpos de Lewy difusos, disautonomía pura, disfagia con cuerpos de Lewy, enfermedad con cuerpos de Lewy incidentales, enfermedad con cuerpos de Lewy hereditaria o atrofia de múltiples sistemas.
2. La composición de la reivindicación 1, para el uso de la reivindicación 1, en la que la respuesta inmunógena comprende anticuerpos hacia alfa-sinucleína.
3. La composición de la reivindicación 1, para el uso de la reivindicación 1, en la que el agente es alfa-sinucleína o un fragmento inmunógeno de alfa-sinucleína, opcionalmente, en la que el fragmento comprende los aminoácidos 35-65 de alfa-sinucleína (SEQ ID N°: 1).
4. La composición de la reivindicación 1, para el uso de la reivindicación 1, en la que el fragmento inmunógeno comprende los aminoácidos 130-140 de alfa-sinucleína (SEQ ID N°: 1) y tiene menos de 40 aminoácidos.
5. La composición de la reivindicación 4, para el uso de la reivindicación 4, en la que el aminoácido C-terminal del fragmento es el aminoácido C-terminal de alfa-sinucleína.
6. La composición de la reivindicación 1, para el uso de la reivindicación 1, en la que la composición es para la administración a un paciente sin síntomas clínicos de una enfermedad caracterizada por los depósitos de amiloide de A(3.
7. La composición de la reivindicación 1, para el uso de la reivindicación 1, en la que la alfa-sinucleína o el fragmento inmunógeno de alfa-sinucleína se administra con un adyuvante.
8. La composición de la reivindicación 1, para el uso de la reivindicación 1, en la que la alfa-sinucleína o el fragmento se une a una molécula portadora para formar un conjugado, opcionalmente en el extremo N-terminal de la alfa-sinucleína o del fragmento.
9. La composición de la reivindicación 1, para el uso de la reivindicación 1, en la que el agente es un anticuerpo hacia alfa-sinucleína o el fragmento inmunógeno de la misma, opcionalmente, un anticuerpo humanizado, o un anticuerpo humano, preferiblemente del isotipo lgG1 humano.
10. La composición de la reivindicación 9, para el uso de la reivindicación 9, en la que el anticuerpo es un anticuerpo monoclonal.
11. La composición de la reivindicación 1, para el uso de la reivindicación 1, en la que el anticuerpo se une a un epítopo dentro de los residuos 130-140 de alfa-sinucleína.
12. La composición de la reivindicación 9, para el uso de la reivindicación 9, en la que el anticuerpo se administra a una dosis de 0,0001 a 100 mg/kg, preferiblemente al menos 1 mg de anticuerpo/kg de peso corporal, opcionalmente, en dosis múltiples a lo largo de un periodo prolongado, por ejemplo, de al menos seis meses, o en forma de una composición de liberación sostenida.
13. La composición de la reivindicación 9, para el uso de la reivindicación 9, en la que el anticuerpo se interioriza dentro de las neuronas que tienen cuerpos de Lewy, por lo que se disipan los cuerpos de Lewy, o en la que el anticuerpo se une a la superficie externa de las neuronas que tienen cuerpos de Lewy, por lo que se disipan los cuerpos de Lewy.
14. La composición de cualquier reivindicación precedente, para el uso de esa reivindicación, en la que la enfermedad es la enfermedad de Parkinson.
15. La composición de cualquier reivindicación precedente, para el uso de esa reivindicación, en la que el paciente no tiene la enfermedad de Alzheimery no tiene factores de riesgo de la misma.
16. La composición de cualquier reivindicación precedente, para el uso de esa reivindicación, en la que la composición se administra de manera periférica.
17. Un método de cribado de un agente para determinar si el agente tiene una actividad útil en el tratamiento de una enfermedad caracterizada por los cuerpos de Lewy, que comprende:
poner en contacto el agente con un animal transgénico no humano predispuesto a desarrollar una característica de una enfermedad por cuerpos de Lewy;
determinar si el agente afecta al grado o la velocidad de desarrollo de la característica respecto de un animal transgénico no humano de control;
en el que el agente es un fragmento inmunógeno de alfa-sinucleína o un anticuerpo hacia alfa-sinucleína, y en el que la enfermedad es la enfermedad de Parkinson, demencia con cuerpos de Lewy, enfermedad con 5 cuerpos de Lewy difusos, disautonomla pura, disfagia con cuerpos de Lewy, enfermedad con cuerpos de Lewy
incidentales, enfermedad con cuerpos de Lewy hereditaria o atrofia de múltiples sistemas.
18. El método de la reivindicación 17, en el que el animal transgénico no humano comprende un transgén que expresa la alfa-sinucleína, y opcionalmente un transgén que expresa la proteína precursora de amiloide.
Patentes similares o relacionadas:
Eliminación de impurezas de cultivos celulares residuales, del 29 de Julio de 2020, de NOVARTIS AG: Un método para eliminar la Proteína Nuclear (NP) de la Gripe de una preparación que comprende proteínas del virus de la gripe de interés que incluyen hemaglutinina […]
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Arenavirus trisegmentados como vectores de vacunas, del 22 de Julio de 2020, de UNIVERSITE DE GENEVE: Una partícula de arenavirus trisegmentada infecciosa y competente para la replicación que comprende un segmento L y dos segmentos S, en donde uno de los dos segmentos […]
Composiciones para inducir la diferenciación de células supresoras derivadas mieloides para tratar el cáncer y las enfermedades infecciosas, del 15 de Julio de 2020, de OSE Immunotherapeutics: Un compuesto seleccionado del grupo que consiste en un anticuerpo y un fragmento de unión a antígeno del mismo que se une específicamente a la proteína […]
Polipéptidos biparatópicos antagonistas de la señalización WNT en células tumorales, del 15 de Julio de 2020, de Boehringer Ingelheim International GmbH & Co. KG: Un polipéptido que se une específicamente a LRP5 o LRP6, que comprende - un primer dominio variable individual de inmunoglobulina seleccionado del grupo de dominios […]