Formulaciones de liberación inmediata de cinacalcet.
Composición farmacéutica, que comprende:
(a) de un 15 % a un 50 % en peso de cinacalcet HCl;
(b) de un 30 % a un 80 % en peso de una o más cargas;
(c) de un 5,1 % a un 7 % en peso de uno o más aglutinantes;
y opcionalmente uno o más agentes disgregantes, una o más sustancias de deslizamiento y/o uno o más lubricantes o uno u otros excipientes farmacéuticamente aceptables más, en los que el porcentaje de peso es con respecto al peso total de la composición.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E12007638.
Solicitante: K.H.S. PHARMA HOLDING GMBH.
Nacionalidad solicitante: Alemania.
Dirección: Rheinstrasse 49 55218 Ingelheim am Rhein ALEMANIA.
Inventor/es: LEITÃO SILVA,GABRIEL, CADONAU,STEPHANIE, PAULO SIMÕES,SÉRGIO, DRESCHER,CHRISTIAN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K9/16 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Aglomerados; Granulados; Microbolitas.
- A61K9/20 A61K 9/00 […] › Píldoras, pastillas o comprimidos.
PDF original: ES-2547577_T3.pdf



Fragmento de la descripción:
Formulaciones de liberación inmediata de cinacalcet Introducción
El cinacalcet es un compuesto activo receptor de calcio que está aprobado para el tratamiento del hiperparatiroidismo secundario que resulta del tratamiento de la insuficiencia renal crónica y para el tratamiento de hipercalcemia en pacientes con carcinoma de paratiroides.
El cinacalcet en la forma de su sal de adición de ácido clorhídrico (cinacalcet HCI) se comercializa con los nombres comerciales Mimpara®y Parareg® en Europa y Sensipar® en Estados Unidos.
En nombre químico del cinacalcet HCI es Clorhidrato de (R)-N-[1-(1-naftil)etil]-3-[3-(trifluorometil)fenil]propan-1-amina y tiene la siguiente estructura:
**(Ver fórmula)**Una síntesis de cinacalcet se desvela en el documento de patente WO 96/12697. El proceso de preparación de la forma I polimórfica más estable de cinacalcet HCI se desvela en el documento de patente WO 2007/62147.
Los comprimidos comercializados en la actualidad con liberación inmediata del fármaco se describen básicamente en el documento de solicitud de patente WO 2005/034928.
Con el fin de encontrar ciertas solicitudes reguladoras, el documento de patente WO 2005/034928 enseña el uso de composiciones de cinacalcet HCI que comprenden:
(a) de un 10 % a un 40 % en peso de cinacalcet HCI
(b) de un 45 % a un 85 % en peso de al menos un diluyente;
(c) de un 1 % a un 5 % en peso de al menos un aglutinante;
(d) de un 1 % a un 10 % en peso de al menos un agente disgregante; y
(e) de un 0,05 % a un 5 % de al menos un aditivo elegido entre sustancias de deslizamiento, lubricantes, y sustancias adherentes; en las que el porcentaje en peso es con respecto al peso total de la composición.
La solicitud de patente WO 2005/034928 informa de una solubilidad muy baja de cinacalcet HCI en agua, entre 0,1 mg/ml y 1,6 mg/ml, dependiendo del valor de pH, dando como resultado una biodisponibilidad baja y limitando las opciones de formulación y administración disponibles para este compuesto.
El documento de patente WO 2005/034928 también desvela un proceso de preparación de formulaciones de cinacalcet, que indican varios "Controles Críticos del Proceso", es decir, parámetros tales como el nivel de agua, velocidad del impulsor y tasa de pulverización de agua (durante la granulación), y tiempo de mezcla, velocidad de prensado del comprimido, peso del comprimido, espesor, dureza y friabilidad (durante la compresión) etc., que se podrían adaptar con el fin de conseguir un resultado deseado (es decir, satisfacer las características de disolución de acuerdo con los patrones similares a 26/NF 21 de la USP, capítulo 711). Como se desprende de la solicitud, la composición cuantitativa de los comprimidos también es un parámetro crítico que se pretende adaptar dentro de los límites especificados.
De acuerdo con el documento de patente WO 2005/034928, las partículas de cinacalcet HCI pueden tener un Dso menor o igual que aproximadamente 50 pm. sin embargo, la solicitud guarda silencio sobre cualquier implicación técnica relacionada con el tamaño de partícula de las partículas de cinacalcet HCI. Además, la solicitud guarda silencio sobre el Dso del API que se usó realmente.
La solicitud de patente WO 2010/071689 sugiere métodos mecánicos para la reducción del tamaño de partícula del cinacalcet HCI cristalino con el fin de obtener tamaños de partícula con un Dso menor o igual que 50 pm, pero también guarda silencio sobre cualquier consecuencia técnica al realizar esto, y menos aún de proporcionar
información alguna sobre el comportamiento de clnacalcet HCI cuando se formulan composiciones farmacéuticas.
El documento de patente WO 2010/034497 sugiere que el cinacalcet HCI micronizado es difícil de procesar y podría ser sensible a la oxidación. El Ejemplo 4 de la presente solicitud indica además que las formulaciones de acuerdo con el documento de patente WO 2005/034928 con cinacalcet HCI micronizado muestran características de disolución inferiores en comparación con las de cinacalcet HCI no micronizado con un Dso de 101 pm.
En conclusión, la técnica anterior enseña a usar preferentemente cinacalcet HCI con un Dso superior a 100 pm, pero guarda silencio sobre las implicaciones de los tamaños de partícula de cinacalcet HCI inferiores a 100 pm para la preparación de formulaciones farmacéuticas.
Por lo tanto, un objeto de la presente invención es la investigación de la correlación del tamaño de partícula de cinacalcet HCI y sus características de disolución.
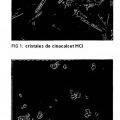
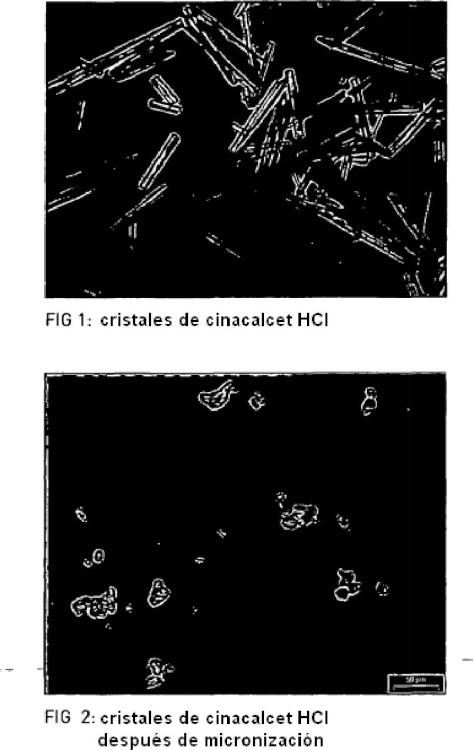
De acuerdo con la enseñanza del documento de patente WO 2010/071689, la cristalización de cinacalcet HCI en condiciones controladas conduce a cristales grandes con forma de aguja, tal como se puede observar en la figura 1. La figura 2 ilustra una muestra de cinacalcet HCI micronizado.
Se ha encontrado que la disolución del API de cinacalcet HCI se ve muy influenciado por su Dso. Se observó una disminución de la tasa de disolución con un Dso decreciente (véase la figura 4).
Como resultado de esta observación, otro objeto de la presente invención es proporcionar un proceso de formulación que sea flexible con respecto al uso de cinacalcet HCI con tamaños de partícula inferiores a 100 pm.
Para obtener una autorización comercial para el desarrollo de un fármaco genérico, es esencial satisfacer varios requisitos reguladores. Entre ellos, la prueba de bioequivalencia es de gran importancia. La primera etapa en el objetivo de la bioequivalencia es acercarse al perfil de disolución in vitro de un producto existente en el mercado. Con el fin de realizar esto, es favorable establecer métodos y procesos que permitan la selección y uso de la sustancia activa y todos los ingredientes necesarios y la adaptación de los parámetros relevantes dentro de amplios intervalos. Por lo tanto, el proceso de formulación farmacéutica será flexible tanto sobre un amplio intervalo de carga de fármaco activo, como también con respecto a las cantidades cuantitativas de los excipientes a usar.
Todos los objetivos que se han mencionado anteriormente se han alcanzado mediante el proceso de formulación y las composiciones farmacéuticas que se describen en lo sucesivo en el presente documento y en las reivindicaciones. Se ha encontrado que las formulaciones ventajosas comprenden de un 5,1 % a un 7 % de uno o más aglutinantes.
Los aglutinantes tales como povidona generalmente no se usan en cantidades inferiores a un 0,5 %, debido al fallo de la actividad de unión. Por otro lado, las cantidades superiores a un 5 % son inusuales ya que la fuerte actividad de unión podría disminuir la disolución del comprimido. Ahora teniendo en cuenta que el cinacalcet HCI es extremadamente ¡nsoluble en agua, fue una gran sorpresa cuando los inventos de la presente invención encontraron que el cinacalcet HCI se puede formular con más de un 5 % de aglutinante sin influir en el perfil de disolución de la formulación resultante.
Las composiciones farmacéuticas de acuerdo con la presente invención comprenden adicionalmente
(a) de un 15 % a un 50 % de cinacalcet HCI;
(b) de un 33 % a un 80 % de una o más cargas;
(c) de un 5,1 % a un 7 % de uno o más aglutinantes;
y pueden comprender otros ingredientes farmacéuticos tales como agentes disgregantes, sustancias de deslizamiento o lubricantes, en las que el porcentaje en peso es con respecto al peso total de la composición.
Se entenderá que los términos cargas, agentes disgregantes, alucinantes, lubricantes, sustancias de deslizamiento etc., incluyen un solo compuesto, pero también mezclas de compuestos.
La composición farmacéutica preferente es un comprimido. Los comprimidos se pueden preparar de acuerdo con procesos bien conocidos en la técnica.
El cinacalcet HCI usado en las composiciones farmacéuticas se prepara mediante procedimientos conocidos que se han indicado anteriormente, que presentan un tamaño de partícula con un Dso que varía de 5pm a 95 pm. Preferentemente, el Dso varía de 5 pm a 45 pm. Más preferentemente, el Dso varía de 10 pm a 30 pm. Lo más
preferentemente, el valor de Dso varía de 14 pm a 23 pm. El tamaño de partícula del cinacalcet HCI se mide de
acuerdo con técnicas de dispersión de luz. La forma de cristal preferente es la forma I cristalina tal como se desvelan el documento de patente WO 2007/62147.
Algunas cargas o diluyentes farmacéuticamente aceptables Incluyen almidón, celulosa mlcrocrlstallna, fosfato dicálcico, lactosa, carbonato cálcico, carbonato de magnesio, sorbitol, manitol, sacarosa, dextrlna, caolín, óxido de magnesio, sulfato cálcico, xilitol, isomalt, glucosa, fructosa,... [Seguir leyendo]
Reivindicaciones:
1. Composición farmacéutica, que comprende:
(a) de un 15 % a un 50 % en peso de cinacalcet HCI;
(b) de un 30 % a un 80 % en peso de una o más cargas;
(c) de un 5,1 % a un 7 % en peso de uno o más aglutinantes;
y opcionalmente uno o más agentes disgregantes, una o más sustancias de deslizamiento y/o uno o más lubricantes o uno u otros excipientes farmacéuticamente aceptables más, en los que el porcentaje de peso es con respecto al peso total de la composición.
2. Composición farmacéutica de acuerdo con la reivindicación 1, que comprende:
(b) de un 35 % a un 70 % en peso de una o más cargas.
3. Composición farmacéutica de acuerdo con las reivindicaciones 1 o 2, que comprende adicionalmente:
(d) de un 10,1 % a un 15 % en peso de uno o más agentes disgregantes.
4. Composición farmacéutica de acuerdo con una de las reivindicaciones anteriores, que comprende:
(a) de un 18 % a un 45 % en peso de cinacalcet HCI;
(b) de un 35 % a un 64 % en peso de una o más cargas;
(c) de un 5,1 % a un 7 % en peso de uno o más aglutinantes;
(d) de un 10,1 % a un 12 % en peso de uno o más agentes disgregantes.
5. Composición farmacéutica de acuerdo con una de las reivindicaciones 1 a 4, que comprende:
(a) de un 18 % a un 20 % en peso de cinacalcet HCI;
(b) de un 60 % a un 64 % en peso de una o más cargas;
(c) de un 5,1 % a un 7 % en peso de uno o más aglutinantes;
(d) de un 10,1 % a un 12 % en peso de uno o más agentes disgregantes.
6. Composición farmacéutica de acuerdo con una de las reivindicaciones 1 a 4, que comprende:
(a) de un 41 % a un 44 % en peso de cinacalcet HCI;
(b) de un 35 % a un 40 % en peso de una o más cargas;
(c) de un 5,1 % a un 7 % en peso de uno o más aglutinantes
(d) de un 10,1 % a un 12 % en peso de uno o más agentes disgregantes.
7. Composición farmacéutica de acuerdo con una de las reivindicaciones 3 a 6, que comprende:
(d) de un 10,5 % a un 11,5 % en peso de uno o más agentes disgregantes.
8. Composición farmacéutica de acuerdo con una de las reivindicaciones 1 a 5, que comprende una fase intragranular, que comprende
(a) de un 18 % a un 20 % en peso de cinacalcet HCI;
(bj de un 30 % a un 40 % en peso de una o más cargas;
(c) de un 5,1 % a un 7 % en peso de uno o más aglutinantes;
(d) de un 5 % a un 6 % en peso de uno o más agentes disgregantes;
y una fase extragranular, que comprende
(b") de un 25 % a un 28 % en peso de una o más cargas;
(d") de un 5 % a un 6 % en peso de uno o más agentes disgregantes;
(e) de un 0,2 % a un 1 % en peso de una o más sustancias de deslizamiento.
9. Composición farmacéutica de acuerdo con una de las reivindicaciones 1 a 5, que comprende una fase intragranular, que comprende
(a) de un 41 % a un 44 % en peso de cinacalcet HCI;
(b) de un 25 % a un 30 % en peso de una o más cargas;
(c) de un 5,1 % a un 7 % en peso de uno o más aglutinantes;
(d) de un 5 % a un 6 % en peso de uno o más agentes disgregantes;
y una fase extragranular, que comprende
(b") de un 8 % a un 12 % en peso de una o más cargas;
(d") de un 5 % a un 6 % en peso de uno o más agentes disgregantes;
(e) de un 0,2 % a un 1 % en peso de una o más sustancias de deslizamiento.
10. Composición farmacéutica de acuerdo con una de las reivindicaciones anteriores, que comprende:
(c) de un 5,5 % a un 6,5 % en peso de uno o más aglutinantes.
11. Composición farmacéutica de acuerdo con una de las reivindicaciones anteriores, que comprende:
(f) de un 0,2 % a un 1,5 % en peso de uno o más lubricantes.
12. Composición farmacéutica de acuerdo con una de las reivindicaciones anteriores, en la que las partículas de cinacalcet HCI presentan un Dso que varía de 5 pm a 95 pm, que varía preferentemente de 5 pm a 45 pm, que varía más preferentemente de 10 pm a 30 pm, que varía incluso más preferentemente de 14 pm a 23 pm.
13. Proceso para la preparación de una composición farmacéutica que comprende cinacalcet HCI de acuerdo con una de las reivindicaciones anteriores, que comprende las siguientes etapas:
(a) Mezclar cinacalcet HCI, los agentes aglutinantes, una parte de las cargas y una parte de los agentes disgregantes para formar una fase intragranular;
(b) Granular en húmedo la fase intragranular para formar gránulos húmedos;
(c) Tamizar los gránulos húmedos;
(d) Secar los gránulos húmedos y calibrar los gránulos secos;
(e) Mezclar y tamizar las partes restantes de las cargas y de los agentes disgregantes con las sustancias de deslizamiento para formar una fase extragranular;
(f) Combinar la fase extragranular con los gránulos secos;
(g) Tamizar los lubricantes y mezclarlos con la mezcla de gránulos secos y la fase extragranular para formar la mezcla final que se usa para la producción de los comprimidos.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Formulación de vitamina D de liberación modificada estabilizada y método de administración de la misma, del 22 de Julio de 2020, de EirGen Pharma Ltd: Una formulacion oral de liberacion controlada de un compuesto de vitamina D que comprende uno o ambos de 25- hidroxivitamina D2 y 25-hidroxivitamina D3, la formulacion […]
Métodos y composiciones para la administración oral de proteínas, del 22 de Julio de 2020, de Entera Bio Ltd: Una única composición farmacéutica oral que comprende una proteína que tiene un peso molecular de hasta 100.000 Daltons, siendo dicha proteína PTH; […]
Composición farmacéutica que comprende un agente antipsicótico atípico y método para su preparación, del 15 de Julio de 2020, de PHARMATHEN S.A.: Comprimido de liberación controlada de Paliperidona en forma de comprimido de varias capas que comprende: a) un núcleo de matriz que comprende […]
Composiciones y métodos para tratar el virus de la hepatitis C, del 15 de Julio de 2020, de Gilead Pharmasset LLC: Una composición farmacéutica que comprende: a) de aproximadamente el 25% a aproximadamente el 35% p/p de GS-7977 cristalino que tiene la estructura **(Ver […]
Macrogols para aplicación a la mucosa, y sus usos terapéuticos, del 15 de Julio de 2020, de S.I.I.T. S.R.L.-SERVIZIO INTERNAZIONALE IMBALLAGGI TERMOSALDANTI: Composición farmacéutica en forma sólida que comprende, por unidad de dosificación, entre 5 y 400 mg de un PEG con un grado de 3000 o más, para uso en el tratamiento […]
Preparación para el control del peso corporal a base de quitosano y celulosa, del 1 de Julio de 2020, de S.I.I.T. S.R.L.-SERVIZIO INTERNAZIONALE IMBALLAGGI TERMOSALDANTI: Una composición oral sólida que contiene una combinación de quitosano de hongos o levaduras, celulosa amorfa en polvo y opcionalmente excipientes.
Granulados secos de polvos de sílice mesoporosa, del 1 de Julio de 2020, de FORMAC PHARMACEUTICALS N.V: Un granulado seco que comprende desde el 50% al 100% p/p de sílice mesoporosa ordenada que tiene una organización bidimensional hexagonalmente […]