Liposoma de irinotecán o su clorhidrato y método de preparación del mismo.
Un liposoma de irinotecán o clorhidrato de irinotecán, caracterizado porque el citado liposoma comprende irinotecán o clorhidrato de irinotecán,
un fosfolípido neutro y el colesterol, y la relación en peso del colesterol con el fosfolípido neutro es 1: 3~5, caracterizado porque la citada relación en peso del fosfolípido neutro con el irinotecán o clorhidrato de irinotecán es de 2~5: 1, preferiblemente 2.5 ~ 4: 1 y porque el citado fosfolípido neutro comprende la fosfatidilcolina de soja hidrogenada.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CN2009/075298.
Solicitante: Jiangsu Hengrui Medicine Co., Ltd.
Nacionalidad solicitante: China.
Dirección: 145 Renmin Eastern Road Xinpu District Lianyungang, Jiangsu 222002 CHINA.
Inventor/es: CHEN,LIANG, TONG,XINYONG, LEI,GUOFENG, YU,CHENGXIA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/4745 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensados con sistemas cíclicos teniendo el nitrógeno como heteroátomo de un ciclo, p. ej. fenantrolinas (derivados de la yohimbina, vinblastina A61K 31/475; derivados de la ergolina A61K 31/48).
- A61K9/127 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Liposomas.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
PDF original: ES-2547698_T3.pdf

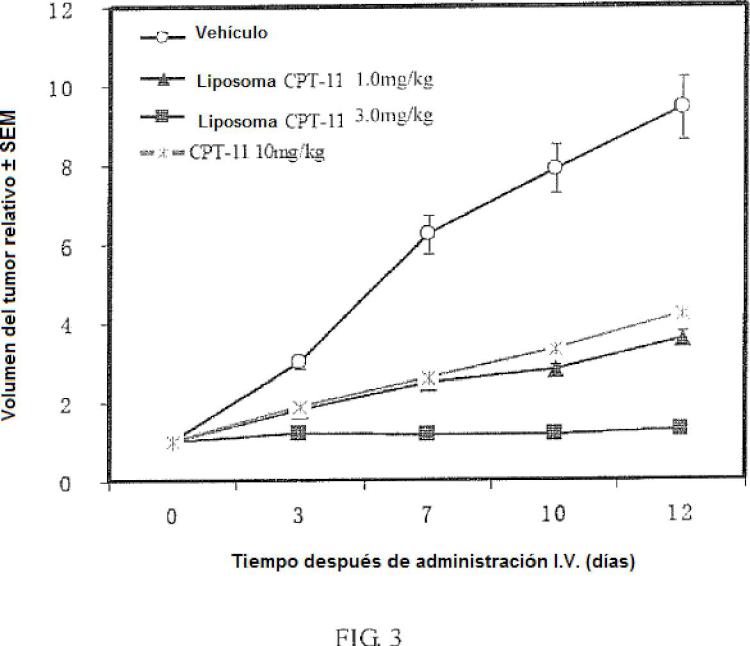
Fragmento de la descripción:
Liposoma de irinotecán o su clorhidrato y método de preparación del mismo Campo de la invención
La presente invención se refiere a un liposoma de irinotecán o su clorhidrato y método de preparación del mismo, y una inyección que comprende el citado liposoma y método de preparación de la misma.
Antecedentes de la invención
El irinotecán es un derivado semisintético de la camptotecina. La camptotecina se puede unir específicamente a la topoisomerasa I, que puede inducir roturas de una sola hebra de ADN reversibles, y luego desenvolver la estructura de hebra doble de ADN. El irinotecán y su metabolito SN-38 activo se puede unir al complejo ADN-topoisomerasa I, impidiendo de este modo la re-conexión de la fractura de una sola hebra. Se ha demostrado que la citotoxicidad del irinotecán se puede atribuir a la interacción de la replicasa y de los complejos triples topoisomerasa l-ADN-irinotecán (o SN-38), que rompe ADN de doble hebra en la síntesis de ADN.
El clorhidrato de irinotecán se utiliza ampliamente en el tratamiento de tumor maligno con las ventajas de los efectos farmacológicos obvios y la eficacia clínica. Sin embargo, tiene el mismo problema con otros derivados de la camptotecina: el anillo de lactona saturada en la estructura de irinotecán es dependiente del pH y se puede transformar en su forma carboxilato de forma reversible en condiciones fisiológicas, por lo cual se debilitaría la actividad anti-tumor. Las formulaciones comerciales existentes de clorhidrato de irinotecán son en inyección de líquido y polvo liofilizado para inyección. Después de la administración intravenosa en clínica, el fármaco libre perderá la actividad debido a que el anillo de lactona en su estructura es propenso a ser hidrolizado en la forma carboxilato en el ambiente fisiológico alcalina, reduciendo así la eficacia del fármaco indirectamente. Y estas formulaciones tienen efectos secundarios graves, que son principalmente la neutropenia y diarrea tardía.
El liposoma es ampliamente estudiado como un portador de fármacos en los últimos años. Las principales características de los liposomas incluyen la protección del fármaco encapsulado, el aumento de la estabilidad del fármaco, cambiando el comportamiento de distribución in vivo del fármaco, y llevando el fármaco a la región enferma por orientación pasiva o activa. Como buen portador de fármacos contra el cáncer, el liposoma puede mejorar la eficacia del fármaco y reducir la toxicidad del fármaco.
La solicitud internacional W02005/117878 revela una formulación de liposoma de irinotecán y el método de preparación de los mismos. Esta formulación comprende irinotecán o clorhidrato de irinotecán, fosfolípido seleccionado del grupo que consiste en fosfatidilcolina de soja hidrogenada, fosfatidiletanolamina, lecitina y cardiolipina, y el colesterol. Del mismo modo, la solicitud de patente china CN1994279A también revela una formulación de liposoma de irinotecán y el método de preparación de los mismos, en donde la fosfatidilcolina se utiliza como un fosfolípido para preparar un liposoma en el Ejemplo 5.
Chou et al (Effect of Composition on the Stability of Liposomal Irinotecán Prepared by a pH Gradient Method; Journal of Bioscience and Bioengeneering, Vol 95, No 4, 405-408, 2003) revela liposomas de irinotecán con HSPC/Col de 100:30.
Las formulaciones mencionadas en la literatura de patentes anteriores pueden lograr buenos resultados. Sin embargo, cuando se utilizan esas formulaciones en humanos, la estabilidad, tamaño de partícula y similares son todavía
insatisfactorios.
Descripción de la invención
La presente invención proporciona un liposoma de irinotecán o clorhidrato de irinotecán, que tiene una mayor capacidad de carga del fármaco, alta eficiencia de encapsulación, una buena estabilidad y es apropiado para ser preparado en una
formulación.
Hasta ahora, algunas publicaciones (por ejemplo, la solicitud internacional W02005/117878 y CN1994279A) han descrito los métodos de composición y preparación de liposomas de irinotecán. En alguna formulación de ellos algunos índices tuvieron buen resultado. Sin embargo, no hay ninguna información acerca de la estabilidad y el control del tamaño de partícula. Después de otro estudio del liposoma, fue sorprendente encontrar que la cantidad del colesterol en particular tenía un impacto en el tamaño de las partículas y en la estabilidad del liposoma cuando el tipo seleccionado del ingrediente inactivo y la cantidad utilizada en la formulación cumplen algunas condiciones. Se preparó con éxito un liposoma con una distribución del tamaño de partícula pequeña y uniforme y se mejoró su estabilidad mediante el control de la relación entre el fosfolípido neutro y el colesterol. En comparación con otras formulaciones, el liposoma de la presente solicitud tiene mayor estabilidad de almacenamiento, y otros indicadores también mejoraron significativamente, además, en comparación con las tecnologías descritas en la solicitud internacional W02005/117878 y CN1994279A, estos productos no comprenden un compuesto con un grupo funcional básico y un lípido catiónico. Y el liposoma de la presente invención tiene un buen efecto anti-tumoral y algunas ventajas de formulación simple, de alta capacidad de carga del fármaco y una buena estabilidad de almacenamiento.
El liposoma de la presente Invención comprende ¡rlnotecán o clorhidrato de irinotecán, un fosfolípido neutro y el colesterol, y la relación en peso del colesterol con el fosfolípido neutro es 1: 3 ~ 5, preferiblemente 1: 3.5 ~ 4.5, más preferiblemente 1: 4, caracterizado porque la citada relación en peso del fosfolípido neutro con el ¡rlnotecán o clorhidrato de ¡rlnotecán es de 2-5: 1, preferiblemente 2.5-4: 1 y porque el citado fosfolípido neutro comprende fosfatldllcollna de 5 soja hidrogenada.
El fosfolípido neutro utilizado en la presente Invención se selecciona del grupo que consiste en fosfatldllcollna de soja hidrogenada (HSPC), fosfatldllcollna de huevo (EPC), fosfatldllcollna de soja (SPC) y similares. El efecto se convierte en el mejor cuando la fosfatldllcollna de soja hidrogenada se utiliza como un fosfolípido neutro. La capacidad de carga del fármaco del liposoma se puede mejorar en gran medida cuando la relación en peso del fármaco con el fosfolípido se 10 ajusta adlclonalmente de la siguiente manera:
¡rlnotecán o clorhidrato de ¡rlnotecán I
fosfolípido neutro 25, preferiblemente 2.5-4
El liposoma de la presente Invención se puede preparar por métodos convencionales de preparación de liposomas en la técnica, preferiblemente por el método de gradiente Iónico. Cuando se usa el método de gradiente de iones, no hay gradiente de iones, formado por una solución reguladora entre la fase acuosa interna y la fase acuosa externa del citado 15 liposoma. Preferiblemente, la fase acuosa Interna del citado liposoma tiene una mayor concentración de iones de la fase acuosa externa, que puede mejorar la estabilidad del tamaño de partícula del liposoma durante el período de almacenamiento, mantener mejor la eficacia del fármaco, y ser capaz de controlar el tamaño medio de partícula del liposoma pequeño y uniforme, permitir que el cambio en el tamaño de partícula de liposoma se reduzca al mínimo durante el período de almacenamiento.
20 En la presente invención, el cambio en el tamaño de partícula del liposoma durante el período de almacenamiento se puede reducir al mínimo mediante la adición de un derivado lipídico de polímero hidrófilo a la formulación. Y, el tiempo de ciclo del liposoma in vivo se puede extender a través de la adición de un derivado de polietilenglicol en la formulación. El derivado de polietilenglicol se selecciona del grupo que consiste en polietilenglicol 2000-dlestearoil fosfatidil etanolamina (DSPEPEG2000), polietilenglicol 5000-diestearoil fosfatidil etanolamina, polietilenglicol 2000- 25 dipalmitoil fosfatidil etanolamina, polietilenglicol 5000-dipalmitoil fosfatidil etanolamina. Con el fin de mejorar la eficacia a largo plazo del fármaco, se prefiere que se adicione a los liposomas en la presente invención un derivado lipídico de polímero hidrófilo. Basándose en esta relación de terminación, DSPE-PEG2000 tiene el efecto más obvio. La relación en peso preferida del derivado lipídico con el irinotecán o clorhidrato de irinotecán es 0.2 ~ 0.4.
El liposoma puede comprender además un fosfolípido cargado seleccionado del grupo que consiste en fosfatidilglicerol 30 dilauroilo, fosfatidilglicerol dipalmitoil, diestearoil fosfatidil glicerol, fosfatidilglicerol dimiristato, ácido dioleico fosfatidilserina, dioleoil fosfatidilglicerol, ácido dilauroil fosfatídico,... [Seguir leyendo]
Reivindicaciones:
1. Un liposoma de ¡rinotecán o clorhidrato de irinotecán, caracterizado porque el citado liposoma comprende irinotecán o clorhidrato de irinotecán, un fosfolípido neutro y el colesterol, y la relación en peso del colesterol con el fosfolípldo neutro es 1: 3~5, caracterizado porque la citada relación en peso del fosfolípido neutro con el ¡rinotecán o clorhidrato de
5 ¡rinotecán es de 2~5: 1, preferiblemente 2.5 ~ 4: 1 y porque el citado fosfolípido neutro comprende la fosfatidllcollna de soja hidrogenada.
2. El liposoma de acuerdo con la reivindicación 1, caracterizado porque el citado fosfolípido neutro es la fosfatidilcolina de soja hidrogenada.
3. El liposoma de acuerdo con una cualquiera de las reivindicaciones anteriores, caracterizado porque la citada relación 10 del colesterol con el fosfolípido neutro es 1: 3.5-4.5. preferiblemente 1 : 4.
4. El liposoma de acuerdo con una cualquiera de las reivindicaciones anteriores, caracterizado porque el citado liposoma se prepara mediante el método de gradiente iónico.
5. El liposoma de acuerdo con la reivindicación 4, caracterizado porque el citado liposoma tiene gradiente iónico formado por una solución reguladora entre la fase acuosa interna y la fase acuosa externa del liposoma, preferiblemente
15 la fase acuosa interna del citado liposoma tiene una mayor concentración de iones que la fase acuosa externa.
6. El liposoma de acuerdo con una cualquiera de las reivindicaciones anteriores, caracterizado porque el citado liposoma comprende además un derivado lipídico del polímero hidrófilo, preferiblemente DSPE-PEG2ooo-
7. El liposoma de acuerdo con la reivindicación 6, caracterizado porque la citada relación en peso del derivado lipídico de polímero hidrófilo con el irinotecán o clorhidrato de irinotecán es 0.2 ~ 0.4.
20 8. El liposoma de acuerdo con una cualquiera de las reivindicaciones anteriores, caracterizado porque el citado
liposoma comprende además un fosfolípido cargado, en donde el citado fosfolípido cargado se selecciona del grupo que consiste en dilauroilo fosfatidilglicerol, dipalmitoil fosfatidilglicerol, diestearoil fosfatidil glicerol, dimiristato de fosfatidilglicerol, ácido dioleico fosfatidilserina, dioleoil fosfatidilglicerol, ácido dilauroil fosfatídico, dimiristato ácido fosfatídico, ácido diestearoil fosfatídico y una mezcla de los mismos, y la relación en peso del fosfolípido cargado con el 25 fosfolípido neutro es 1: 5 ~ 1: 100.
9. El liposoma de acuerdo con la reivindicación 1, caracterizado porque el citado liposoma comprende las siguientes relaciones en peso de ingredientes:
clorhidrato de irinotecán 1.
fosfatidilcolina de soja hidrogenada 3.4 - 3.8.
polietilenglicol 2000 diestearoil fosfatidil etanolamina 0.34 - 0.38.
colesterol 0.8 - 0.95.
y la relación de colesterol a fosfatidilcolina de soja hidrogenada es 1:4.
10. Un método de preparación del citado liposoma de acuerdo con una cualquiera de las reivindicaciones 1 a 11, caracterizado porque el citado método de preparación comprende las siguientes etapas de:
30 1) preparación de un liposoma blanco por uno cualquiera de los siguientes métodos A a D:
A. disolver un fosfolípido neutro y el colesterol en etanol anhidro o un solvente mixto de etanol anhidro y tert-butil alcohol de acuerdo con la formulación deseada, mezclar la mezcla con una solución reguladora para obtener un liposoma blanco en bruto después retirar el etanol a través de destilación a presión reducida, y a continuación, preparar un liposoma blanco con el tamaño de partícula deseado, utilizando un homogeneizador de alta presión y/o un equipo de
35 extrusión;
B. disolver un fosfolípido neutro y colesterol en cloroformo o un solvente mixto de cloroformo-metanol de acuerdo con la formulación deseada, formar una película de lípido a través de un evaporador rotatorio, adicionar una solución reguladora de hidratación para obtener un liposoma blanco en bruto, y luego preparar un liposoma blanco con el tamaño de partícula deseado mediante el uso de un homogeneizador de alta presión y/o un equipo de extrusión;
40 C. mezclar un fosfolípido neutro, colesterol y una solución reguladora de acuerdo con la formulación deseada, a continuación, preparar un liposoma blanco con el tamaño de partícula deseado utilizando un homogeneizador de alta presión y/o un equipo de extrusión;
D. disolver un fosfolfpido neutro y el colesterol en etanol anhidro o un solvente mixto de etanol anhidro y tert-butil alcohol de acuerdo con la formulación deseada, mezclar la mezcla con una solución reguladora, y luego preparar un liposoma blanco con el tamaño de partícula deseado mediante el uso de homogeneizador de alta presión y/o un equipo de extrusión;
2) formación de gradiente iónico entre la fase acuosa interna y la fase acuosa externa del liposoma blanco: sustituir la fase acuosa externa del liposoma blanco para formar un gradiente iónico entre la fase acuosa interna y la fase acuosa externa del liposoma blanco;
3) preparación un liposoma cargado con un fármaco: preparar una solución acuosa de clorhidrato de irinotecán, adicionarla a la dispersión de liposomas blanco con gradiente iónico, y luego incubar la dispersión para obtener el liposoma cargado con un fármaco con calentamiento y agitación.
11. El método de preparación de acuerdo con la reivindicación 10, caracterizado porque después de la etapa 3) de preparación del liposoma cargado con un fármaco, el citado método comprende también la siguiente etapa de:
4) eliminación del fármaco libre y la concentración de la muestra: adicionar un medio de solución reguladora al liposoma de clorhidrato de irinotecán, eliminar el fármaco no encapsulado mediante el uso de dispositivo de flujo tangencial, y concentrar la muestra a un volumen apropiado.
12. El método de preparación de acuerdo con una cualquiera de las reivindicaciones 10 a 11, caracterizado porque la citada solución reguladora se selecciona del grupo que consiste en una solución reguladora que comprende sales de iones de Na+. K+, Fe2+, Ca2+, Ba2+, Mn2+, Mg2+, L¡+, NH/, H+ y una mezcla de los mismos.
13. Una inyección de liposoma que comprende el liposoma de Irinotecán o clorhidrato de irinotecán, de acuerdo con una cualquiera de las reivindicaciones 1 a 9.
14. La inyección de liposomas de acuerdo con la reivindicación 13, caracterizada porque la citada inyección comprende un estabilizador, en donde el citado estabilizador se selecciona del grupo que consiste en ácido etilendiaminotetraacético, ácido etilendlamlnotetraacétlco disódico, ácido etilendiaminatetracético dlcálcico y una mezcla de los mismos, preferiblemente ácido etilendiaminatetracético disódico; la relación del estabilizador adicionado es 0 - 0.5% (peso/v), y el mínimo no es 0%.
15. La inyección de liposomas de acuerdo con la reivindicación 13, caracterizada porque la citada inyección es una Inyección de líquido o polvo liofilizado para inyección.
16. La inyección de liposomas de acuerdo con la reivindicación 13, caracterizada porque la citada inyección comprende un regulador de presión osmótica, en donde dicho regulador de presión osmótica se selecciona entre el grupo que consiste en glucosa, sacarosa, sorbitol, manltol, cloruro de sodio, glicerina, histidina y su clorhidrato, glicina y su clorhidrato, Usina, serina, ácido glutámico, arginina, valina y una mezcla de los mismos: la relación de dicho regulador de presión osmótica adicionado es 0 ~ 5% (peso/v), y el mínimo no es 0%.
17. La inyección de liposomas de acuerdo con la reivindicación 13, caracterizada porque la citada inyección comprende además un antioxidante, en donde el citado antioxidante se selecciona entre el grupo que consiste en un antioxidante soluble en agua y un antioxidante soluble en aceite: en donde el citado antioxidante soluble en aceite es seleccionado del grupo que consiste en a-tocoferol, succinato de a-tocoferol, acetato de a-tocoferol y una mezcla de los mismos: en donde el citado antioxidante soluble en agua se selecciona del grupo que consiste en ácido ascórbico, bisulfito de sodio, sulfito de sodio, pirosulfito de sodio. L-cisteína y una mezcla de los mismos: la relación del antioxidante adicionado es 0 - 0.5% (peso/v), y el mínimo no es 0%.
18. La inyección de liposomas de acuerdo con la reivindicación 15, caracterizada porque la citada inyección es polvo liofilizado para inyección que comprende un lioprotector, y se prepara mediante liofilización.
19. La inyección de liposomas de acuerdo con la reivindicación 13, caracterizado porque la citada inyección comprende las siguientes relaciones en peso de los ingredientes:
clorhidrato de irinotecán
1.
fosfatidilcolina de soja hidrogenada
3.4-3.8.
polietilenglicol 2000-diestearoil fosfatidil etanolamina
0.34 - 0.38.
colesterol
0.8-0.95.
y la relación del colesterol con la fosfatidilcolina de soja hidrogenada es 1:4.
20. Un procedimiento de preparación de la citada inyección de liposomas de acuerdo con una cualquiera de las reivindicaciones 13 a 19, caracterizado porque el citado proceso comprende el método de preparación de acuerdo con una cualquiera de las reivindicaciones 10 a 11.
21. El proceso de preparación de acuerdo con la reivindicación 20, caracterizado porque el proceso de la citada 5 preparación comprende además las siguientes etapas de:
medición del volumen, la esterilización y subenvase: ajustar la concentración del fármaco de liposoma, medir el volumen, esterilización por filtración, llenado en los viales y sellado para obtener la inyección de liposomas; o
adición de un lioprotector a la muestra de fármacos de liposoma, ajustar de la concentración del fármaco, medir el volumen, esterilización por filtración, llenado en los viales, sellado, a continuación, liofilización para obtener el polvo 10 liofilizado para inyección.
Patentes similares o relacionadas:
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Aril éteres y usos de los mismos, del 22 de Julio de 2020, de Peloton Therapeutics, Inc: Un compuesto de formula Vd: **(Ver fórmula)** ç o una sal farmaceuticamente aceptable del mismo, en donde: R1 es arilo o heteroarilo; […]