Estructura cristalina de glutaminil ciclasa.
Un cristal que comprende glutaminil ciclasa humana que tiene un grupo espacial caracterizado de C121 y dimensiones de celda unidad de +/- 5% de a ≥
82,6 Å, b ≥ 63,9 Å, c ≥ 77,5 Å, α ≥ 90,0º, β ≥ 105,7º y γ ≥ 90,0º.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2011/064289.
Solicitante: PROBIODRUG AG.
Nacionalidad solicitante: Alemania.
Dirección: WEINBERGWEG 22 06120 HALLE/SAALE ALEMANIA.
Inventor/es: SCHILLING,STEPHAN, WERMANN,Michael, RAHFELD,JENS-ULRICH, KOCH,BIRGIT, PARTHIER,CHRISTOPH, RUIZ-CARILLO,DAVID, STUBBS,MILTON.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N9/10 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Transferasas (2.) (ribonucleasas C12N 9/22).
- G06F19/16
PDF original: ES-2540467_T3.pdf



Fragmento de la descripción:
Estructura cristalina de glutaminil ciclasa Campo de la invención
La invención se refiere a la nueva estructura cristalina de glutaminil ciclasa (QC, EC 2.3.2.5). QC cataliza la delación intramolecular de residuos de glutamina N-termlnales a ácido piroglutámico (5-oxo-prolilo, pGlu*) con liberación de amoniaco y la ciclación intramolecular de residuos de glutamato N-terminales a ácido piroglutámico con liberación de agua.
Antecedentes de la invención
La glutaminil ciclasa (QC, EC 2.3.2.5) QC cataliza la ciclación intramolecular de residuos de glutamina N-terminales a ácido piroglutámico (pGlu*) liberando amoniaco. Se aisló primero una QC por Messer del látex de la planta tropical Carica papaya en 1963 (Messer, M. 1963 Nature 4874, 1299). 24 años después, se descubrió una actividad enzlmátlca correspondiente en hipófisis animal (Busby, W. H. J. et al. 1987 J Biol Chem 262, 8532-8536; Fischer, W. H. y Spless, J. 1987 Proc Nati Acad Sel U S A 84, 3628-3632). Para la QC de mamífero, la conversión de Gln a pGlu por la QC se pudo mostrar para los precursores de TRH y GnRH (Busby, W. H. J. et al. 1987 J Biol Chem 262, 8532- 8536; Fischer, W. H. y Spless, J. 1987 Proc Nati Acad Sci U S A 84, 3628-3632). Además, experimentos iniciales de localización de QC revelaron una colocalización con sus putativos productos de catálisis en hipófisis bovina, mejorando además la función sugerida en la síntesis de hormonas peptídicas (Bockers, T. M. et al. 1995 J Neuroendocrlnol 7, 445-453). En contraste, la función fisiológica de QC vegetal está menos clara. En caso de la enzima de C. papaya, se sugirió un papel en la defensa de la planta contra microorganismos patógenos (El Moussaoui, A. et al.21 Cell Mol Life Sci 58, 556-57). Se identificaron QC putativas de otras plantas por comparaciones de secuencias recientemente (Dahl, S. W. et al. 2 Protein Expr Purif 2, 27-36). La función fisiológica de estas enzimas, sin embargo, es todavía ambigua.
Las QC conocidas de plantas y animales tienen una especificidad estricta para L-glutamina en la posición N-terminal de los sustratos y se encontró que su comportamiento cinético obedecía la ecuación de Michaelis-Menten (Pohl, T. et al. 1991 Proc Nati Acad Sci USA 88, 159-163; Consalvo, A. P. et al. 1988 Anal Biochem 175, 131-138; Gololobov, M. Y. ef al. 1996 Biol Chem Floppe Seyler 377, 395-398). Una comparación de las estructuras primarias de las QC de C. papaya y esa de la QC muy conservada de mamíferos, sin embargo, no reveló ninguna homología de secuencia (Dahl, S. W. ef al. 2 Protein Expr Purif 2, 27-36). Mientras que las QC vegetales parecen pertenecer a una nueva familia de enzimas (Dahl, S. W. ef al. 2 Protein Expr Purif 2, 27-36), se encontró que las QC de mamíferos tenían una homología de secuencia pronunciada a amlnopeptldasas bacterianas (Bateman, R. C. ef al. 21 Biochemistry 4, 11246-1125), llevando a la conclusión de que las QC de plantas y animales tienen diferentes orígenes evolucionarios.
Recientemente, se ha mostrado que QC humana recomblnante así como la actividad QC de extractos de cerebros catalizan la ciclación tanto de N-glutamlnllo terminal como de glutamato. Lo más sorprendente es el descubrimiento, de que la conversión de Glui catalizada por la ciclasa se favorece a aproximadamente pH 6 mientras que la conversión de Glni a derivados de pGlu se produce con un pH óptimo de aproximadamente 8,. Puesto que la formación de péptldos relacionados con pGlu-Ap se puede suprimir por Inhibición de QC humana recombinante y actividad QC de extractos hipofisarios de cerdo, la enzima QC es una diana en desarrollo de fármacos para el tratamiento de la enfermedad de Alzheimer.
El documento US 7.572.614 (Wang ef al) y Fluang ef al (25) PNAS 12(37), 13117-13122 describen ambos un ejemplo de la estructura cristalina de glutaminil ciclasa soluble. La estructura cristalina divulgada en Wang ef al y Huang ef al se generó usando una proteína expresada en E. coli, que produce la falta de glicosilación. Se sabe bien que todas las QC de mamífero contienen al menos un sitio de glicosilación (Pohl, T. ef al. (1991) Proc Nati Acad Sel U S A 88, 159-163; Song, I. ef al. (1994) J Mol Endocrino! 13, 77-86), que se gllcosila en QC cristalizada según la Invención en virtud de ser expresada en huéspedes eucarlotas, que se puede observar en las estructuras cristalinas presentadas en el presente documento. Además, todas las QC de mamífero contienen dos residuos de cisteína conservados cerca del sitio activo, que forman un enlace disulfuro. En la estructura cristalina de Wang ef al y Fluang ef al, falta el enlace disulfuro. La expresión de proteínas secretoras de mamíferos en bacterias frecuentemente produce la ausencia de la formación de disulfuro (FHannig, G. y Makrides, S. C. (1998) Trends Biotechnol 16, 54-6). El enlace disulfuro está claramente presente en las estructuras cristalina de QC tanto humana como murina presentadas en el presente documento. Notablemente, los análisis mutaciones proporcionados en los ejemplos descritos en el presente documento sugieren una Importante función establllzadora del enlace disulfuro sobre la estructura global. Además, en la estructura de Wang ef al y Fluang ef al, un segmento de residuos (L25- FI26-W27) cercano al sitio activo aparece en dos conformaciones diferentes. Debido a las orientaciones, el modo de unión de sustratos está afectado y no se pudieron sacar conclusiones mecanístlcas precisas (Fluang ef al., 25). El residuo W27 está conservado en las QC de mamífero (W28 en QC murina). En las estructuras cristalinas de QC humana y murina presentadas en el presente documento, la orientación es Idéntica, aunque los residuos
adyacentes L25 y H26 no están conservados. Por tanto, la orientación estructural de los residuos parece no nativa en la estructura cristalina de Wang et al y Huang et al.
La expresión de la QC murina y humana en un huésped eucariota, como se describe en la presente invención, permite la cristalización y refinamiento estructural de una QC de mamífero nativa y, de forma importante, la determinación inequívoca de los modos de unión de inhibidores, como se ejemplifica por la resolución estructural de QC murina con tres compuestos inhibitorios diferentes (enumerados en la tabla I como inhibidor A, inhibidor B e inhibidor C), que tienen potencia inhibitoria similar entre QC humana y murina.
En contraste a las estructuras descritas en publicaciones previas por Wang et al y Huang et al, la invención muestra que las modificaciones postraduccionales de formación de disulfuro y glicosilación producen una única disposición estructural de los residuos L25-H26-W27 en QC humana y murina. Los residuos tienen un efecto directo sobre el modo de unión de compuestos dirigidos al sitio activo. Las orientaciones múltiples de W27 en estudios previos, produjeron variaciones en los modos de unión de compuestos dirigidos al sitio activo.
Tabla 1: Valores de Ki [pM] de inhibidores seleccionados para QC murina (mQC) y humana (hQC)
| Inhibidor | mQC | hQC |
| Inhibidor A | ,173 | ,542 |
| Inhibidor B | n.d | ,613 |
| Inhibidor | ,513 | ,16 |
En contraste, se observaron modos de unión inequívocos de compuestos y orientaciones de W27 con tres inhibidores diferentes e incluso en una estructura sin inhibidor unido. Por tanto, los métodos como se describen en la presente invención proporcionan avances sustanciales para el diseño de fármacos dirigido por estructura de inhibidores de QC.
La conclusión está particularmente reforzada por la evaluación estructural de QC de dos mamíferos diferentes. Compendio de la invención
Según un primer aspecto de la invención se proporciona un cristal que comprende glutaminil ciclasa humana que tiene un grupo espacial caracterizado de C121 y dimensiones de celda unidad de +/- 5% de a = 82,6 A, b = 63,9 A, c = 77,5 A, a = 9,°, (3 = 15,7° y y = 9,°
Según un segundo aspecto de la invención se proporciona un cristal que comprende glutaminil ciclasa murina que tiene un grupo espacial caracterizado de P212121 y que tiene dimensiones de celda unidad de +/- 5% de a = 42,7 A, b = 84, A, y c = 96,5 A.
Según un tercer aspecto de la invención se proporciona un método de preparar el cristal de glutaminil ciclasa humana como se describe en el presente documento, que comprende los pasos de:
(a) proporcionar una solución de glutaminil ciclasa humana, opcionalmente en presencia de un inhibidor conocido de glutaminil ciclasa, en un tampón adecuado tal como tampón Bis-Tris... [Seguir leyendo]
Reivindicaciones:
1. Un cristal que comprende glutaminil ciclasa humana que tiene un grupo espacial caracterizado de C121 y dimensiones de celda unidad de +/- 5% de a = 82,6 Á, b = 63,9 Á, c = 77,5 A, a = 9,°, (3 = 15,7° y y = 9,°.
2. Un cristal como se define en la reivindicación 1, que difracta rayos x para la determinación de las coordenadas atómicas del cristal a una resolución de entre 2,8 Á y 11,98 Á.
3. Un cristal como se define en la reivindicación 1 o la reivindicación 2, en donde la glutaminil ciclasa humana consiste en los residuos de aminoácidos A35 a L361 de SEQ ID NO: 1.
4. Un cristal como se define en la reivindicación 3, que comprende un bolsillo de unión proporcionado por los residuos E22, D159 y H33 de SEQ ID NO: 1 según las coordenadas de la figura 1.
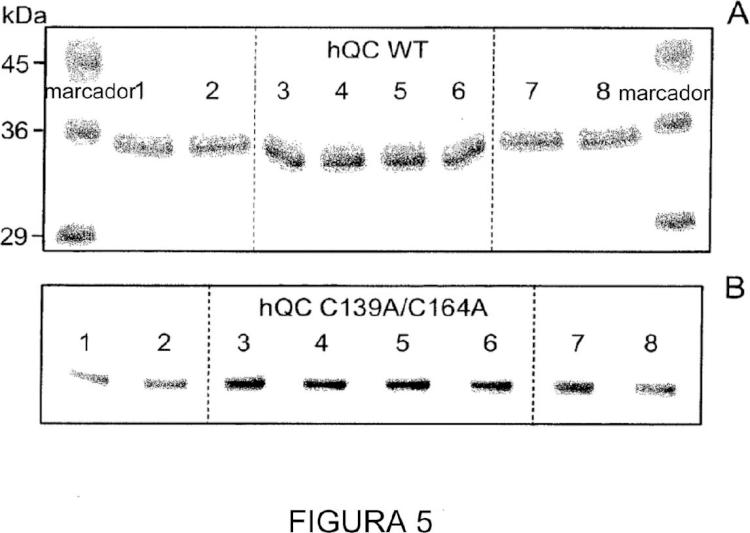
5. Un cristal como se define en la reivindicación 3 o la reivindicación 4, que comprende un puente disulfuro entre los residuos C139 y C164 de SEQ ID NO: 1.
6. Un cristal como se define en cualquiera de las reivindicaciones 3 a 5, que comprende uno o más enlaces peptídicos cis entre uno o más de los siguientes pares de residuos de SEQ ID NO: 1: D159-S16, H228-P229, G31-V32 y S323-P324.
7. Un método de identificar un inhibidor de glutaminil ciclasa humana que comprende los siguientes pasos:
(a) generar un modelo tridimensional de glutaminil ciclasa humana usando las coordenadas estructurales descritas en la figura 1;
(b) analizar el bolsillo de unión proporcionado por los residuos E22, D159 y H33 de SEQ ID NO: 1 según las coordenadas de la figura 1;
(c) realizar análisis de modelado por ordenador para identificar un compuesto inhibidor que se puede asociar con el bolsillo de unión de glutaminil ciclasa humana.
8. Un método como se define en la reivindicación 7, en donde el paso de realizar análisis de modelado por ordenador para identificar dicho compuesto inhibidor comprende identificar dicho compuesto de una biblioteca
de compuestos;
o identificar dicho compuesto en una base de datos; o
diseñar el compuesto a partir de un inhibidor de glutaminil ciclasa humana conocido.
9. Un método de preparar el cristal de glutaminil ciclasa humana como se describe en cualquiera de las reivindicaciones 1 a 6, que comprende los pasos de:
(a) proporcionar una solución de glutaminil ciclasa humana, opcionalmente en presencia de un inhibidor conocido de glutaminil ciclasa, en un tampón adecuado tal como tampón Bis-Trls 25 mM, pH 6,8 /NaCI 1 mM;
(b) mezclar la solución con una solución de cristalización que comprende 2-metil-2,4-pentanodiol al 3% (v/v) y 4PEG al 11% (p/v); y
(c) incubar la mezcla en condiciones para fomentar la difusión de vapor en gota colgante durante un tiempo suficiente para producir el cristal de glutaminil ciclasa humana.
1. Un método para preparar el cocristal como se define en la reivindicación 9, que comprende los pasos de:
(a) proporcionar una solución de glutaminil ciclasa humana en presencia de un ligando de unión, tal como un inhibidor de glutaminil ciclasa, en un tampón adecuado tal como tampón Bis-Trls 25 mM, pH 6,8 /NaCI 1 mM;
(b) mezclar la solución con una solución de cristalización que comprende 2-metil-2,4-pentanodiol al 3% (v/v) y 4PEG al 11 % (p/v); y
(c) incubar la mezcla en condiciones para fomentar la difusión de vapor en gota colgante durante un tiempo suficiente para producir el cocristal de glutaminil ciclasa humana unida a un ligando de unión, tal como un inhibidor de glutaminil ciclasa.
11. Un cristal que comprende glutaminil ciclasa murina que tiene un grupo espacial caracterizado de P212121 y que tiene dimensiones de celda unidad de +/- 5% de a = 42,7 A, b = 84, A, c = 96,5 A, a = 9,°, (3 = 9,° y y = 9,°
12. Un cristal como se define en la reivindicación 11, que tiene unas dimensiones de celda unidad de a = 42,7 A, b = 83, A, c = 95,7 A, a = 9,°, (3 = 9,° y y = 9,°
13. Un cristal como se define en la reivindicación 11, que tiene unas dimensiones de celda unidad de a = 42,7 A, b = 84,6 A, c = 96,5 A, a = 9,°, (3 = 9,° y y = 9,°
14. Un cristal como se define en la reivindicación 11, que tiene unas dimensiones de celda unidad de a = 42,7 A, b = 84,6 A, c = 97,2 A, a = 9,°, (3 = 9,° y y = 9,°
15. Un cristal como se define en cualquiera de las reivindicaciones 11 a 14, que difracta rayos x para la determinación de las coordenadas atómicas del cristal a una resolución de entre 1,9 A y 32, A.
16. Un cristal como se define en cualquiera de las reivindicaciones 11 a 15, en donde la glutaminil ciclasa murina consiste en los residuos de aminoácidos A36 a L362 de SEQ ID NO: 13.
17. Un cristal como se define en cualquiera de las reivindicaciones 11 a 16, que comprende un bolsillo de unión proporcionado por los residuos D16, E23 y H331 de SEQ ID NO: 13 según las coordenadas de las figuras 2 a 4.
18. Un cristal como se define en la reivindicación 16 o la reivindicación 17, que comprende un puente disulfuro entre los residuos C14 y C165 de SEQ ID NO: 13.
19. Un método de identificar un inhibidor de glutaminil ciclasa murina que comprende los siguientes pasos:
(a) generar un modelo tridimensional de glutaminil ciclasa murina usando las coordenadas estructurales descritas en cualquiera de las figuras 2 a 4;
(b) analizar el bolsillo de unión proporcionado por los residuos D16, E23 y H331 de SEQ ID NO: 13 según las coordenadas de las figuras 2 a 4;
(c) realizar un análisis de modelado por ordenador para identificar un compuesto inhibidor que se puede asociar con el bolsillo de unión de glutaminil ciclasa murina.
2. Un método como se define en la reivindicación 19, en donde el paso de realizar el análisis de modelado por ordenador para identificar dicho compuesto inhibidor comprende identificar dicho compuesto de una biblioteca de compuestos;
o identificar dicho compuesto en una base de datos;
o diseñar el compuesto a partir de un inhibidor de glutaminil ciclasa humana conocido.
21. Un método de preparar el cristal de glutaminil ciclasa murina como se describe en cualquiera de las reivindicaciones 11 a 18, que comprende los pasos de:
(a) proporcionar una solución de glutaminil ciclasa murina, opcionalmente en presencia de un inhibidor conocido de glutaminil ciclasa, en un tampón adecuado tal como tampón Bis-Tris 15 mM, pH 6,8 /NaCI 1 mM;
(b) mezclar la solución con una solución de cristalización que comprende acetato de sodio ,1 M pH 5,3, sulfato de amonio ,2 M y 2 MME-PEG al 12% (p/v); y
(c) incubar la mezcla en condiciones para fomentar la difusión de vapor en gota colgante durante un tiempo suficiente para producir el cristal de glutaminil ciclasa murina.
22. Un método para preparar un cocristal de glutaminil ciclasa murina, que comprende los pasos de:
(a) proporcionar una solución de glutaminil ciclasa murina en presencia de un inhibidor conocido de glutaminil ciclasa, en un tampón adecuado tal como tampón Bis-Tris 15 mM, pH 6,8 /NaC11 mM;
(b) mezclar la solución con una solución de cristalización que comprende acetato de sodio ,1 M pH 5,3, sulfato de amonio ,2 M y 2 MME-PEG al 12% (p/v); y
(c) incubar la mezcla en condiciones para fomentar la difusión de vapor en gota colgante durante un tiempo suficiente para producir el cocristal de glutaminil ciclasa murina unida a un ligando de unión, tal como un inhibidor de glutaminil ciclasa.
23. Un método de diseñar, seleccionar y/u optimizar una entidad química que se une a todo o parte del bolsillo de unión o glutaminil ciclasa humana o murina según cualquiera de las figuras 1 a 4 que comprende los pasos de:
(a) proporcionar las coordenadas estructurales de dicho bolsillo de unión o glutaminil ciclasa humana o murina según cualquiera de las figuras 1 a 4 a un ordenador que comprende los medios para generar información estructural tridimensional a partir de dichas coordenadas estructurales según cualquiera de las figuras 1 a 4; y
(b) diseñar, seleccionar y/u optimizar dicha entidad química realizando una operación de ajuste entre dicha entidad química y dicha información estructural tridimensional de todo o parte de dicho bolsillo de unión o glutaminil ciclasa humana o murina.
Un método para evaluar la capacidad de un entidad química de asociarse con todo o parte del bolsillo de unión o glutaminil ciclasa humana o murina según cualquiera de las figuras 1 a 4 que comprende los pasos de:
(a) proporcionar las coordenadas estructurales de dicho bolsillo de unión o glutaminil ciclasa humana o murina según cualquiera de las figuras 1 a 4 a un ordenador que comprende los medios para generar información estructural tridimensional a partir de dichas coordenadas estructurales según cualquiera de las figuras 1 a 4;
(b) emplear medios computacionales para realizar una operación de ajuste entre la entidad química y todo o parte del bolsillo de unión o la glutaminil ciclasa humana o murina; y
(c) analizar los resultados de dicha operación de ajuste para cuantificar la asociación entre la entidad química y todo o parte del bolsillo de unión o glutaminil ciclasa humana o murina.
25. Un método para identificar un agonista o antagonista de la glutaminil ciclasa humana o murina según
cualquiera de las figuras 1 a 4, que comprende los pasos de:
(a) usar una estructura tridimensional del bolsillo de unión o glutaminil ciclasa humana o murina, que se ha generado a partir de las coordenadas estructurales según cualquiera de las figuras 1 a 4, para diseñar o seleccionar una entidad química;
(b) poner en contacto la entidad química con la glutaminil ciclasa humana o murina;
(c) seguir la actividad catalítica de la glutaminil ciclasa humana o murina; y
(d) clasificar la entidad química como un agonista o antagonista basado en el efecto de la entidad química sobre la actividad catalítica de glutaminil transferasa humana o murina.
26. Un método de diseñar un compuesto o complejo que se asocia con todo o parte del bolsillo de unión o
glutaminil ciclasa humana o murina según cualquiera de las figuras 1 a 4, que comprende los pasos de:
(a) proporcionar las coordenadas estructurales de dicho bolsillo de unión o glutaminil ciclasa humana o murina según cualquiera de las figuras 1 a 4 a un ordenador que comprende los medios para generar información estructural tridimensional a partir de dichas coordenadas estructurales según cualquiera de las figuras 1 a 4; y
usar el ordenador para realizar una operación de ajuste para asociar una primera entidad química con tordo o parte del bolsillo de unión;
realizar una operación de ajuste para asociar al menos una segunda entidad química con todo o parte del bolsillo de unión;
cuantificar la asociación entre la primera y segunda entidad química y todo o parte del bolsillo de unión; opcionalmente repetir los pasos (b) a (d) con otra primera y segunda entidad química, seleccionando una primera y segunda entidad química basada en dicha asociación cuantificada de todo de dicha primera y segunda entidad química;
opcionalmente, inspeccionar visualmente la relación de la primera y segunda entidad química entre sí en relación al bolsillo de unión en una pantalla de ordenador usando la representación gráfica tridimensional del bolsillo de unión y dicha primera y segunda entidad química; y
ensamblar la primera y segunda entidad química en un compuesto o complejo que se asocia con todo o parte de dicho bolsillo de unión por construcción de modelo.
(b)
(c)
(d)
(e)
(f)
(9)
Patentes similares o relacionadas:
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Reducción de sacarosa y generación de fibra insoluble en zumos, del 27 de Mayo de 2020, de DANISCO US INC: Un método para producir una bebida baja en calorías y alta en fibras insolubles comprendiendo; tratamiento de una bebida que contiene sacarosa con una glucosiltransferasa para […]
Microorganismo con productividad de l-lisina aumentada y procedimiento para producir l-lisina utilizando el mismo, del 27 de Mayo de 2020, de CJ CHEILJEDANG CORPORATION: Una subunidad beta prima (subunidad-β') mutante de la ARN polimerasa, en la que la subunidad beta prima (subunidad-β') mutante de la ARN polimerasa tiene […]
Una célula acetogénica genéticamente modificada, del 13 de Mayo de 2020, de Evonik Operations GmbH: Una célula microbiana acetogénica que es capaz de producir al menos un alcohol superior a partir de una fuente de carbono, en donde la célula microbiana acetogénica está genéticamente […]
Construcción de nuevas variantes de dextransacarasa DSR-S por ingeniería genética, del 6 de Mayo de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: 1. Una dextransacarasa que consiste en una secuencia que tiene el 90 %, el 95 % o el 98 % de similitud de secuencia con una secuencia de aminoácidos seleccionada del fragmento […]
Células virales resistentes y sus usos, del 22 de Abril de 2020, de Sigma-Aldrich Co. LLC: Una línea celular de ovario de hámster chino (CHO) modificada genéticamente en la que la entrada y/o propagación del virus diminuto del ratón (MVM) […]
Cepas bacterianas que expresan genes de metilasa y sus usos, del 22 de Abril de 2020, de LOMA LINDA UNIVERSITY: Una bacteria aislada para usar en la producción de ADN plasmídico metilado, en donde la bacteria comprende un polinucleótido exógeno que codifica una CpG metilasa […]
Construcción de nuevas variantes de dextransacarasa DSR-S por ingeniería genética, del 22 de Abril de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: Una secuencia de nucleótidos que consiste en una secuencia de nucleótidos como se define en SEQ ID NO: 1 o la secuencia complementaria a la secuencia como […]