Dominios variables de anticuerpos de conejo modificados por ingeniería genética y usos de los mismos.
Método para producir un dominio VL o VH de conejo que se une inmunoespecíficamente a un antígeno,
en el que dicho método es un primer método que comprende:
a) seleccionar de una biblioteca de expresión en fago un conjunto de secuencias de ADN que codifican para dominios VH o VL que se unen inmunoespecíficamente a dicho antígeno, preparándose dicha biblioteca de expresión en fago a partir de secuencias de ADN o ADNc que codifican para dominios VH o VL y que se obtuvieron a partir de una muestra biológica de un conejo que contenía células que expresan inmunoglobulinas; y
b) expresar dicho conjunto de secuencias, o un subconjunto del mismo, en bacterias como una proteína de fusión con CAT, seleccionar bacterias que tienen resistencia a cloranfenicol en virtud de la expresión de CAT y obtener secuencias que codifican para dominios VH o VL de conejo a partir de las bacterias seleccionadas, mediante lo cual dicha resistencia bacteriana a cloranfenicol conferida por dicha fusión con CAT se correlaciona con la solubilidad, estabilidad y/o falta de agregación de dicha secuencia fusionada con CAT;
o un segundo método que comprende:
a) expresar secuencias de ADN o ADNc que codifican para dominios VH o VL en bacterias como una proteína de fusión con CAT, en el que dichas secuencias de ADN o ADNc se obtuvieron a partir de una muestra biológica de un conejo que contenía células que expresan inmunoglobulinas;
b) seleccionar bacterias que tienen resistencia a cloranfenicol en virtud de la expresión de CAT y obtener el conjunto de secuencias que codifican para dominios VH o VL de conejo a partir de las bacterias seleccionadas, mediante lo cual dicha resistencia bacteriana a cloranfenicol conferida por dicha fusión con CAT se correlaciona con la solubilidad, estabilidad y/o falta de agregación de dicha secuencia fusionada con CAT; y
c) seleccionar de una biblioteca de expresión en fago secuencias de ADN que codifican para dominios VH o VL que se unen inmunoespecíficamente a dicho antígeno, mediante lo cual se prepara dicha biblioteca a partir de dicho conjunto de secuencias, o subconjunto del mismo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/PT2008/000018.
Solicitante: Technophage, Investigação E Desenvolvimento Em Biotecnologia, SA.
Nacionalidad solicitante: Portugal.
Dirección: Avenida Professor Egas Moniz Edificio Egas Moniz Piso 2 Sala A8 1649-028 Lisboa PORTUGAL.
Inventor/es: BRAZ GONCALVES,JOÃO MANUEL, CASTANHEIRA AIRES DA SILVA,FREDERICO NUNO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
PDF original: ES-2540807_T3.pdf

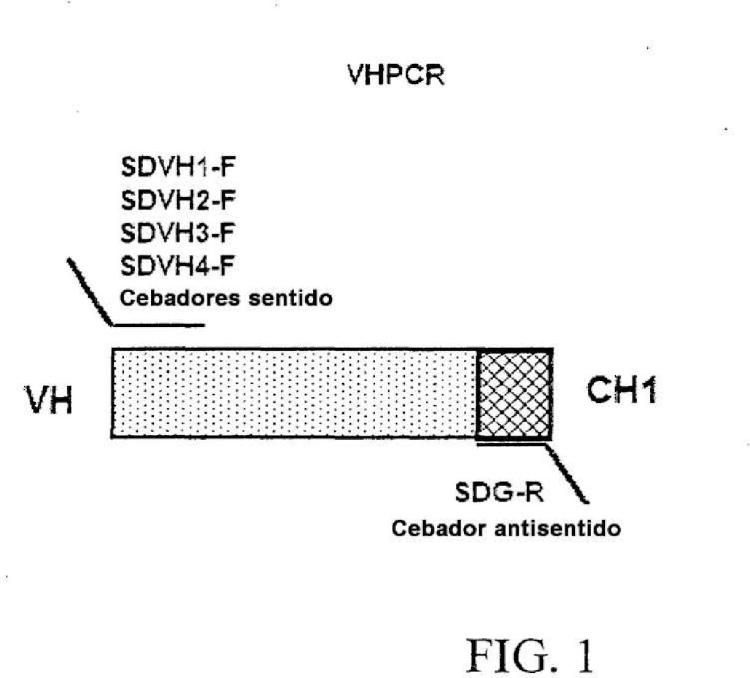
Fragmento de la descripción:
Dominios variables de anticuerpos de conejo modificados por ingeniería genética y usos de los mismos
1. Campo de la invención
La presente invención se refiere a métodos para seleccionar y producir polipéptidos que se unen inmunoespecíficamente a un antígeno, polipéptidos que comprenden dominios de unión que se derivan de inmunoglobulina de conejo. Usando armazones de cadena pesada o cadena ligera de anticuerpos de conejo, los métodos de la invención permiten la identificación de regiones de entramado y bucles de CDR novedosos y que confieren estabilidad y/o afinidad potenciada con respecto a dominios variables de inmunoglobulina aislados, en particular, en relación con los derivados de anticuerpos de ratón. La estabilidad y/o afinidad potenciadas de los dominios variables de la invención permiten su uso en la producción de herramientas de investigación y polipéptidos terapéuticos que presentan inmunoespecificidad por un antígeno de interés, incluyendo polipéptidos de un solo dominio de unión, es decir, anticuerpos de un solo dominio que comprenden uno de un dominio VH o VL.
2. Antecedentes
Los anticuerpos están compuestos por dos cadenas denominadas cadenas ligera y pesada. La cadena ligera contiene un dominio variable amino terminal (dominio VL) y un dominio constante carboxilo terminal (CL). La cadena pesada está compuesta por un dominio variable amino terminal (VH) y tres dominios constantes (CH1, CH2, CH3). El sitio de unión del anticuerpo está ubicado en los dominios VL y VH y está constituido por seis bucles hipervariables que representan las regiones determinantes de complementariedad (CDR). Tanto las regiones VL como las VH contienen tres bucles de CDR (CDR1, CDR2 y CDR3), que están conectados a una región de entramado de lámina beta conservada estructuralmente.
Con el desarrollo de la tecnología de hibridomas, se hizo posible producir una sola población de anticuerpos, o anticuerpos monoclonales (AcM), que se dirigen específicamente a un solo epítopo abriendo una revolución en el campo de descubrimiento de fármacos. Sin embargo, problemas con la producción de anticuerpos y las respuestas in vivo, incluyendo inmunogenicidad y efectos secundarios asociados con citocinas, han conducido a la investigación de la alteración de la estructura y/o la función de los anticuerpos al mismo tiempo que todavía se conserva la unión inmunoespecífica. Estudios han intentado reducir el anticuerpo a su forma funcional más pequeña, sin cambiar significativamente el reconocimiento del antígeno y la afinidad por el mismo. La identificación del fragmento de anticuerpo más pequeño que puede unirse al antígeno ha evolucionado desde moléculas de anticuerpo completas o IgG hasta fragmentos Fab y Fv de cadena sencilla recombinantes.
Debido al progreso de la recombinación génica en la década de 198, fue posible la generación rápida y fácil de dominios variables recombinantes. Usando la reacción en cadena de la polimerasa, se clonaron diversos repertorios de genes que codifican para dominios VH y VL a partir del ADN genómico de animales inmunizados, permitiendo la caracterización de funcionalidades y actividades de unión múltiples contra varios antígenos. No obstante, los fragmentos de dominios variables aislados inicialmente eran escasamente solubles y difíciles de producir.
Los problemas en la producción se abordaron con la caracterización de anticuerpos de camélidos, que son moléculas diméricas que comprenden sólo cadenas pesadas. No sólo el descubrimiento de la molécula dimérica abordaba muchas cuestiones con respecto a la producción de anticuerpos recombinantes, sino que la molécula también resaltó la posibilidad de que la cadena pesada de moléculas de inmunoglobulina pudiese dirigir la unión inmunoespecífica en ausencia de una cadena ligera. Actualmente está ampliamente aceptado que las cadenas pesadas de Ig pueden conservar una capacidad de unión al antígeno significativa en ausencia de una cadena ligera. También hay evidencias a partir de estudios estructurales de que la región CDR3 del dominio Vh es el más significativo de los dominios de CDR con respecto a la inmunoespecificidad. Esto se basa en los hallazgos de que los residuos de aminoácido de HCDR3 proporcionan la mayor parte del área de contacto de superficie y son cruciales en la interacción molecular con el antígeno. Por consiguiente, puede ser posible una reducción adicional del tamaño de la proteína de unión a antígeno hasta proteínas de unión de un solo dominio basándose en dominios Vh de inmunoglobulina.
2.1 Anticuerpos de conejo
El repertorio de anticuerpos de conejo, que en forma de anticuerpos policlonales se ha utilizado durante décadas, es una fuente extraordinaria de anticuerpos que muestran fuerte afinidad y alta especificidad (Mage et al., 26). Además, los conejos, que pertenecen al orden Lagomorpha, están distanciados evolutivamente de ratones y ratas, que pertenecen al orden Rodentia. En consecuencia, epítopos conservados entre antígenos humanos y de roedor que son invisibles para AcM de roedor (y también AcM humanos generados a partir de ratones transgénicos con genes de inmunoglobulina humanos) pueden reconocerse a menudo por anticuerpos policlonales de conejo.
Los AcM de conejo generados mediante presentación en fago ofrecen ventajas adicionales debido al hecho de que el fenotipo y el genotipo se seleccionan al mismo tiempo. El conocimiento de la secuencia de AcM de conejo permite la generación fácil de una variedad de formatos de AcM, incluyendo anticuerpos de un solo dominio, scFv, Fab e IgG, y, de manera más importante, humanización y maduración por afinidad (Rader et al., 2; Steinberger et al., 2; Rader, 21). En consecuencia, los AcM de conejo generados mediante presentación en fago han llegado a ser reactivos prometedores para aplicaciones terapéuticas en seres humanos.
En conejos normales, el 7-9% de las moléculas de Ig y células B portan los alotipos VHa debido al uso del segmento génico de VH D-proximal, VH1, en transposiciones génicas VDJ. En conejos parecen producirse transposiciones de una variedad de segmentos génicos Vk y VI, puesto que se ha encontrado una variedad de diferentes secuencias de VL entre las secuencias de ADNc expresadas.
El repertorio de células B que se desarrolla en médula ósea de conejo está limitado por el pequeño número de segmentos génicos de VH usados en transposiciones génicas VDJ. Mientras que se transponen segmentos génicos Vk múltiples en células del linaje B de la médula ósea, la mayoria de las células del linaje B transponen el mismo gen de VH, VH1, que codifica para las secuencias alotípicas de VHa. El repertorio también está limitado por el uso de un pequeño número de segmentos génicos JH y D en transposiciones VDJ. Se encuentra JH4 en el 8% de las transposiciones génicas VDJ y JH2 en el otro 2%; los otros tres segmentos génicos JH funcionales se usan pocas veces. Además, a partir del total de 12 segmentos génicos D, la mayoría de las transposiciones génicas VDJ usan D2a (D9), D2b (Df), D3 o D5; D4 y D6 se utilizan pocas veces. Aunque el uso limitado de segmentos génicos de VH, D y JH daría como resultado un repertorio de VDJ limitado, se encuentran nucleótidos N en esencialmente todas las uniones VD y DJ desde las primeras transposiciones durante la diferenciación celular. La alta diversidad de regiones N entre transposiciones génicas VDJ da como resultado un repertorio mucho más grande que el esperado a partir de transposiciones de un número limitado de segmentos génicos V, D y J. El tamaño de este repertorio no se ha estimado. Sin embargo, dado que esencialmente todos los genes de VDJ están diversificados de manera somática en la periferia después de que las células B abandonen la médula ósea y otros sitios primarios de linfopoyesis B, es concebible que el repertorio que se desarrolla en los sitios primarios de desarrollo de células B sea funcionalmente insuficiente.
Después de que se produzcan transposiciones génicas de Ig en células B en sitios tales como la médula ósea de conejos jóvenes, células B con IgM inmaduras experimentan una diversificación adicional del repertorio de Ig en el apéndice y otros tejidos linfoides asociados al intestino. Estos sitios parecen promover el desarrollo de un repertorio preinmunitario primario.
Se encuentra conversión génica de secuencias de cadena pesada y ligera transpuestas en el apéndice de conejo a las 3-4 semanas de edad. Se produce hipermutación somática en las regiones D y J, que carecen de donadores de conversión génica conocidos. La región JH también se diversifica mediante hipermutación somática y por tanto es probable que se produzca también hipermutación somática en los segmentos... [Seguir leyendo]
Reivindicaciones:
1. Método para producir un dominio Vl o Vh de conejo que se une inmunoespecíficamente a un antígeno, en el que dicho método es un primer método que comprende:
a) seleccionar de una biblioteca de expresión en fago un conjunto de secuencias de ADN que codifican para dominios Vh o Vl que se unen inmunoespecíficamente a dicho antígeno, preparándose dicha biblioteca de expresión en fago a partir de secuencias de ADN o ADNc que codifican para dominios VH o VL y que se obtuvieron a partir de una muestra biológica de un conejo que contenía células que expresan ¡nmunoglobulinas; y
b) expresar dicho conjunto de secuencias, o un subconjunto del mismo, en bacterias como una proteína de fusión con CAT, seleccionar bacterias que tienen resistencia a cloranfenicol en virtud de la expresión de CAT y obtener secuencias que codifican para dominios Vh o Vl de conejo a partir de las bacterias seleccionadas, mediante lo cual dicha resistencia bacteriana a cloranfenicol conferida por dicha fusión con CAT se correlaciona con la solubilidad, estabilidad y/o falta de agregación de dicha secuencia fusionada con CAT;
o un segundo método que comprende:
a) expresar secuencias de ADN o ADNc que codifican para dominios Vh o Vl en bacterias como una proteína de fusión con CAT, en el que dichas secuencias de ADN o ADNc se obtuvieron a partir de una muestra biológica de un conejo que contenía células que expresan ¡nmunoglobulinas;
b) seleccionar bacterias que tienen resistencia a cloranfenicol en virtud de la expresión de CAT y obtener el conjunto de secuencias que codifican para dominios Vh o Vl de conejo a partir de las bacterias seleccionadas, mediante lo cual dicha resistencia bacteriana a cloranfenicol conferida por dicha fusión con CAT se correlaciona con la solubilidad, estabilidad y/o falta de agregación de dicha secuencia fusionada con CAT; y
c) seleccionar de una biblioteca de expresión en fago secuencias de ADN que codifican para dominios Vh o Vl que se unen inmunoespecíficamente a dicho antígeno, mediante lo cual se prepara dicha biblioteca a partir de dicho conjunto de secuencias, o subconjunto del mismo.
2. Método según la reivindicación 1, en el que dicha muestra biológica de conejo es de un conejo que se ha inmunizado con dicho antígeno.
3. Método según la reivindicación 1, en el que, en dicho primer método, la etapa a) se repite una o más veces o en el que, en dicho segundo método, la etapa c) se repite una o más veces.
4. Método según la reivindicación 1, en el que dicha muestra biológica comprende células plasmáticas, tejido linfoide, médula ósea o tejido de apéndice.
5. Método según la reivindicación 4, en el que dicha muestra comprende tejido linfoide y dicho tejido linfoide es tejido de bazo o tejido de ganglios linfáticos.
6. Polipéptido que se une inmunoespecíficamente a un antígeno, en el que dicho polipéptido comprende uno o ambos de un dominio Vh o Vl de conejo, y al menos uno de
(a) un dominio FR1 de VH que tiene la secuencia de aminoácidos QEQLMETESGGGAEGGLVKPGASLTLTCTAS (SEQ ID NO: 57);
(b) un dominio FR3 de Vh que tiene la secuencia de aminoácidos YATWVNGRFTLSRDIDQSTGCLQLNSLTAADTATYYCAR (SEQ ID NO: 95);
(c) un dominio FR1 de VL que tiene la secuencia de aminoácidos ELVLTQTPPSLSASVGETVRIRC (SEQ ID NO: 15);
(d) un dominio FR3 de VL que tiene la secuencia de aminoácidos GVSSRFKGSGSGTQFTLTISGVQCADAATYYC; (SEQ ID NO: 25); o
(e) un dominio FR4 de VL que tiene la secuencia de aminoácidos FAFGGGTELEIL (SEQ ID NO: 21).
7. Polipéptido según la reivindicación 6, que comprende además al menos uno de
(f) un dominio FR2 de VH que tiene la secuencia de aminoácidos WVRQAPGKGLEWIG (SEQ ID NO: 69);
(g) un dominio FR4 de Vh que tiene la secuencia de aminoácidos WGQGTLVTVSS (SEQ ID NO: 139);
(h) un dominio FR1 de Vl que tiene la secuencia de aminoácidos ELVLTQTPSSVSAAVGGTVTINC (SEQ ID NO: 155);
(i) dominio FR2 de Vl que tiene la secuencia de aminoácidos WYQQKPEKPPTLLIS (SEQ ID NO: 174) o WYQQKPGQRPKLLIY (SEQ ID NO: 181);
(j) un dominio FR3 de Vl que tiene la secuencia de aminoácidos GVPPRFSGSGSGTDYTLTIGGVQAEDVATYYC (SEQ ID NO: 183); o
(k) un dominio FR4 de VL que tiene la secuencia de aminoácidos FGAGTNVEIK (SEQ ID NO: 26).
8. Polipéptido según la reivindicación 6 ó 7, en el que dicho polipéptido comprende además al menos uno de
(a) en el dominio FR2 de Vh, una fenilalanina en la posición 46;
(b) en el dominio FR2 de VH, un ácido glutámico en la posición 53;
(c) en el dominio FR2 de VH, una arginina en la posición 54;
(d) en el dominio FR2 de VH, una glicina en la posición 56;
(e) en el dominio FR2 de VH, una alanina en la posición 58;
(f) en el dominio CDR1 de VH, una cisterna en la posición 44;
(g) en el dominio CDR2 de VH, una cisterna en la posición 59;
(h) en el dominio FR4 de Vh, una arginina en la posición 126;
(i) en el dominio FR2 de Vl, una fenilalanina o una tirosina en la posición 39;
(j) en el dominio FR2 de Vl, una lisina en la posición 45; o
(k) en el dominio FR3 de Vl; una cisteína en la posición 91,
en el que dichas posiciones son según las posiciones de las alineaciones de secuencias del dominio Vh o Vl en las figuras 3 y 4, respectivamente.
9. Polipéptido que se une inmunoespecíficamente a un antígeno, en el que dicho polipéptido comprende uno o ambos de un dominio Vh o Vl de conejo, y al menos uno de
(f) un dominio FR2 de Vh que tiene la secuencia de aminoácidos WVRQAPGKGLEWIG (SEQ ID NO: 69);
(g) un dominio FR4 de Vh que tiene la secuencia de aminoácidos WGQGTLVTVSS (SEQ ID NO: 139);
(h) un dominio FR1 de Vl que tiene la secuencia de aminoácidos ELVLTQTPSSVSAAVGGTVTINC (SEQ ID NO: 155);
(i) dominio FR2 de Vl que tiene la secuencia de aminoácidos WYQQKPEKPPTLLIS (SEQ ID NO: 174) o WYQQKPGQRPKLLIY (SEQ ID NO: 181);
(j) un dominio FR3 de Vl que tiene la secuencia de aminoácidos GVPPRFSGSGSGTDYTLTIGGVQAEDVATYYC (SEQ ID NO: 183); o
(k) un dominio FR4 de Vl que tiene la secuencia de aminoácidos FGAGTNVEIK (SEQ ID NO: 26); y en el que dicho polipéptido comprende además al menos uno de
(a) en el dominio FR2 de VH, una fenilalanina en la posición 46;
(b) en el dominio FR2 de Vh, un ácido glutámico en la posición 53;
(c) en el dominio FR2 de Vh, una arginina en la posición 54;
(d) en el dominio FR2 de Vh, una glicina en la posición 56;
(e) en el dominio FR2 de Vh, una alanina en la posición 58;
(f) en el dominio CDR1 de Vh, una cisterna en la posición 44;
(g) en el dominio CDR2 de Vh, una cisteína en la posición 59;
(h) en el dominio FR4 de VH, una arginina en la posición 126;
(i) en el dominio FR2 de VL, una fenilalanina o una tirosina en la posición 39;
(j) en el dominio FR2 de Vl, una lisina en la posición 45; o
(k) en el dominio FR3 de Vl; una cisteína en la posición 91
en el que dichas posiciones son según las posiciones de las alineaciones de secuencias del dominio VH o Vl en las figuras 3 y 4, respectivamente.
1. Anticuerpo que comprende el polipéptido según la reivindicación 6, 7, 8 ó 9 o un fragmento de unión a antígeno del mismo; en el que un dominio Vh o Vl de dicho polipéptido se pliega para formar un polipéptido soluble, no agregado que permite la selección a una concentración de cloranfenicol de al menos 1,8 mM cuando se fusiona con CAT; y en el que el dominio Vh o Vl tiene una Tm de al menos 54°C.
11. Anticuerpo o fragmento según la reivindicación 1, en el que dicho anticuerpo es un anticuerpo de cadena sencilla, un anticuerpo de un solo dominio, un minicuerpo, un diacuerpo, un anticuerpo biespecífico o un nanocuerpo; o en el que dicho anticuerpo es un fragmento de anticuerpo que es un fragmento Fab, Fab, F(ab)2 o Fv.
12. Anticuerpo o fragmento según la reivindicación 1, en el que dicho anticuerpo o dicho fragmento no comprende un dominio CH1.
13. Versión quimérica o humanizada del anticuerpo o fragmento según una cualquiera de las reivindicaciones 1-12.
14. Anticuerpo o fragmento según una cualquiera de las reivindicaciones 1-13, en el que dicho antígeno no es inmunogénico en ratones o ratas.
15. Método según la reivindicación 1, en el que dicho antígeno no es inmunogénico en ratones o ratas.
16. Polipéptido según la reivindicación 6, 7, 8 ó 9, en el que dicho polipéptido no tiene uno o más de un dominio CHi, dominio CH2, dominio CH3 o dominio CL; o no tiene uno de un dominio VH o VL; y en el que un dominio VH o VL de dicho polipéptido se pliega para formar un polipéptido soluble, no agregado que permite la selección a una concentración de cloranfenicol de al menos 1,8 mM cuando se fusiona con CAT; y en el que el dominio Vh o Vl tiene una Tm de al menos 54°C.
17. Polipéptido según la reivindicación 16, que no comprende un dominio VH de conejo.
18. Polipéptido según la reivindicación 16, que no comprende un dominio VH de una especie distinta de conejo.
19. Polipéptido según la reivindicación 16, que no comprende un dominio VL de conejo.
2. Polipéptido según la reivindicación 16, que no comprende un dominio VL de una especie distinta de conejo.
21. Polipéptido según una cualquiera de las reivindicaciones 16-2, que no comprende un dominio CH2.
22. Polipéptido según una cualquiera de las reivindicaciones 16-2, que no comprende un dominio CH3.
23. Polipéptido según una cualquiera de las reivindicaciones 16-2, que no comprende un dominio CH1
24. Polipéptido según la reivindicación 16, en el que dicho antígeno no es inmunogénico en ratones o ratas.
25. Polipéptido según la reivindicación 16, en el que dicho polipéptido se conjuga además con un agente terapéutico, un péptido que interacciona con albúmina, un péptido que interacciona con fibronectina, fibronectina, albúmina, proteína A o proteína G.
26. Anticuerpo o fragmento según la reivindicación 1, en el que dicho anticuerpo o fragmento se conjuga además con un agente terapéutico, un péptido que interacciona con albúmina, un péptido que interacciona con fibronectina, fibronectina, albúmina, proteína A o proteína G.
27. Método según la reivindicación 1, en el que dicha selección es a una concentración de cloranfenicol de al menos 1,8 mM; el dominio VH o VL recombinante tiene una Tm de al menos 54°C; y/o el dominio VH o VL recombinante muestra una Kd para dicho antígeno de no más de 2 nM.
28. Polipéptido de fusión que comprende CAT fusionada con un dominio Vh o Vl de conejo, comprendiendo dicho dominio Vh o Vl el polipéptido según la reivindicación 6, 7, 8 ó 9.
29. Polipéptido de fusión según la reivindicación 28, en el que dicho dominio Vh o Vl se pliega para formar un polipéptido soluble, no agregado que permite la selección a una concentración de cloranfenicol de al menos 1,81 mM cuando se fusiona con la CAT; y en el que el dominio Vh o Vl tiene una Tm de al menos 54°C.
3. Polipéptido de fusión según la reivindicación 28, en el que dicho dominio carece de uno o más de un dominio CHi, dominio CH2, dominio CH3 o dominio CL; o que carece de uno de un dominio VH o VL.
31. Polipéptido de fusión que comprende CAT fusionada con el anticuerpo o fragmento según una cualquiera de las reivindicaciones 1-14 y 26.
32. Polipéptido de fusión que comprende CAT fusionada con el polipéptido según una cualquiera de las
reivindicaciones 16-25.
33. Polinucleótido que codifica para un polipéptido de fusión según una cualquiera de las reivindicaciones 28-32.
34. Vector de expresión que comprende el polinucleótido según la reivindicación 33.
35. Célula huésped que comprende el polinucleótido según la reivindicación 34.
36. Célula huésped según la reivindicación 35, en la que dicha célula es una célula bacteriana.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Formulación anti-IFNAR1 estable, del 24 de Junio de 2020, de ASTRAZENECA AB: Una formulacion de anticuerpo que comprende: a. De 100 mg/ml a 200 mg/ml de anifrolumab; b. Lisina HCl 40 mM a 60 mM; c. Trehalosa […]
Proteínas y péptidos modificados, del 24 de Junio de 2020, de GLAXO GROUP LIMITED: Un dominio variable de inmunoglobulina único, que se une a TNFR1 y que se selecciona de cualquiera de las siguientes secuencias de aminoácidos: (a) DOM1h-131-206 caracterizada […]
Métodos para purificar una proteína objetivo de una o más impurezas en una muestra, del 17 de Junio de 2020, de EMD Millipore Corporation: Un metodo para purificar una proteina objetivo que contiene una region Fc de una o mas impurezas en una muestra, el metodo comprende las etapas de: a) poner en contacto […]
Dominios variables de inmunoglobulina, del 10 de Junio de 2020, de Ablynx NV: Dominio variable individual de inmunoglobulina de cadena pesada (ISVD), en que el residuo aminoacídico en la posición 89 es L y el residuo […]
Criterio de valoración terapéutico equivalente para inmunoterapia de enfermedades basada en antiCTLA-4, del 10 de Junio de 2020, de E. R. Squibb & Sons, L.L.C: Un anticuerpo antiCTLA-4 para su uso en el tratamiento de cáncer en un sujeto, tratamiento que comprende inducir un acontecimiento liminar […]