Células madre hematopoyéticas adecuadas para el trasplante, su preparación y composiciones farmacéuticas que las comprenden.
Un método in vitro para preparar una población de células que comprende células madre hematopoyéticas enriquecidas con progenitores primitivos inmaduros,
comprendiendo el método introducir en las células madre recogidas un fragmento de ADN que comprende la secuencia de CXCR4.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IL2004/001018.
Solicitante: YEDA RESEARCH AND DEVELOPMENT CO. LTD..
Inventor/es: LAPIDOT, TSVEE, KAHN,JOY.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de mamíferos; Composiciones que comprenden tejidos o células indeterminadas; Composiciones que comprenden células madre no embrionarias; Células modificadas genéticamente (vacunas o preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00).
- A61K35/28 A61K 35/00 […] › Médula ósea; Células madre hematopoyéticas; Células madre mesenquimales de cualquier origen, por ejemplo células madre derivadas de tejido adiposo.
- C07K14/715 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › para citoquinas; para linfoquinas; para interferones.
- C12N5/0789 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células madre; Células progenitoras multipotentes.
PDF original: ES-2534724_T3.pdf

Fragmento de la descripción:
Células madre hematopoyéticas adecuadas para el trasplante, su preparación y composiciones farmacéuticas que las comprenden CAMPO DE LA INVENCIÓN
La presente invención se refiere a células madre hematopoyéticas adecuadas para el trasplante y a métodos para su preparación.
ANTECEDENTES DE LA INVENCIÓN
Procesos de trasplante clínicos y experimentales de células madre hematopoyéticas (HSC) imitan el proceso fisiológico de la migración de HSC de la circulación a la médula ósea (BM) que se produce durante el desarrollo embrionario tardío y la hematopoyesis en estado estacionario en adultos a lo largo de la vida1-3. La transferencia de genes en HSC humanas puede servir como una herramienta prometedora en la corrección de una amplia diversidad de trastornos hematopoyéticos y genéticos. Los trasplantes de HSC se pueden utilizar para suministrar de forma duradera estas células genéticamente modificadas a la BM, que a su vez liberarán células maduras con el gen corregido en la circulación a lo largo de la vida.
Una eficacia incrementada del injerto de células madre podría mejorar el resultado de los trasplantes clínicos, así como los protocolos de terapia génica, y podría conseguirse mediante la modulación de la capacidad de las células madre de alojarse y repoblar la BM receptora. Para este fin, es necesaria una mejor comprensión de los mecanismos que regulan estos procesos.
Las interacciones entre el factor derivado de estroma 1 (SDF-1) de quimioquinas, al que también se alude como CXCL12, y su receptor CXCR4 desempeñan un papel esencial en la siembra de células madre de la BM durante el desarrollo embrionario murino10, 11. Previamente, los autores de la invención fueron capaces de demostrar, utilizando ratones NOD/SCID inmunodeficientes como receptores, que tanto la migración (traslado) in vivo a corto plazo como el alto nivel de repoblación multilinaje de la médula ósea murina por parte de células CD34+ enriquecidas humanas dependen de interacciones SDF-1/CXCR412-15 . En apoyo de estos datos se ha demostrado que altos niveles de expresión de CXCR4 en células CD34+ humanas, o una alta motilidad direccional in vitro inducida por SDF-1 se correlaciona con una recuperación más rápida en trasplantes clínicos tanto alogénicos como autólogos con selección positiva de células CD34+16, 17.
La expresión de CXCR4 es un proceso dinámico, que está regulado por factores medioambientales tales como citoquinas, quimioquinas, células del estroma, moléculas de adhesión y enzimas proteolíticas18. En células madre y progenitoras hematopoyéticas de origen humano, CXCR4 puede supra-regularse a partir de agrupaciones intracelulares mediante cultivo a corto plazo (~ 40 h) in vitro de citoquinas13, 19 o estimulación de CD34+ de la sangre del cordón umbilical (CB) con enzimas proteolíticas tales como MMP-2 y MMP-920. Esto potencia subsiguientemente su migración in vitro hacia un gradiente de SDF-113, así como sus capacidades de traslado y de repoblación in vivo en ratones NOD/SCID trasplantados y ratones NOD/SCID β2m trasplantados en serie12, 13, enlazando la autorenovación de células madre y el desarrollo con la motilidad. Un informe reciente ha demostrado que períodos de cultivo más largos con un cóctel de citoquinas resulta en una disminución de la expresión de CXCR4 en la superficie de la célula en células del CB22 enriquecidas en CD34+ y la repoblación reducida se documentó con progenitores humanos cultivados in vitro durante periodos23 más largos. Recientemente, los autores de la presente invención demostraron que células del CB clasificadas CD34+/CXCR4-albergan bajos niveles de CXCR4 intracelular, que, después de la estimulación de citoquinas in vitro a corto plazo, rápidamente se pueden expresar funcionalmente en la superficie celular para mediar en el traslado dependiente de SDF-1 y en la repoblación de ratones NOD/SCID trasplantados15.
Además de su papel central en la mediación de la migración direccional de células madre humanas y murinas24, las interacciones SDF-1/CXCR4 también están implicados en otras funciones de células madre. De manera importante, las interacciones SDF-1/CXCR4 también están involucradas en la retención de células madre y progenitoras en la BM10, 32, 33
. Esta hipótesis también ha sido confirmada por otros estudios que demostraron la implicación de interacciones SDF-1/CXCR4 en el anclaje de HSC humanas inyectadas directamente en el en la cavidad de la BM murina34, 35. La interferencia de estas interacciones induce la liberación/movilización de progenitores tanto humanos como murinos de la BM en la circulación36-41 .
Ratones transgénicos que sobre-expresan CD4 y CXCR4 humanas en sus células T CD4+ tienen niveles incrementados de estas células en su BM y sólo niveles muy bajos en la circulación42. Por lo tanto, la sobreexpresión de CXCR4 en células progenitoras CD34+ humanas puede facilitar su traslado y potencial repoblación.
Se han utilizado vectores lentivirales para introducir transgenes en células de repoblación SCID (SRCs) 43-46, debido a su capacidad única de transducir células no en división47. Además, se realizó un avance clínico significativo en la terapia génica en pacientes con inmunodeficiencia grave combinada (SCID) -X1 humana que resulta en una corrección completa del fenotipo de la enfermedad48, 49, demostrando que la terapia génica puede funcionar en la
práctica. Sin embargo, existe una evidencia emergente para un traslado deficiente8 y un bajo injerto9 de células CD34+ humanas retroviralmente transducidas.
Está bien documentado que bajas concentraciones de SDF-1 en sinergia con otras citoquinas de acción temprana potencian la proliferación tanto de células CD34+ humanas como células madre y progenitoras murinas, lo que sugiere un papel de esta quimioquina en la supervivencia de células progenitoras25-29, mientras que altos niveles de SDF-1 inducen la quiescencia de células iniciadoras de cultivo a largo plazo (LTCIC) humanas proliferantes y células madre CD34+ del hígado fetal humanas primitivas capaces de repoblación en serie de ratones NOD/SCID trasplantados30, 31.
Una de las desventajas del trasplante de BM son los niveles reducidos de larga duración de progenitores inmaduros tales como las células iniciadoras de cultivo a largo plazo (LTCIC) , (reducción de 1 log) en la BM de pacientes trasplantados en comparación con individuos sanos4-7 .
Células iniciadoras de cultivo a largo plazo (LTC-IC) son progenitores hematopoyéticos capaces de generar células unidades formadoras de colonias (CFU) después de 5 a 8 semanas (35 a 60 días) de cultivo en estroma de médula ósea (BM) y representan progenitores actualmente detectables in vitro. Se ha informado que cultivos a largo plazo iniciados con células CD38+CD34-de BM humana o sangre del cordón umbilical son capaces de seguir generando CFU durante al menos 100 días, es decir, más allá del período de LTC-IC estándar. Se utilizaron cultivos monocelulares de sangre de cordón umbilical individual para estudiar si la subpoblación de células CD34+CD38-es capaz de generar CFU más allá de 60 días ("células iniciadoras de cultivo a largo plazo extendido" o ELTC-IC) . A diferencia de LTC-IC de la sangre del cordón umbilical, ELTC-IC proliferan más tarde en el cultivo y son una población progenitora más quiescente. ELTC-IC genera de tres a cuatro veces más progenie que lo hacía LTC-IC (P < 0, 002) . Se trata de una jerarquía funcional de progenitores en cultivo a largo plazo, que se correlaciona con su grado de quiescencia. (Blood. 1 de noviembre de 1996; 88 (9) : 3306-13 Crooks GM et al.
SUMARIO DE LA INVENCIÓN
La invención se refiere a los siguientes puntos:
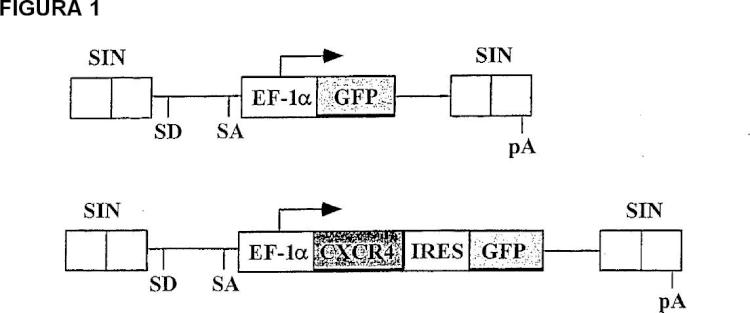
1. Un método in vitro para preparar una población de células que comprende células madre hematopoyéticas enriquecidas con progenitores primitivos inmaduros, comprendiendo el método introducir en las células madre recogidas un fragmento de ADN que comprende la secuencia de CXCR4.
2. El método de acuerdo con el punto 1, en el que la población de células exhibe una migración de células potenciada inducida por SDF-1 en respuesta a una concentración de SDF-1 igual a o menor que aproximadamente 50 ng/ml.
3. El método de acuerdo con el punto 1, en el que la población de células exhibe una migración de células potenciada inducida por SDF-1 en respuesta a una concentración de SDF-1 igual a o mayor que aproximadamente 1 μg/ml.
4. El método de acuerdo con el punto 1, en el que la población de células exhibe una reducción en la desensibilización por parte de SDF-1 en respuesta a una concentración de SDF-1 igual a o mayor que aproximadamente 1 μg/ml.... [Seguir leyendo]
Reivindicaciones:
1. Un método in vitro para preparar una población de células que comprende células madre hematopoyéticas enriquecidas con progenitores primitivos inmaduros, comprendiendo el método introducir en las células madre recogidas un fragmento de ADN que comprende la secuencia de CXCR4.
2. El método de acuerdo con la reivindicación 1, en el que la población de células exhibe una migración de células potenciada inducida por SDF-1 en respuesta a una concentración de SDF-1 igual a o menor que aproximadamente 50 ng/ml.
3. El método de acuerdo con la reivindicación 1, en el que la población de células exhibe una migración de células potenciada inducida por SDF-1 en respuesta a una concentración de SDF-1 igual a o mayor que aproximadamente 1 μg/ml.
4. El método de acuerdo con la reivindicación 1, en el que la población de células exhibe una reducción en la desensibilización por parte de SDF-1 en respuesta a una concentración de SDF-1 igual a o mayor que aproximadamente 1 μg/ml.
5. El método de acuerdo con la reivindicación 1, en el que los progenitores primitivos inmaduros son del linaje CD34+/CD38-/low
.
6. El método de acuerdo con la reivindicación 1, en el que las células madre se recogieron después de haber inducido un proceso de movilización de células madre y/o mediante un proceso quirúrgico.
7. El método de acuerdo con la reivindicación 1, que comprende, además, aislar mediante FACS células madre que tienen niveles de CXCR4 por encima de un umbral predeterminado.
8. El método de acuerdo con la reivindicación 1, en el que las células madre son capaces de diferenciarse hacia los linajes mieloide y eritroide.
9. El método de acuerdo con la reivindicación 5, en el que la cantidad de progenitores primitivos inmaduros del linaje CD34+/CD38-/low es aproximadamente 1-5% de la población.
10. El método de acuerdo con la reivindicación 5, en el que los progenitores primitivos inmaduros del linaje CD34+/CD38-/low están en una cantidad igual o superior a aproximadamente 3% de la población.
11. Una población de células que comprende células madre hematopoyéticas enriquecidas con progenitores primitivos inmaduros, que exhiben una migración de células potenciada inducida por SDF-1 en respuesta a una concentración de SDF-1 que es igual a o menor que aproximadamente 50 ng/ml, o que es igual a o mayor que aproximadamente 1 μg/ml, preparada al introducir en las células madre un fragmento de ADN que comprende la secuencia de CXCR4, dando como resultado una sobre-expresión de CXCR4 en las células madre.
12. La población de células de acuerdo con la reivindicación 11, que es capaz de diferenciar hacia los linajes mieloide y eritroide.
13. La población de células de acuerdo con la reivindicación 11, en donde la cantidad de progenitores primitivos inmaduros son del linaje CD34+/CD38-/low.
14. La población de células de acuerdo con la reivindicación 13, en donde la cantidad de progenitores primitivos inmaduros del linaje CD34+/CD38-/low es aproximadamente 1-5% de la población.
15. La población de células de acuerdo con la reivindicación 13, en donde la cantidad de progenitores primitivos inmaduros del linaje CD34+/CD38-/low es aproximadamente o superior a 3% de la población.
16. Uso de una población de células que comprende células madre hematopoyéticas de acuerdo con una cualquiera de las reivindicaciones 11-15, en la fabricación de un medicamento para aumentar el traslado de las células madre hematopoyéticas a un tejido diana en un sujeto que lo necesita.
17. Uso de una población de células de acuerdo con una cualquiera de las reivindicaciones 11-15, en la fabricación de un medicamento para aumentar la repoblación de un tejido diana en un sujeto que lo necesita.
18. El uso de acuerdo con las reivindicaciones 16 ó 17, en donde dicho tejido diana se selecciona del grupo que consiste en médula ósea, vasos sanguíneos, corazón, pulmón, hígado, páncreas, riñón, sistema nervioso, piel, hueso y músculo esquelético.
19. Uso de una población de células de acuerdo con una cualquiera de las reivindicaciones 11-15, en la fabricación de un medicamento para facilitar el trasplante.
20. El uso de acuerdo con la reivindicación 19, en donde dicho trasplante sigue protocolos de quimioterapia.
21. El uso de acuerdo con la reivindicación 19, en donde dicho trasplante es autólogo.
22. El uso de acuerdo con la reivindicación 21, en donde el trasplante implica la movilización de células autólogas.
23. El uso de acuerdo con la reivindicación 19, en donde el trasplante es heterólogo.
24. El uso de acuerdo con la reivindicación 19, en donde el trasplante se lleva a cabo con células madre movilizadas.
25. Una población de células que comprende células madre hematopoyéticas de acuerdo con una cualquiera de las reivindicaciones 11-15, para uso en aumentar el traslado de las células madre hematopoyéticas a un tejido diana en un sujeto que lo necesita.
26. Una población de células de acuerdo con una cualquiera de las reivindicaciones 11-15, para uso en aumentar la repoblación de un tejido diana en un sujeto que lo necesita.
27. La población de células de acuerdo con una cualquiera de las reivindicaciones 11-15, para el uso de acuerdo con la reivindicación 25 ó 26, en donde dicho tejido diana se selecciona del grupo que consiste en médula ósea, vasos sanguíneos, corazón, pulmón, hígado, páncreas, riñón, sistema nervioso, piel, hueso y músculo esquelético.
28. Una población de células de acuerdo con una cualquiera de las reivindicaciones 11-15, para uso en facilitar el trasplante.
29. La población de células de acuerdo con una cualquiera de las reivindicaciones 11-15, para el uso de acuerdo con la reivindicación 28, en donde el trasplante sigue protocolos de quimioterapia.
30. La población de células de acuerdo con una cualquiera de las reivindicaciones 11-15, para el uso de acuerdo con la reivindicación 28, en donde dicho trasplante es autólogo.
31. La población de células de acuerdo con una cualquiera de las reivindicaciones 11-15, para el uso de acuerdo con la reivindicación 30, en donde el trasplante implica la movilización de células autólogas.
32. La población de células de acuerdo con una cualquiera de las reivindicaciones 11-15, para el uso de acuerdo con la reivindicación 28, en donde el trasplante es heterólogo.
33. La población de células de acuerdo con una cualquiera de las reivindicaciones 11-15, para el uso de acuerdo con la reivindicación 28, en donde el trasplante se lleva a cabo con células madre movilizadas.
34. Un método in vitro para preparar una población de células que comprenden células madre hematopoyéticas que exhiben CXCR4 con un epítopo 6H8 intacto, comprendiendo el método introducir en las células madre un fragmento de ADN que comprende la secuencia de CXCR4.
35. Una población de células que comprenden células madre hematopoyéticas que comprenden un epítopo 6H8 intacto de CXCR4, preparado al introducir un fragmento de ADN que comprende la secuencia de CXCR4 en las células madre, dando como resultado la sobre-expresión de CXCR4 en las células madre.
36. Uso de una población de células de acuerdo con una cualquiera de las reivindicaciones 11-15, en la fabricación de un medicamento para el trasplante.
37. Una población de células de acuerdo con una cualquiera de las reivindicaciones 11-15, para uso en el trasplante.
38. Una composición farmacéutica que comprende una población de células hematopoyéticas que comprenden células madre que exhiben un epítopo 6H8 intacto de CXCR4, preparado al introducir un fragmento de ADN que comprende la secuencia de CXCR4 en las células madre, dando como resultado la sobre-expresión de CXCR4 en las células madre.
FIGURA 1
Patentes similares o relacionadas:
Procedimiento para diagnosticar cáncer y kit de diagnóstico a través de la medición de actividad de células NK, del 6 de Mayo de 2020, de NKMAX Co., Ltd: Un procedimiento para medir la actividad de los linfocitos citolíticos naturales (NK), que comprende: estimular las células NK en una muestra de sangre entera incubando […]
Procedimiento para controlar la sialilación de proteínas producidas por un cultivo de células de mamíferos, del 22 de Enero de 2020, de F. HOFFMANN-LA ROCHE AG: Un proceso para controlar la cantidad de ácido siálico presente en una cadena lateral de oligosacárido de una glicoproteína producida en la fase de producción […]
DIANA TERAPÉUTICA EN RECEPTORES DE QUIMIOCINAS PARA LA SELECCIÓN DE COMPUESTOS ÚTILES PARA EL TRATAMIENTO DE PROCESOS PATOLÓGICOS QUE IMPLICAN LA SEÑALIZACIÓN DE QUIMIOCINAS, del 9 de Enero de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: La invención proporciona una diana molecular (SEQ ID NO: 1) dentro de receptores de quimiocinas, localizada específicamente dentro de la región transmembrana […]
Anakinra para uso en el tratamiento del síndrome de bronquiolitis obliterante, del 23 de Octubre de 2019, de Levitt, Roy C: Una cantidad efectiva de un agente que consiste en un inhibidor de IL-1 para usar en el tratamiento del síndrome de bronquiolitis obliterante, en el que el inhibidor de […]
Moduladores del sistema inmunitario, del 23 de Octubre de 2019, de CanImGuide Therapeutics AB: Péptido aislado que comprende la secuencia de aminoácidos FFVKLS (SEQ ID NO: 62) que comprende no más de 30 aminoácidos, en el que, si el péptido aislado se pone en contacto […]
Composición farmacéutica combinada, del 9 de Octubre de 2019, de Cytune Pharma: Composición farmacéutica combinada que comprende: a) un conjugado que comprende (i) un polipéptido que comprende la secuencia de aminoácidos […]
Procedimientos de predicción del riesgo de un resultado clínico adverso, del 7 de Agosto de 2019, de CRITICAL CARE DIAGNOSTICS, INC: Un procedimiento in vitro para evaluar el riesgo de un resultado clínico adverso (ACO) en un sujeto humano con insuficiencia cardíaca y una concentración circulante elevada […]
Un receptor quimérico soluble de interleucina 10 y su uso terapéutico, del 26 de Junio de 2019, de MEDIOLANUM FARMACEUTICI S.P.A.: Una proteína de fusión quimérica que comprende albúmina y el dominio extracelular de la unidad alfa del receptor de interleucina 10 (IL10).