Métodos de tratamiento que emplean infusión continua prolongada de Belinostat.
(E)-N-hidroxi-3-(3-fenilsulfamoil-fenil-)acrilamida, o una de sus sales,
hidratos o solvatos, para su uso en el tratamiento de una enfermedad o un trastorno en un paciente humano, por medio de infusión intravenosa continua y prolongada;
en donde la infusión intravenosa continua y prolongada es durante un periodo de al menos 12 horas;
en donde la enfermedad o el trastorno es:
una afección proliferativa; o
un tumor; o
un tumor sólido; o
cáncer; o
un cáncer de tumor sólido; o
cáncer de pulmón, cáncer de próstata, cáncer renal, hepatoma, cáncer de vejiga, cáncer colorrectal, cáncer pancreático, cáncer gástrico, cáncer de mama, cáncer de ovarios, sarcoma de tejido blando, osteosarcoma, carcinoma hepatocelular, cáncer de piel, leucemia o linfoma; o
leucemia; o
leucemia mielógena aguda (AML), leucemia mielógena crónica (CML), leucemia mielógena crónica en fase blástica (CML-BP) o síndrome mielodisplásico resistente a tratamiento (MDS).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2009/005044.
Solicitante: Onxeo DK, branch of Onxeo S.A., France.
Nacionalidad solicitante: Dinamarca.
Dirección: SYMBION SCIENCE PARK, FRUEBJERGVEJ 3 2100 COPENHAGEN DINAMARCA.
Inventor/es: JENSEN,PETER BUHL, SEHESTED, MAXWELL, NISSEN,NIS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/18 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Sulfamidas (compuestos que contienen un grupo para N-benceno-sulfonil-N A61K 31/63).
- A61K47/18 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Aminas; Amidas; Ureas; Compuestos de amonio cuaternario; Aminoácidos; Oligopéptidos que tienen hasta cinco aminoácidos.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
PDF original: ES-2536208_T3.pdf
Fragmento de la descripción:
Métodos de tratamiento que emplean infusión continua prolongada de Belinostat.
Campo técnico 5
La presente invención se refiere generalmente al tratamiento de enfermedades y trastornos que están mediados por histona desacetilasa (HDAC) , por ejemplo, cáncer, con Belinostat, y más particularmente, a tratamientos de mejora de dichas enfermedades (por ejemplo, cánceres, por ejemplo, leucemias) , que emplean infusión continua y prolongada (por ejemplo, infusión intravenosa continua y prolongada) de Belinostat. 10
Antecedentes
Se citan un número de pacientes y publicaciones en la presente memoria con el fin de describir más completamente y divulgar la invención y el estado de la técnica a la cual pertenece la invención. 15
Durante toda la memoria descriptiva, incluyendo las reivindicaciones siguientes, a menos que el contexto requiera lo contrario, se entiende que la palabra "comprenden" y variaciones tales como "comprende" y "comprender" implican la inclusión de un número entero afirmado o etapa o grupo de números enteros o etapas, pero sin exclusión de cualquier otro número entero o etapa o grupos de números enteros o etapas. 20
Debe apreciarse que, según se usa en la memoria descriptiva y en las reivindicaciones adjuntas, las formas en singular "un", "una", "el" y "ella" incluyen referentes en plural a menos que el contexto claramente indique lo contrario. De este modo, por ejemplo, la referencia a "un vehículo farmacéutico" incluye mezclas de dos o más dichos vehículos, y similares. 25
Con frecuencia, los intervalos se expresan en la presente memoria desde "aproximadamente" un valor particular y/o hasta "aproximadamente" otro valor particular. Cuando se expresa dicho intervalo, otra realización incluye desde el valor particular y/o hasta el otro valor particular. Similarmente, cuando se expresan los valores como aproximaciones, por medio del uso del antecedente "aproximadamente", se entiende que el valor particular forma 30 otra realización.
La presente divulgación incluye información que puede resultar útil en la comprensión de la presente invención. No constituye una admisión que parte de la información proporcionada en la presente memoria sea técnica anterior o relevante para la invención reivindicada actualmente, o que alguna publicación referenciada de forma específica o 35 explícita constituya la técnica anterior.
PXD101 / Belinostat
(E) -N-hidroxi-3- (3-fenilsulfamoil-fenil) -acrilamida, también conocida como PXD101, PX 105684, y Belinostat, 40 mostrada a continuación, es un inhibidor de histona desacetilasa conocido (HDAC) . Se describió por primera vez por parte de Watkins et al., 2002. Se encuentra en desarrollo para el tratamiento de una gama de trastornos con mediación de HDAC, y es el objeto de numerosos ensayos clínicos de Fase I y Fase II para diversos tipos de cáncer.
45 EP2 262 493B12510152025303540455055DescriptionTECHNICAL FIELD[0001]The present invention relates generally to the treatment of diseases and disorders that are mediated by histonedeacetylase (HDAC) , for example, cancer, with Belinostat, and more particularly, to improvement treatments of suchdiseases (for example, cancers, for example, leukemias) , which employ prolonged continuous infusion (e.g., prolongedcontinuous intravenous infusion) of Belinostat.BACKGROUND[0002]A number of patents and publications are cited herein in order to more fully describe and disclose the inventionand the state of the art to which the invention pertains.[0003]Throughout this specification, including the claims which follow, unless the context requires otherwise, the word"comprise, " and variations such as "comprises" and "comprising, " will be understood to imply the inclusion of a statedinteger or step or group of integers or steps but not the exclusion of any other integer or step or group of integers or steps.[0004]It must be noted that, as used in the specification and the appended claims, the singular forms "a, " "an, " and"the" include plural referents unless the context clearly dictates otherwise. Thus, for example, reference to "a pharma-ceutical carrier" includes mixtures of two or more such carriers, and the like.[0005]Ranges are often expressed herein as from "about" one particular value, and/or to "about" another particularvalue. When such a range is expressed, another embodiment includes from the one particular value and/or to the otherparticular value. Similarly, when values are expressed as approximations, by the use of the antecedent "about, " it willbe understood that the particular value forms another embodiment.[0006]This disclosure includes information that may be useful in understanding the present invention. It is not anadmission that any of the information provided herein is prior art or relevant to the presently claimed invention, or thatany publication specifically or implicitly referenced is prior art.PXD101 / Belinostat[0007] (E) -N-hydroxy-3- (3-phenylsulfamoyl-phenyl) -acr y lamide, also known as PXD101, PX 105684, and Belinostat, shown below, is a well known histone deacetylate (HDAC) inhibitor. It was first described in Watkins et al., 2002. It isbeing developed for treatment of a range of disorders mediated by HDAC, and is the subject of a number of Phase Iand Phase II trials for various cancers.[0008]Liquid formulations of Belinostat, further comprising L-arginine, wherein the Belinostat is freely soluble, andwhich are suitable for administration by injection, infusion, intravenous infusion, etc., are described in Bastin et al., 2006.[0009]Phase I dose finding studies have been performed in patients with various solid-tumours where 150 to 1200mg/m2 were given in an intravenous bolus over 30 minutes, giving a maximum tolerated dose of 1000 mg/m2. See, e.g., Steele et al., 2008.[0010]A 30 minute intravenous bolus of Belinostat (600-1200mg/m2/d) was also given to patients in combination withstandard dose carboplatin or paclitaxel, where the maximum tolerated dose of Belinostat was 1000 mg/m2/d. See, e.g., Sinha et al., 2007.[0011]Belinostat was also given to patients in a 30 minute intraveous bolus of 600-900 mg/m2/d. See, e.g., Gimsinget al., 2005.[0012]Patients with multiple myeloma have been given 900-100 mg/m2/d Belinostat by 30 minute infusion. See, e.g., Sullivan et al., 2006.[0013]Belinostat has been given at doses of 900 and 1000 mg/m2/d to patients with T-cell lymphoma. See, e.g., Advani et al., 2007.[0014]Patients with drug-resistant ovarian tumours were given Belinostat at 1000 mg/m2/d in a 30 minutes intravenousbolus. See, e.g., Mackay et al., 2007.[0015]Thus, in Phase I and II clinical trials, it has been reported that the recommended doses of Belinostat are givenin as a bolus by 30 minute infusion on consecutive days. However, the reported plasma half-life of Belinostat is reported
Las formulaciones líquidas de Belinostat, que además comprenden L-arginina, en las cuales Belinostat es soluble de forma libre, y que resultan apropiadas para la administración por medio de inyección, infusión, infusión intravenosa, etc., se describen en Bastin et al., 2006.
Se han llevado a cabo estudios de comprobación de dosis de Fase I en pacientes con diversos tumores sólidos en los cuales se proporcionó de 150 a 1200 mg/m2 en una inyección intravenosa durante 30 minutos, proporcionando una dosis máxima tolerada de 1000 mg/m2. Véase, por ejemplo, Steele et al., 2008.
También se proporcionó una inyección intravenosa de Belinostat durante 30 minutos (600-1200 mg/m2/d) a 55 pacientes en combinación con una dosis convencional de carboplatino o paclitaxel, donde la dosis máxima tolerada de Belinostat fue de 1000 mg/m2/d. Véase, por ejemplo, Sinha et al., 2007.
También se proporcionó Belinostat a pacientes en una inyección intravenosa de 600-900 mg/m2/d durante 30 minutos. Véase, por ejemplo, Gimsing et al., 2005.
Se proporcionaron 900-100 mg/m2/d de Belinostat por medio de infusión durante 30 minutos a pacientes con mieloma múltiple. Véase, por ejemplo, Sullivan et al., 2006. 5
Se proporcionó Belinostat en dosis de 900 a 1000 mg/m2/d a pacientes con linfoma de células-T. Véase por ejemplo, Advani et al., 2007.
Se proporcionó Belinostat a 1000 mg/m2/d en una inyección intravenosa durante 30 minutos a pacientes con 10 tumores ováricos resistentes a fármacos.
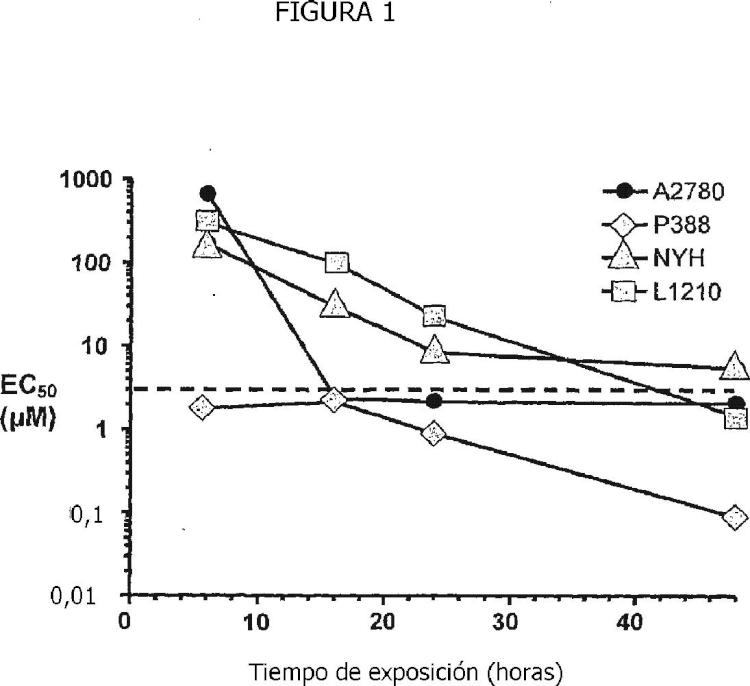
De este modo, se ha presentado, en ensayos clínicos de Fase I y Fase II, que las dosis recomendadas de Belinostat se proporcionan en una inyección intravenosa por medio de infusión durante 30 minutos en días consecutivos. No obstante, se presenta que la semivida en plasma de Belinostat es de 47-86 minutos, y de ese modo el fármaco 15 puede que no se encuentre en concentraciones suficientemente elevadas para resultar eficaz durante gran... [Seguir leyendo]
Reivindicaciones:
1. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso en el tratamiento de una enfermedad o un trastorno en un paciente humano, por medio de infusión intravenosa continua y prolongada; 5
en donde la infusión intravenosa continua y prolongada es durante un periodo de al menos 12 horas;
en donde la enfermedad o el trastorno es:
una afección proliferativa; o un tumor; o 10
un tumor sólido; o cáncer; o un cáncer de tumor sólido; o cáncer de pulmón, cáncer de próstata, cáncer renal, hepatoma, cáncer de vejiga, cáncer colorrectal, cáncer pancreático, cáncer gástrico, cáncer de mama, cáncer de ovarios, sarcoma de tejido blando, osteosarcoma, 15 carcinoma hepatocelular, cáncer de piel, leucemia o linfoma; o leucemia; o leucemia mielógena aguda (AML) , leucemia mielógena crónica (CML) , leucemia mielógena crónica en fase blástica (CML-BP) o síndrome mielodisplásico resistente a tratamiento (MDS) .
2. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo con la reivindicación 1, en donde la infusión intravenosa continua y prolongada es durante un periodo de al menos 24 horas.
3. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo 25 con la reivindicación 1, en donde la infusión intravenosa continua y prolongada es durante un periodo de al menos 36 horas.
4. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo con la reivindicación 1, en donde la infusión intravenosa continua y prolongada es durante un periodo de al menos 30 48 horas.
5. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en donde la infusión intravenosa continua y prolongada se lleva a cabo durante dos o más ciclos, con periodos de descanso intermedios. 35
6. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo con la reivindicación 5, en donde el periodo de descanso o cada periodo de descanso es de al menos 24 horas.
7. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo 40 con la reivindicación 5, en donde el periodo de descanso o cada periodo de descanso es de al menos 6 días.
8. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo con una cualquiera de las reivindicaciones 1 a 7, en donde la dosificación durante la infusión intravenosa continua y prolongada o durante cada infusión intravenosa continua y prolongada es de 100 a 2500 mg/m2/d de (E) -N-hidroxi-3-45 (3-fenilsulfamoil-fenil-) acrilamida.
9. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo con una cualquiera de las reivindicaciones 1 a 7, en donde la dosificación durante la infusión intravenosa continua y prolongada o durante cada infusión intravenosa continua y prolongada es de 500 a 1500 mg/m2/d de (E) -N-hidroxi-3-50 (3-fenilsulfamoil-fenil-) acrilamida.
10. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo con una cualquiera de las reivindicaciones 1 a 9, en donde la (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil) -acrilamida se proporciona en una formulación apropiada para administración por medio de infusión intravenosa continua y 55 prolongada y que además comprende L-arginina.
11. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo con una cualquiera de las reivindicaciones 1 a 10, en donde la enfermedad o el trastorno es una afección proliferativa. 60
12. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo con una cualquiera de las reivindicaciones 1 a 10, en donde la enfermedad o el trastorno es cáncer.
13. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo 65 con una cualquiera de las reivindicaciones 1 a 10, en donde la enfermedad o el trastorno es leucemia.
14. (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, para su uso de acuerdo con una cualquiera de las reivindicaciones 1 a 10, en donde la enfermedad o el trastorno es leucemia mielógena aguda (AML) , leucemia mielógena crónica (CML) , leucemia mielógena crónica en fase blástica (CML-BP) o síndrome mielodisplásico resistente al tratamiento (MDS) . 5
15. Uso de (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil-) acrilamida, o una de sus sales, hidratos o solvatos, en la fabricación de un medicamento para el tratamiento de una enfermedad o de un trastorno en un paciente humano, por medio de infusión intravenosa continua y prolongada;
en donde la infusión intravenosa continua y prolongada es durante un periodo de al menos 12 horas; 10
en donde la enfermedad o el trastorno es:
una afección proliferativa; o un tumor; o un tumor sólido; o 15
cáncer; o un cáncer de tumor sólido; o cáncer de pulmón, cáncer de próstata, cáncer renal, hepatoma, cáncer de vejiga, cáncer colorrectal, cáncer pancreático, cáncer gástrico, cáncer de mama, cáncer de ovarios, sarcoma de tejido blando, osteosarcoma, carcinoma hepatocelular, cáncer de piel, leucemia o linfoma; o 20
leucemia; o leucemia mielógena aguda (AML) , leucemia mielógena crónica (CML) , leucemia mielógena crónica en fase blástica (CML-BP) o síndrome mielodisplásico resistente a tratamiento (MDS) .
16. Uso de acuerdo con la reivindicación 15, en el que la infusión intravenosa continua y prolongada es durante un 25 periodo de al menos 24 horas.
17. Uso de acuerdo con la reivindicación 15, en el que la infusión intravenosa continua y prolongada es durante un periodo de al menos 36 horas.
18. Uso de acuerdo con la reivindicación 15, en el que la infusión intravenosa continua y prolongada es durante un periodo de al menos 48 horas.
19. Uso de una cualquiera de las reivindicaciones 15 a 18, en el que la infusión intravenosa continua y prolongada se lleva a cabo durante dos o más ciclos, con periodos de descanso intermedios. 35
20. Uso de acuerdo con la reivindicación 19, en el que el periodo de descanso o cada periodo de descanso es de al menos 24 horas.
21. Uso de acuerdo con la reivindicación 19, en el que el periodo de descanso o cada periodo de descanso es de al 40 menos 6 días.
22. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 21, en el que la dosificación durante la infusión intravenosa continua y prolongada o durante cada infusión intravenosa continua y prolongada es de 100 a 2500 mg/m2/d de (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil) -acrilamida. 45
23. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 21, en el que la dosificación durante la infusión intravenosa continua y prolongada o durante cada infusión intravenosa continua y prolongada es de 500 a 1500 mg/m2/d de (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil) -acrilamida.
24. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 23, en el que se proporciona (E) -N-hidroxi-3- (3-fenilsulfamoil-fenil) -acrilamida en una formulación apropiada para administración por medio de infusión intravenosa continua y prolongada y que además comprende L-arginina.
25. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 24, en donde la enfermedad o el trastorno es 55 una afección proliferativa.
26. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 24, en donde la enfermedad o el trastorno es cáncer.
27. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 24, en donde la enfermedad o el trastorno es leucemia.
28. Uso de acuerdo con una de las reivindicaciones 15 a 24, en donde la enfermedad o el trastorno es leucemia mielógena aguda (AML) , leucemia mielógena crónica (CML) , leucemia mielógena crónica en fase blástica (CML-BP) 65 o síndrome mielodisplásico resistente a tratamiento (MDS) .
Patentes similares o relacionadas:
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Aril éteres y usos de los mismos, del 22 de Julio de 2020, de Peloton Therapeutics, Inc: Un compuesto de formula Vd: **(Ver fórmula)** ç o una sal farmaceuticamente aceptable del mismo, en donde: R1 es arilo o heteroarilo; […]