Nuevas formas polimorfas de rifaximina, procedimientos para su producción y uso de las mismas en preparados medicinales.
Polimorfo del antibiótico denominado rifaximina δ, caracterizado por un contenido en agua en el intervalo de 2,
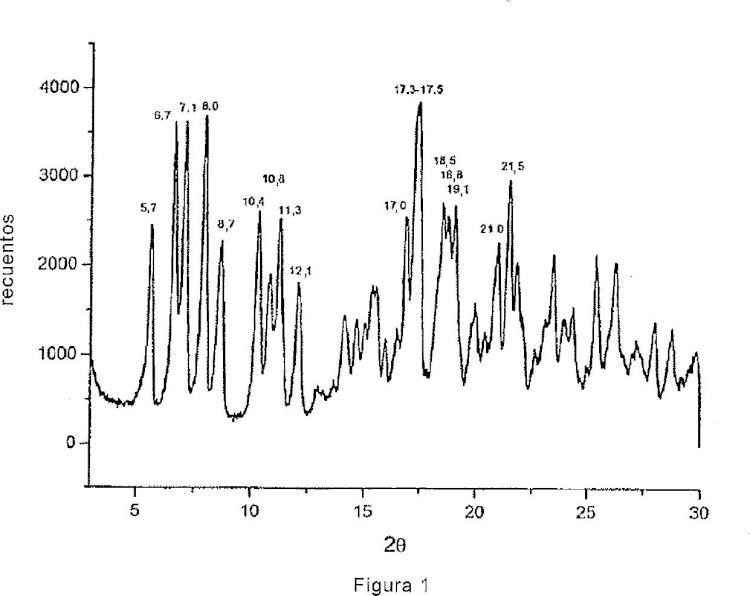
5% (p/p) a 6% (p/p), preferiblemente comprendido entre 3,0% y 4,5%, y por un difractograma de rayos X en polvo que muestra picos en los valores de los ángulos de difracción 2θ de 5,7º +- 0,2, 6,7º +- 0,2, 7,1º +- 0,2, 8,0º +- 0,2, 8,7º +- 0,2, 10,4º +- 0,2, 10,8º +- 0,2, 11,3º +- 0,2, 12,1º +- 0,2, 17,0º +- 0,2, 17,3º +- 0,2, 17,5º +- 0,2, 18,5º +- 0,2, 18,8º +- 0,2, 19,1º +- 0,2, 21,0º +- 0,2, 21,5º +- 0,2.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05004695.
Solicitante: ALFA WASSERMANN S.P.A..
Nacionalidad solicitante: Italia.
Dirección: CONTRADA SANT'EMIDIO S.N.C. 65020 ALANNO SCALO (PESCARA) ITALIA.
Inventor/es: VISCOMI, GIUSEPPE CLAUDIO, CAMPANA,MANUELA, BRAGA,DARIO, CONFORTINI,DONATELLA, BARBANTI,MARIA MIRIAM.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen el nitrógeno como heteroátomo de un ciclo, p. ej. guanetidina o rifamicina.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- C07D498/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 498/00 Compuestos heterocíclicos que contienen en el sistema condensado al menos un heterociclo que tienen átomos de nitrógeno y oxígeno como únicos heteroátomos del ciclo (4-oxa-1-azabiciclo [3.2.0] heptanos, p. ej. oxapenicilinas C07D 503/00; 5-oxa-1-azabiciclo [4.2.0] octanos, p. ej. oxacefalosporinas C07D 505/00; aquéllos de sus análogos que tienen el átomo de oxígeno del ciclo en otra posición C07D 507/00). › en los que el sistema condensado contiene cuatro o más heterociclos.
PDF original: ES-2522895_T3.pdf
Fragmento de la descripción:
Nuevas formas polimorías de rifaximina, procedimientos para su producción y uso de las mismas en preparados medicinales Antecedentes de la invención La rifaximina (INN; véase The Merck Index, XIII Ed, 8304) es un antibiótico que pertenece a la clase de rifamicina, exactamente en la patente italiana IT 1154655 se describe y reivindica una pirido-imidazo rifamicina, mientras que la patente europea EP 0161534 describe y reivindica un procedimiento para su producción partiendo de la rifamicina O (The Merck Index, XIII Ed., 8301) .
Ambas patentes describen la purificación de la rifaximina de una forma genérica, diciendo que la cristalización puede llevarse a cabo en disolventes o sistemas de disolventes adecuados y en síntesis muestra en algunos ejemplos que el producto procedente de la reacción se puede cristalizar en la mezcla 7:3 de alcohol etílico/agua y se puede secar tanto a presión atmosférica como bajo vacío, sin decir en modo alguno ni las condiciones experimentales de cristalización y secado, ni cualquier característica cristalográfica distintiva del producto obtenido.
La presencia de diferentes polimorfos no había sido simplemente percibida y, por lo tanto, las condiciones experimentales descritas en ambas patentes habían sido desarrollados con el objetivo de obtener un producto homogéneo que tuviera una pureza adecuada desde el punto de vista químico, aparte de los aspectos cristalográficos del propio producto. Ahora se ha encontrado, inesperadamente, que existen algunas formas polimorías cuya formación, además del disolvente, depende de las condiciones de tiempo y temperatura a las que se llevan a cabo tanto la cristalización como el secado.
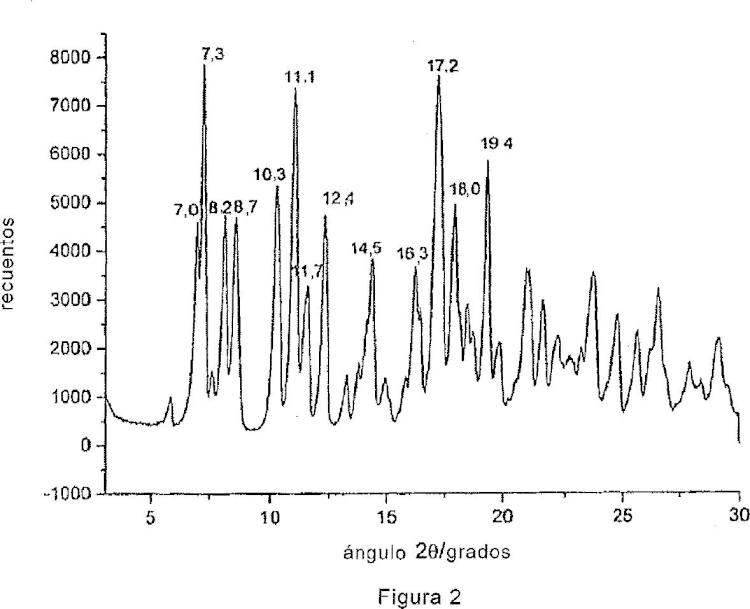
Estas formas ordenadamente polimorías serán, más tarde, convencionalmente identificadas como rifaximina ï? (figura 1) y rifaximina ï?¥ (figura 2) sobre la base de sus respectivos difractogramas específicos reseñados en la presente solicitud. Las formas polimorías de la rifaximina han sido caracterizadas a través de la técnica de la difracción de rayos X en polvo. La identificación y caracterización de estas formas polimorías y, contemporáneamente, la definición de las condiciones experimentales para obtenerlas es muy importante para un compuesto dotado de actividad farmacológica que, al igual que la rifaximina, se comercializa como preparado medicinal, tanto para uso humano como veterinario. De hecho se sabe que el polimorfismo de un compuesto que se puede utilizar como principio activo contenido en un preparado medicinal puede influir sobre las propiedades fármaco-toxicológicas del fármaco. Diferentes formas polimorías de un principio activo, administradas como fármaco en forma oral o tópica, pueden modificar muchas propiedades de los mismos tales como la biodisponibilidad, solubilidad, estabilidad, color, compresibilidad, fluidez y aptitud de trabajo con la consiguiente modificación de los perfiles de seguridad toxicológica, eficacia clínica y eficacia productiva. Lo anteriormente mencionado se confirma con autoridad por el hecho de que las autoridades que regulan la concesión de la autorización para la admisión de fármacos en el mercado requieren que los métodos de fabricación de los principios activos estén estandarizados y controlados de tal manera que den resultados homogéneos y sonoros en términos de polimorfismo de los lotes de producción (CPMP/QWP/96, 2003 -Note for Guidance on Chemistr y of new Active Substance; CPMP/ICH/367/96 -Note for guidance specifications: test procedures and acceptance criteria for new drug substances and new drug products: chemical substances; Fecha de entrada en funcionamiento: mayo de 2000) .
La necesidad de la estandarización arriba mencionada ha sido reforzada sólo en el campo de los antibióticos de rifamicina de Henwood S.Q., de Villiers M.M., Liebenberg W. y Lötter A.P., Drug Development and Industrial Pharmacy, 26 (4) , 403-408, (2000) , quienes han determinado que diferentes lotes de producción de la rifampicina (INN) hechos de diferentes fabricantes difieren entre ellos debido a que muestran diferentes características polimorías y, como consecuencia, muestran perfiles diferentes de disolución junto con la consiguiente alteración de las respectivas propiedades farmacológicas.
Mediante la aplicación de los procesos de cristalización y secado genéricamente descritos en las patentes previas IT 1154655 y EP 0161534, se ha encontrado que bajo algunas condiciones experimentales se obtiene la forma poco cristalina de la rifaximina. mientras que bajo otras condiciones experimentales se obtienen las otras formas
polimorías cristalinas de la rifaximina. Además se ha encontrado que algunos parámetros, absolutamente no descritos en las patentes anteriormente mencionadas tales como, por ejemplo, las condiciones de conservación y la humedad relativa del ambiente, tienen el efecto sorprendente de determinar la forma del polimorfo.
Las formas polimorías de rifaximina, objeto de la presente solicitud de patente, nunca fueron vistas ni se sacaron hipótesis, pensando que siempre se obtendría un único producto homogéneo, independientemente del método que se hubiera elegido dentro de la gama de las condiciones descritas, independientemente de las condiciones utilizadas para la cristalización, el secado y la conservación.
Se ha encontrado ahora que la formación de la formas ï? y ï?¥ depende de la presencia de agua en el disolvente de cristalización, de la temperatura a la cual cristaliza el producto y de la cantidad de agua presente en el producto al final de la fase de secado.
Entonces se han sintetizado la forma ï? y la forma ï?¥ de la rifaximina y son el objeto de la invención.
En particular, la forma ï? se caracteriza por el contenido residual de agua en el material sólido secado en el intervalo de 2, 5% y 6% (p/p) , más preferiblemente de 3% y 4, 5%, mientras que la forma ï?¥ es el resultado de una transición polimórfica bajo temperatura controlada que se desplaza de la forma ï?.
Estos resultados tienen una importancia notable, ya que determinan las condiciones de la fabricación industrial de algunas etapas de trabajo que no podían ser consideradas críticas para la determinación del polimorfismo de un producto tales como, por ejemplo, el mantenimiento en un producto cristalizado de una cantidad de agua en un intervalo riguroso de valores, o el proceso de secado del producto final, en el que una forma, a saber, la forma ï?, tiene que obtenerse antes de continuar el secado para obtener la forma ï?¥, o las condiciones de conservación del producto final, o las características del recipiente en el que se conserva el producto.
La rifaximina ejerce su amplia actividad antibacteriana en el tracto gastrointestinal contra bacterias gastrointestinales localizadas que causan diarrea infecciosa, incluidas cepas anaerobias. Se ha reseñado que la rifaximina se caracteriza por una absorción sistémica despreciable, debido a sus características químicas y físicas (Descombe J.J. et al. Pharmacokinetic study of rifaximin after oral administration in healthy volunteers. Int J Clin. Pharmacol. Res., 14 (2) , 51-56, (1994) ) . Los autores de la invención han encontrado ahora que es posible, sobre la base de las dos formas polimórficas identificadas de rifaximina, modular su nivel de adsorción sistémica, y esto es parte de la presente invención, mediante la administración de distintas formas polimorías de rifaximina, a saber, la rifaximina ï? y la rifaximina ï?¥. Es posible tener una diferencia en la adsorción de casi 100 veces en el intervalo de 0, 001 a 0, 3 ï?g/ml en la sangre.
La diferencia evidenciada en la biodisponibilidad es importante, ya que puede diferenciar el comportamiento farmacológico y toxicológico de los dos polimorfos de rifaximinas ï? y ï?¥.
De hecho, la rifaximina ï?¥ es absorbida de manera despreciable a través de la vía oral, mientras que la rifaximina ï? muestra una absorción suave.
La rifaximina ï?¥ prácticamente no se absorbe, puede actuar sólo a través de una acción tópica, incluido el caso del tracto gastrointestinal, con la ventaja de una toxicidad muy baja.
Por otro lado, la rifaximina ï?, que se absorbe suavemente, puede encontrar un uso ventajoso frente a microorganismos sistémicos, capaces de esconderse y eludir en parte la acción de los antibióticos de administración tópica.
Con respecto a los posibles eventos adversos acoplados al uso terapéutico de rifaximina, es de particular relevancia la inducción de la resistencia bacteriana a los antibióticos. En términos generales, siempre es posible en la práctica terapéutica con antibióticos para inducir una resistencia bacteriana a la misma o a otro antibiótico través de la selección... [Seguir leyendo]
Reivindicaciones:
1. Polimorfo del antibiótico denominado rifaximina ï?, caracterizado por un contenido en agua en el intervalo de 2, 5% (p/p) a 6% (p/p) , preferiblemente comprendido entre 3, 0% y 4, 5%, y por un difractograma de rayos X en polvo que muestra picos en los valores de los ángulos de difracción 2ï?± de 5, 7º ï± 0, 2, 6, 7º ï± 0, 2, 7, 1º ï± 0, 2, 8, 0º ï± 0, 2, 8, 7º ï± 0, 2, 10, 4º ï± 0, 2, 10, 8º ï± 0, 2, 11, 3º ï± 0, 2, 12, 1º ï± 0, 2, 17, 0º ï± 0, 2, 17, 3º ï± 0, 2, 17, 5º ï± 0, 2, 18, 5º ï± 0, 2, 18, 8º ï± 0, 2, 19, 1º ï± 0, 2, 21, 0º ï± 0, 2, 21, 5º ï± 0, 2.
2. Polimorfo del antibiótico denominado rifaximina ï?¥, caracterizado por un difractograma de rayos X en polvo que muestra picos en los valores de la ángulos de difracción 2ï?± de 7, 0º ï± 0, 2, 7, 3º ï± 0, 2, 8, 2º ï± 0, 2, 8, 7º ï± 0, 2, 10, 3º ï± 0, 2, 11, 1º ï± 0, 2, 11, 7º ï± 0, 2, 12, 4º ï± 0, 2, 14, 5º ï± 0, 2, 16, 3º ï± 0, 2, 17, 2º ï± 0, 2, 18, 0º ï± 0, 2, 19, 4º ï± 0, 2.
3. Procedimiento para la producción de la rifaximina ï?, caracterizado por que un equivalente molar de rifamicina O se hace reaccionar con un exceso de 2-amino-4-metilpiridina, preferiblemente de 2, 0 a 3, 5 equivalentes molares, en una mezcla de disolventes constituida por agua y alcohol etílico en relaciones volumétricas entre 1:1 y 2:1, durante un período de tiempo entre 2 y 8 horas a una temperatura entre 40º C y 60º C, la masa de reacción se trata a temperatura ambiente con una disolución de ácido ascórbico en una mezcla de agua, alcohol etílico y ácido clorhídrico acuoso concentrado, la masa de reacción se lleva a pH 2, 0 por medio de una disolución acuosa concentrada de ácido clorhídrico, la suspensión se filtra, el sólido obtenido se lava con la misma mezcla de disolvente agua/alcohol etílico utilizada en la reacción, la rifaximina bruta, así obtenida, se purifica disolviéndola en alcohol etílico a una temperatura entre 45º C y 65º C, provocando la precipitación mediante adición de agua, preferiblemente en cantidades en peso entre 15% y 70% respecto a la cantidad en peso del alcohol etílico utilizado para la disolución, la temperatura se hace descender a un valor entre 28º C y 32º C con el fin de provocar el comienzo de la cristalización, la suspensión, así obtenida, se mantiene entre 40º C y 50º C bajo agitación durante un período de tiempo entre 6 y 24 horas, luego se enfría en un periodo de tiempo entre 15 minutos y una hora a 0º C antes de filtrar, y el secado del sólido obtenido se lleva a cabo hasta que el contenido en agua esté en el intervalo de 2, 5% (p/p) a 6%, preferiblemente comprendido entre 3, 0% y 4, 5%, con lo que se seca en vacío o bajo condiciones de presión normal, con o sin un agente de secado, a una temperatura entre la temperatura ambiente y 105º C durante un período de tiempo entre 2 y 72 horas.
4. Procedimiento para la producción de rifaximina ï?¥, caracterizado por secar rifaximina ï? obtenida de acuerdo con la reivindicación 3 en vacío o a presión atmosférica, a temperatura ambiente o a temperaturas elevadas, en presencia o en ausencia de agentes de secado, con la condición de que el secado se prolongue durante el tiempo necesario de modo que se alcance la conversión en la forma ï?¥.
5. Uso de la rifaximina ï? en la producción de preparados medicinales para uso oral con actividad antibiótica junto con los excipientes habituales tales como agentes diluyentes, agentes aglutinantes, agentes lubricantes, agentes disgregantes, colorantes, aromatizantes y agentes edulcorantes.
6. Uso de la rifaximina ï?¥ en la producción de preparados medicinales para uso oral con actividad antibiótica junto con los excipientes habituales tales como agentes diluyentes, agentes aglutinantes, agentes lubricantes, agentes disgregantes, colorantes, aromatizantes y agentes edulcorantes.
7. Uso de acuerdo con cada una de las reivindicaciones 5 y 6, caracterizado por que los preparados se seleccionan de comprimidos revestidos y no revestidos, cápsulas de gelatina dura y blanda, píldoras recubiertas de azúcar, pastillas, hojas de oblea, gránulos y polvos en envases sellados.
8. Uso de la rifaximina ï? en la producción de preparados medicinales con actividad antibiótica para uso tópico.
9. Uso de la rifaximina ï?¥ en la producción de preparados medicinales con actividad antibiótica para uso tópico.
10. Uso de acuerdo con cada una de las reivindicaciones 8 y 9, caracterizado por que los preparados para uso tópico se seleccionan de los ungüentos, las pomadas, las cremas, los geles y las lociones.
Patentes similares o relacionadas:
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Tratamiento o prevención de infecciones asociadas a biopelículas con agua con cloro libre disponible, del 15 de Julio de 2020, de Sonoma Pharmaceuticals, Inc: Agua con cloro libre disponible (FAC) para su uso en el tratamiento o reducción de la incidencia de una infección en un mamífero provocada por una biopelícula que contiene […]
Formulaciones de azalida acuosas concentradas, del 8 de Julio de 2020, de Sun Pharma Global FZE: Una composición farmacéutica tópica para su uso en el tratamiento de una infección ocular que comprende administrar a un paciente en necesidad del mismo, una cantidad […]
Composición tópica que comprende extractos de boldo y de reina de los prados, destinada a un animal, y sus aplicaciones, del 6 de Julio de 2020, de Virbac SA: Composición tópica para animales, caracterizada por que comprende en un medio fisiológicamente aceptable extractos de boldo Peumus boldus y extractos de reina […]
DERIVADOS DE OLIGOSACÁRIDOS SINTÉTICOS COMO VACUNA CONTRA BORDETELLA PERTUSSIS, del 2 de Julio de 2020, de INSTITUTO FINLAY DE VACUNAS: La presente invención proporciona fragmentos de oligosacáridos sintéticos provenientes del pentasacárido terminal del lipooligosacárido de Bordetella pertussis, un método […]
Inhibidores de lisina gingipaína, del 1 de Julio de 2020, de Cortexyme, Inc: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde Z es ariloximetil-carbonilo sustituido con halógeno; […]
Vacuna de ADN contra pseudotuberculosis en peces marinos, del 1 de Julio de 2020, de NATIONAL UNIVERSITY CORPORATION TOKYO UNIVERSITY OF MARINE SCIENCE AND TECHNOLOGY: Una vacuna de ADN para peces, caracterizada por: - impartir inmunidad contra la pseudotuberculosis causada por Photobacterium damselae subsp. piscicida - que comprende, […]
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]