Indicador biológico desarrollado mediante ingeniería genética.
indicador de esterilización, que comprende
un portador, el portador que tiene una primera superficie y una segunda superficie;
un soporte, el soporte que tiene una primera sección y una segunda sección, el portador que recubre la primera sección del soporte, la segunda superficie del portador que se adhiere a la primera sección del soporte; y
un indicador biológico desarrollado mediante ingeniería genética, que comprende:
al menos un organismo de prueba y al menos un gen reportero apropiado para producir una enzima indicadora, el gen reportero que comprende lacZ, bgaB, xylE, cat, gfp, o
una mezcla de dos o más de estos, el gen reportero que es captado por el organismo de prueba; y
al menos un gen represor que inhibe la expresión del gen reportero hasta que el gen reportero se expone al menos a un inductor, el gen represor que comprende xylR, lacl, tetR o una mezcla de dos de estos
que se soporta por el portador, la segunda sección del soporte que es de dimensión suficiente para permitir manipular el indicador de esterilización sin poner en contacto el indicador biológico.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/078828.
Solicitante: AMERICAN STERILIZER COMPANY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 5960 HEISLEY ROAD MENTOR, OH 44060-1834 ESTADOS UNIDOS DE AMERICA.
Inventor/es: CREGGER,TRICIA A, FRANCISKOVICH,PHILLIP P, YIRAVA,WILLIAM A.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N1/21 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
- C12Q1/70 C12Q 1/00 […] › en los que intervienen virus o bacteriófagos.
PDF original: ES-2501465_T3.pdf


Fragmento de la descripción:
Indicador biológico desarrollado mediante ingeniería genética.
Campo técnico 5
La tecnología descrita se refiere a indicadores biológicos desarrollados mediante ingeniería genética. Estos indicadores biológicos pueden ser útiles para determinar la eficacia de uno o más procesos de esterilización.
Antecedentes 10
Fundamentalmente en la industria del cuidado de la salud, pero además en muchas otras aplicaciones comerciales e industriales, frecuentemente es necesario controlar la eficacia de los procesos usados para esterilizar equipos tales como dispositivos médicos y no médicos, instrumentos y otros artículos y materiales. En estos procesos de esterilización frecuentemente la práctica estandar es incluir un indicador de esterilización en el grupo de artículos a 15 esterlizar. Esto permite un enfoque directo para ensayar la letalidad de los procesos de esterilización.
Hansen y otros se refirieron a un biosensor de tetraciclina que comprende células de E.coli que almacenan los genes gfp bajo el control del promotor Ptet regulado por tetR. Este sensor se usa para detectar oxitetraciclina en suelo estéril (Applied and Environmental Microbiology, En. 2001, 239-244) . 20
Los métodos clásicos de seguridad de la esterilidad típicamente involucran exponer un indicador de esterilización que contiene unos o más organismos de prueba al proceso de esterilización y después medir el brote de cualquiera de los organismos de prueba sobrevivientes. La esterilidad puede asegurarse si no hay brote de los organismos de prueba seguido de la exposición al proceso de esterilización. Las esporas bacterianas (por ejemplo, Geobacillus 25 stearothermophilus, Bacillus subtilis, Bacillus atrophaeus, y similares) se usan típicamente como los organismos de prueba. Tras la terminación del proceso de esterilización, el indicador de esterilización se expone a un medio soporte de crecimiento líquido bajo condiciones que promoverían el crecimiento de cualquiera de las células de los organismos de prueba sobrevivientes. El medio soporte de crecimiento frecuentemente contiene un colorante químico que cambia de color en respuesta a las células en crecimiento activamente (que metabolizan) . Debido a los requerimientos para el 30 crecimiento y el metabolismo, los procesos que emplean estos organismos de prueba típicamente requieren aproximadamente 24 a 72 horas de incubación antes de que pueda determinarse la eficacia del proceso de esterilización. Un problema con este proceso se relaciona el hecho de que muchos usuarios de los artículos esterilizados, tales como los cuidadores de la salud y similares, tienen recursos limitados y pueden reutilizar los artículos quot;esterilizadosquot; dentro de 24 a 72 horas y a veces inmediatamente. En tales ambientes, el período de almacenamiento de 35 24 a 72 horas para la verificación de la esterilidad puede ser poco práctico, costoso, e ineficiente.
Se propuso un proceso de detección para leer los resultados de pruebas de manera más rápida para ciertos ciclos de esterilización con vapor de agua en gravedad y prevacío a 121 º C y 132 º C y ciclos de esterilización con óxido de etileno. El tiempo necesario para observar la evidencia de células indicadoras sobrevivientes se reporta ser tan pequeño 40 como una hora. Se piensa que este proceso involucra detectar la actividad catalítica de la enzima alfa glucosidasa. Esta enzima puede producirse por un microorganismo como un componente normal de su metabolismo y puede presentarse en el revestimiento de la espora del microorganismo en ambas antes y durante la esterilización. La presencia de esta enzima puede detectarse mediante la lectura de la fluorescencia producida por la descomposición de un sustrato no fluorescente de enzima. Esto requiere el uso de un lector fluorométrico automático. La descomposición del sustrato de 45 enzima puede tener una detección temprana alternativa a la espera de un cambio visual de color por pH para indicar un proceso de esterilización fallido. No se requiere ni el crecimiento ni el metabolismo para la señal fluorimétrica. Esto resulta en una reducción en el tiempo requerido para observar un fallo en el proceso de esterilización. Sin embargo, la enzima alfa glucosidasa, que en su origen es termofílica, puede ser más resistente al calor que el microorganismo del que se deriva. Esto puede guiar a fallos molestos, una circunstancia en la que el microorganismo de prueba, de hecho, 50 se mata pero la enzima indicadora indica que el microorganismo permanece viable. En adición, ya que la enzima alfa glucosidasa puede presentarse en el revestimiento de la espora del microorganismo de prueba y su presencia no se necesita en el metabolismo, la detección de esta enzima puede no ser un indicio directo de vida.
Hay situaciones en donde el uso de la enzima alfa glucosidasa puede fallar al discriminar una carga esterilizada sin 55 éxito. La esterilización exitosa con vapor de agua es dependiente tras alcanzar una temperatura y presión eficaz durante una extensión mínima de tiempo. Las esporas bacterianas se seleccionan típicamente como los organismos de prueba para este proceso porque ellas son altamente resistentes a esta combinación de los parámetros. Esto lleva una combinación particularmente letal de temperatura, presión y tiempo para matar esporas bacterianas. Aunque la molécula objetivo/reportera (alfa glucosidasa) es una enzima catalítica derivada de un organismo termofílico, y por lo 60 tanto algo resistente al calor, es el calor del proceso el que destruye a la larga la función de la enzima. Es decir, la presión y el tiempo juegan un papel reducido en la desnaturalización de la alfa glucosidasa. Por ello, bajo condiciones de presión o tiempo subletales la enzima indicadora puede destruirse aun aunque las esporas bacterianas pueden no destruirse. Esto puede resultar en un fallo para detectar una carga no esterilizada.
La incapacidad de la tecnología existente para dar cuenta de todos los parámetros que se relacionan a la muerte celular significa que quot;crecimiento externoquot; puede requerirse para proporcionar en resultado confirmatorio final. Sin embargo, un inconveniente mayor con procesos que requieren lo que se conoce tradicionalmente como crecimiento externo se relaciona al tiempo de retardo en los resultados obtenidos para las pruebas de esterilización. Los indicadores de 5 esterilización que requieren crecimiento externo normalmente emplean el uso de esporas bacterianas que tienen que cultivarse por al menos aproximadamente 24 a 72 horas para asegurar la detección adecuada de cualquier espora sobreviviente. Durante este tiempo, los artículos que pasaron por el proceso de esterilización y que están bajo evaluación no deberían usarse hasta que se determine la prueba de viabilidad de las esporas. Sin embargo, como se indicó anteriormente, esto es poco práctico para muchos usuarios de los artículos que requieren esterilización. 10
Por lo tanto, un problema que se presentó en la materia es proporcionar un indicador biológico que detecta con seguridad y directamente la eficacia de un proceso de esterilización dentro de un período de tiempo relativamente corto. La tecnología descrita proporciona una solución a este problema.
Resumen
La tecnología descrita se relaciona a un indicador biológico desarrollado mediante ingeniería genética, que comprende: al menos un organismo de prueba y al menos un gen reportero apropiado para producir una enzima indicadora, el gen reportero que es captado por el organismo de prueba, y al menos un gen represor que inhibe la expresión del gen 20 reportero hasta que el gen reportero se expone al menos a un inductor.
La tecnología descrita se relaciona a un proceso de esterilización, que comprende: exponer a un medio de esterilización un artículo a esterilizar y el indicador biológico indicado anteriormente.
25 La tecnología descrita se relaciona a un proceso para determinar la eficacia de un proceso de esterilización, que comprende: exponer a un medio de esterilización al menos un artículo a esterilizar y un indicador de esterilización que comprende el indicador biológico indicado anteriormente; y poner en contacto el indicador de esterilización con al menos un inductor y al menos un sustrato de enzima para determinar si la esterilización es eficaz.
30 La tecnología descrita se relaciona a un indicador de esterilización, que comprende: un portador que tiene una primera superficie y una segunda superficie; un soporte, el soporte que tiene una primera sección y una segunda sección, el portador que recubre la primera sección del soporte, la segunda superficie del portador que se adhiere a la primera sección del soporte, y el indicador biológico desarrollado... [Seguir leyendo]
Reivindicaciones:
1. indicador de esterilización, que comprende
un portador, el portador que tiene una primera superficie y una segunda superficie;
un soporte, el soporte que tiene una primera sección y una segunda sección, el portador que recubre la primera 5 sección del soporte, la segunda superficie del portador que se adhiere a la primera sección del soporte; y
un indicador biológico desarrollado mediante ingeniería genética, que comprende:
al menos un organismo de prueba y al menos un gen reportero apropiado para producir una enzima indicadora, el gen reportero que comprende lacZ, bgaB, xylE, cat, gfp, o 10
una mezcla de dos o más de estos, el gen reportero que es captado por el organismo de prueba; y
al menos un gen represor que inhibe la expresión del gen reportero hasta que el gen reportero se expone al menos a un inductor, el gen represor que comprende xylR, lacl, tetR o una mezcla de dos de estos que se soporta por el portador, la segunda sección del soporte que es de dimensión suficiente para permitir manipular el indicador de esterilización sin poner en contacto el indicador biológico. 15
2. indicador de esterilización, que comprende:
un primer compartimiento que contiene un indicador biológico desarrollado mediante ingeniería genética, que comprende: 20
al menos un organismo de prueba y al menos un gen reportero apropiado para producir una enzima indicadora, el gen reportero que comprende lacZ, bgaB, xylE, cat, gfp, o una mezcla de dos o más de estos, el gen reportero que es captado por el organismo de prueba; y
al menos un gen represor que inhibe la expresión del gen reportero hasta que el gen reportero se expone 25 al menos a un inductor, el gen represor que comprende xylR, lacl, tetR o una mezcla de dos de estos, el primer compartimiento que se adapta para permitir al indicador biológico ponerse en contacto con un medio de esterilización durante la esterilización; y
un segundo compartimiento que contiene al menos un inductor y al menos un sustrato de enzima, el segundo compartimiento que se adapta para mantener separados el inductor y el sustrato de enzima del 30 indicador biológico durante la esterilización, y el segundo compartimiento que se adapta para permitir al inductor y al sustrato de enzima ponerse en contacto con el indicador biológico luego de que el indicador biológico se expuso al medio de esterilización.
3. indicador de esterilización de conformidad con la reivindicación 1 o 2, en donde el gen reportero y el gen 35 represor son captados por el organismo de prueba mediante el uso de al menos un plásmido y/o al menos un virus.
4. indicador de esterilización de conformidad con cualquiera de las reivindicaciones 1 a 3, en donde el organismo de prueba comprende una o más bacterias, organismos gram negativos, organismos gram positivos, 40 organismos vegetativos; o en donde el organismo de prueba comprende esporas bacterianas; o en donde el organismo de prueba comprende hongos, micobacterias, protozoos, bacterias vegetativas, o una mezcla de dos o más de estos; o en donde el organismo de prueba comprende células vegetativas.
5. Indicador de esterilización de conformidad con la reivindicación 4, en donde el organismo de prueba 45 comprende Geobacillus stearothermophilus, Bacillus atrophaeus, Bacillus subtilis, Bacillus sphaericus, Bacillus anthracis, Bacillus pumilus, Bacillus coagulans, Clostridium sporogenes, Clostridium difficile, Clostridium botulinum, Bacillus subtilis globigii, Bacillus cereus, Bacillus circulans, Escherichia coli, o una mezcla de dos o más de estos, o Aspergillus niger, Candida albicans, Trichophyton mentagrophytes, Wangiella dermatitis, Mycobacterium chelonae, Mycobacterium gordonae, Mycobacterium smegmantis, Mycobacterium terrae, 50 Mycobacterium bovis, Mycobacterium tuberculosis, Giardia lamblia, Cr y ptosporidium parvum, Aeromonas hydrophila, Enterococcus faecalis, Streptococcus faecalis, Enterococcus faecium, Streptococcus pyrogenes, Escherichia coli, Klebsiella (pneumoniae) , Legionella pneumophila, Methylobacterium, Pseudomonas aeruginosa, Salmonella choleraesuis, Helicobacter pylori, Micrococcus radiodurans, Deinococcus radiodurans, Staphylococcus aureus, Staphylococcus epidermidis, Stenotrophomonas maltophilia, o una mezcla de dos o 55 más de estos, o enterococci resistente a la vancomicina, Staphyloccus aureus, Mycobacterium cheloni, resistente a meticilina o una mezcla de dos o más de estos.
6. Indicador de esterilización de conformidad con cualquiera de las reivindicaciones 1 a 3, en donde se produce una enzima indicadora por el gen reportero, la enzima indicadora comprende beta-D-galactosidasa, 60 cloroamfenicol acetiltransferasa, catacol-2, 3-dioxigenasa, o una mezcla de dos o más de estos.
7. Indicador de esterilización de conformidad con la reivindicación 3 en donde el gen reportero comprende lacZ.
8. Indicador de esterilización de conformidad con la reivindicación 3 en donde el gen reportero comprende xylR.
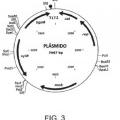
9. indicador de esterilización de conformidad con la reivindicación 3 en donde el plásmido comprende un gen reportero y un gen represor, preferentemente un gen lacZ y un gen xylR, una o más secuencias de ADN que sirven como un origen de replicación, unos o más marcadores genéticos, uno o más sitios de clonación 5 múltiples, uno o más genes que proporcionan un marcador seleccionable para inducir al organismo de prueba a retener el plásmido; y un gen de resistencia a antibiótico, preferentemente un gen del antibiótico cloranfenicol, ampicilina o espectinomicina y/o un gen con capacidad nutricional exógena, preferentemente un gen nutricional de xilosa, lactosa o aminoácido.
10. indicador de esterilización de conformidad con la reivindicación 3, en donde el plásmido comprende al menos un origen de replicación, al menos un gen de marcador seleccionable, al menos un promotor inducible y al menos un gen reportero.
11. indicador de esterilización de conformidad con la reivindicación 3, en donde el tamaño del plásmido está en el 15 intervalo de 2000 a 20000 pares de base.
12. indicador de esterilización de conformidad con la reivindicación 3, en donde de 1 a 3000 copias del mismo plásmido son captadas por una célula única del organismo de prueba.
13. Indicador de esterilización de conformidad con la reivindicación 9, en donde el origen de replicación gram negativo comprende Escherichia coli, y el origen de replicación gram positivo comprende Bacillus subtilis, Geobacallus stearothermophilus, Bacillus atrophaeus, o una mezcla de dos o más de estos.
14. Indicador de esterilización de conformidad con la reivindicación 3, en donde el virus comprende al menos un 25 gen transportador que comprende el ácido nucleico rodeado por una cápsida.
15. Indicador de esterilización de la reivindicación 14, en donde el virus comprende al menos un bacteriófago, preferentemente un bacteriófago lambda o M13.
16. Indicador de esterilización de conformidad con cualquiera de las reivindicaciones 1 a 3 en donde el inductor comprende xilosa, alolactosa, isopropilo tiogalactósido, metalotionina, o una mezcla de dos o más de estos.
17. Un proceso de esterilización, que comprende exponer un artículo a esterilizar y el indicador de esterilización de conformidad con cualquiera de las reivindicaciones 1 a 3 a un medio de esterilización. 35
18. El proceso de la reivindicación 17 en donde el medio de esterilización comprende vapor de agua, calor seco, radiación, plasma, uno o más esterilizantes gaseosos y/o uno o más esterilizantes líquidos; o en donde el medio de esterilización comprende radiación de haz de electrones, radiación electromagnética, radiación gamma, radiación beta, óxido de etileno, peróxido de hidrógeno gaseoso, peróxido de hidrógeno líquido, 40 formalina, glutaraldehído, y/o ácido peracético.
19. Un proceso para determinar la eficacia de la esterilización, que comprende exponer al menos un artículo a esterilizar y un indicador de esterilización de conformidad con cualquiera de las reivindicaciones 1 a 3 a un medio de esterilización; y poner en contacto el indicador de esterilización con al menos un inductor y al menos 45 un sustrato de enzima para determinar la eficacia de la esterilización.
20. El proceso de la reivindicación 19 en donde el inductor comprende xilosa, alolactosa, isopropilo tiogalactósido, metalotionina, o una mezcla de dos o más de estos.
21. El proceso de la reivindicación 19 en donde el sustrato de enzima comprende: 5-Bromo-4-cloro-3-indolil-β-D-galactopiranosida (X-gal) , 5-Bromo-6-cloro-3-indolil-β-galactopiranosida (Mag-gal) , 5-Bromo-3-indolilo- (β -D-galactopiranosida (Bluo-gal) , 6-Bromo-2-naftilo-β-D-galactopiranosida, 6-cloro-3-indolil-β-D-galacotpiranosida (Rose-gal) , 3-indoxil-β-D galactopiranosida (Y-gal) , 5-yodo-3-indoxil- β -D-galactopiranosida, N-metilindoxil-β-D-galactopiranosida, 2-nitrofenil-β-D-galactopiranosida (ONPG) , 4-nitrofenil-β-D-galactopiranosida (PNPG) , fenil-55 β-D-galactopiranosida (P-gal) , 2-cloro-4-nitrofenil-β-D-lactósido, 4-metilumbeliferil-β-D-galactopiranosida, 4-trifluorometilumbeliferil-β-D-galactopiranosida, fluoresceína di (β-D-galactopiranosida) (FDG) , fluoresceína mono-β-D-galactopiranosida, fluoresceína di- (β-D-acetil galactosamina) , 4-metilumbeliferil-β-D-lactopiranosida, 2-naftil-β-D-galactopiranosida, 8-hidroxiquinoleína-β-D-galactopiranosida, Resorufina β-D-galactopiranosida, 3-Carboxiumbeliferil- β -D-galactopiranosida, 4-Clorometil-6, 8-difluoroumbeliferil- β -D-galactopiranosida, 6, 8-60 Difluor-4-metilumbeliferil-β-D-galactopiranosida, 6, 8-Difluoro-4-heptadecilumbeliferil-β-D-galactopiranosida, 5- (Pentafluorobenzoilamino) -fluoresceína-β-D-galactopiranosida, C2-fluoresceína-β-D-galactopiranosida, C8-fluoresceína-β-D-galactopiranosida, C12-fluoresceína-β-D-galactopiranosida, 5-Clorometilfluoresceina-β-D-
galactopiranosida, C12-resorufina-β-D-galactopiranosida, 7-hidroxilo-9H- (1, 3-diclor-9, 9-dimetilacridin-2-ona) (DDAO) , 4-metilumbeliferil elaidato, 4-metilumbeliferil oleato, p-nitrofenil acetato, p-naftil acetato, indoxil acetato, N-metilindoxil acetato, N-metilindoxil miristato, 5-Bromoindoxil acetato, 5-Br-4-CI-3-indolil acetato, Diacetilfluoresceina; o una mezcla de dos o más de estos.
22. Uso de un indicador biológico desarrollado mediante ingeniería genética para detectar la eficacia en un proceso de esterilización, en donde el indicador desarrollado mediante ingeniería genética comprende al menos un organismo de prueba y al menos un gen reportero apropiado para producir una enzima indicadora, el gen reportero que comprende lacZ, bgaB, xylE, cat, gfp, o una mezcla de dos o más de estos, el gen reportero que es captado por el organismo de prueba; y 10
al menos un gen represor que inhibe la expresión del gen reportero hasta que el gen reportero se expone al menos a un inductor, el gen represor que comprende xylR, lacl, tetR, o una mezcla de dos o más de estos.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]