Procedimiento para preparar una composiciónde IgG enriquecida a partir de plasma.
Un procedimiento para preparar una composición de IgG enriquecida a partir de plasma,
comprendiendo el procedimiento las etapas de:
(a) precipitar una fracción de plasma desprovisto de crioprecipitado, en una primera etapa de precipitación, con alcohol entre aproximadamente un 6 % y aproximadamente un 10 % a un pH de entre aproximadamente 7,0 y aproximadamente 7,5 para obtener un primer precipitado y un primer sobrenadante;
(b) precipitar la IgG del primer sobrenadante, en una segunda etapa de precipitación, con alcohol entre aproximadamente un 20 % y aproximadamente un 25 % a un pH de entre aproximadamente 6,7 y aproximadamente 7,3 para formar un segundo precipitado;
(c) resuspender el segundo precipitado para formar una suspensión;
(d) precipitar la IgG de la suspensión formada en la etapa (c), en una tercera etapa de precipitación, con alcohol entre aproximadamente un 22 % y aproximadamente un 28 % a un pH de entre aproximadamente 6,7 y aproximadamente 7,3 para formar un tercer precipitado;
(e) resuspender el tercer precipitado para formar una suspensión; y
(f) separar la fracción soluble de la suspensión formada en la etapa (e), formando de este modo una composición de IgG enriquecida,
en el que al menos una de la primera etapa de precipitación, segunda de precipitación, o tercera etapa de precipitación comprende la adición por pulverización del alcohol.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2010/036470.
Solicitante: BAXTER INTERNATIONAL INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE BAXTER PARKWAY DEERFIELD, IL 60015 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SCHWARZ, HANS-PETER, TESCHNER, WOLFGANG, SVATOS, SONJA, PLJEVLJAKOVIC,AZRA, BRUCKSCHWAIGER,LEOPOLD, NÜRNBERGER,JULIA, BUTTERWECK,HARALD ARNO, GUNDINGER,THOMAS, KOELBL,BERNHARD, GRAUSENBURGER,REINHARD.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/17 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- A61K47/18 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Aminas; Amidas; Ureas; Compuestos de amonio cuaternario; Aminoácidos; Oligopéptidos que tienen hasta cinco aminoácidos.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/08 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Soluciones.
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
PDF original: ES-2525492_T3.pdf



Fragmento de la descripción:
Procedimiento para preparar una composición de IgG enriquecida a partir de plasma
Antecedentes de la invención 5
Los productos de inmunoglobulina de plasma humano se usaron por primera vez en 1952 para tratar una inmunodeficiencia. Inicialmente, la administración intramuscular o subcutánea del isotipo G de inmunoglobulina (IgG) eran los procedimientos de elección. Sin embargo, para inyectar mayores cantidades de IgG necesarias para un tratamiento eficaz de varias enfermedades, se desarrollaron los productos administrables por vía intravenosa con 10 menor concentración de IgG (50 mg/ml) . Normalmente, la inmunoglobulina intravenosa (IVIG) , contiene las inmunoglobulinas de inmunoglobulina G (IgG) combinadas del plasma de más de mil donantes de sangre. Típicamente, contienen más de un 95 % de IgG no modificada, que tiene las funciones efectoras dependientes de Fc intactas, y solo cantidades mínimas de inmunoglobulina A (IgA) o inmunoglobulina M (IgM) , las IVIG son productos de IgG purificados, estériles, usados principalmente en el tratamiento de tres categorías principales de afecciones 15 médicas: (1) inmunodeficiencias tales como agammaglobulinemia ligada al cromosoma X, hipogammaglobulinemia (inmunodeficiencias primarias) , y afecciones de inmunidad deficiente adquirida (inmunodeficiencias secundarias) , con niveles de anticuerpos bajos; (2) enfermedades inflamatorias y autoinmunitarias; y (3) infecciones agudas.
Específicamente, muchas personas con trastornos de inmunodeficiencia primaria carecen de anticuerpos necesarios 20 para resistir la infección. En determinados casos, estas deficiencias se pueden complementar por la infusión de IgG purificada, comúnmente a través de administración intravenosa (es decir, tratamiento con IVIG) . Varios trastornos de inmunodeficiencia primaria se tratan comúnmente de esta manera, incluyendo agammaglobulinemia ligada al cromosoma X (XLA) , inmunodeficiencia variable común (CVID) , síndrome hiper-IgM (HIM) , inmunodeficiencia combinada grave (SCID) , y algunas deficiencias de la subclase de IgG (Blaese y Winkelstein, J. Patient & Family 25 Handbook for Primar y Immunodeficiency Diseases. Towson, MD: Immune Deficiency Foundation; 2007) .
Aunque el tratamiento con IVIG puede ser muy eficaz para tratar trastornos de inmunodeficiencia primaria, este tratamiento solo es una sustitución temporal para los anticuerpos que no se producen en el cuerpo, más que una cura para la enfermedad. En consecuencia, los pacientes dependientes del tratamiento con IVIG requieren dosis repetidas, 30 típicamente, de aproximadamente una vez al mes de por vida. Esta necesidad supone una gran demanda de una producción continuada de composiciones de IVIG. Sin embargo, a diferencia de otros productos biológicos que se producen por medio de la expresión in vitro de vectores de ADN recombinante, la IVIG se fracciona a partir de donantes de sangre y plasma humanos. Por lo tanto, no se pueden incrementar los productos de IVIG incrementando simplemente el volumen de producción. Más bien el nivel de IVIG disponible comercialmente está limitado por el 35 suministro disponible de donaciones de sangre y plasma.
Varios factores impulsan la demanda de IVIG, incluyendo la aceptación de tratamientos con IVIG, la identificación de indicaciones adicionales para las que el tratamiento con IVIG es eficaz, y el incremento del diagnóstico del paciente y la prescripción de IVIG. Notablemente, la demanda global de IVIG se ha más que cuadriplicado desde 1990 y continúa 40 incrementándose en la actualidad a una tasa anual de entre aproximadamente un 7 % y un 10 % (Robert P., Pharmaceutical Policy and Law, 11 (2009) 359-367) . Por ejemplo, la Australian National Blood Authority informó de que la demanda de IVIG en Australia creció un 10, 6 % durante el año presupuestario 2008-2009 (National Blood Authority Australia Annual Report 2008-2009) .
Debido en parte al incremento de la demanda global y de las fluctuaciones en el suministro disponible de productos de inmunoglobulina, varios países, incluyendo Australia e Inglaterra, han implementado programas de gestión de la demanda para proteger los suministros de estos productos para los pacientes con la mayor demanda durante épocas de escasez de productos.
Se ha informado de que en 2007, se fraccionaron 26, 5 millones de litros de plasma, generando 75, 2 toneladas métricas de IVIG, con un promedio del rendimiento de producción de 2, 8 gramos por litro (Robert P., supra) . Este mismo informe estimó que se esperaba que los rendimientos globales de IVIG se incrementaran aproximadamente 3, 43 gramos por litro en 2012. Sin embargo, debido al crecimiento continuado de la demanda global de IVIG, extrapolada entre aproximadamente un 7 % y un 13 % anual entre ahora y el 2015, se necesitará una mejora adicional 55 en el rendimiento de IVIG total para cumplir con la demanda global.
Se usan varios procedimientos de preparación de IVIG por proveedores comerciales de los productos de IVIG. Un problema común con los procedimientos de producción de IVIG actuales es la pérdida sustancial de IgG durante el procedimiento de purificación, que se estima que es al menos de un 30 % a un 35 % del contenido de IgG total del 60 material de partida. Un reto es mantener la calidad de la inactivación vírica y la falta de impurezas que puedan provocar reacciones adversas, reforzando mientras el rendimiento de IgG. En los niveles de producción actuales de IVIG, lo que se considera pequeños incrementos en el rendimiento son, de hecho, altamente significativos. Por ejemplo, en los niveles de producción en 2007, un incremento de un 2 % en la eficacia, igual a 56 miligramos adicionales por litro, generarían 1, 5 toneladas métricas adicionales de IVIG. 65
Los documentos DE 100 08 619, EP 0 893 450, US 4 550 019 divulgan procedimientos para la fabricación de composiciones de inmunoglobulina. Lo mismo se aplica a: documentos US 6 150 471, US 4 499 073; Cammerata-P.B., Cohen-P.P. Fractionation and Properties of Glutamic-Oxalacetic Transaminase. jbc.org. 1981. 53-62. Curling-J-M. Methods of Plasma Protein Fractionation. Academic Press. 1980.
En la cuarta entrega de una serie de artículos influyentes publicados sobre la preparación y las propiedades de las proteínas del suero y del plasma, Cohn et al. (J. Am. Chem. Soc., 1946, 68 (3) : 459-475) describieron por primera vez un procedimiento para el fraccionamiento con alcohol de proteínas del plasma (procedimiento 6) , que permite el aislamiento de una fracción enriquecida en IgG a partir de plasma humano. Varios años después, Oncley et al. (J. Am. Chem. Soc., 1949, 71 (2) : 541-550) ampliaron los procedimientos de Cohn publicando un procedimiento 10 (procedimiento 9) que dio como resultado el aislamiento de una preparación de IgG más pura.
Estos procedimientos, aunque sientan las bases para toda la industria de los factores sanguíneos derivados de plasma, no pudieron proporcionar preparaciones de IgG que tuvieran concentraciones suficientemente altas para el tratamiento de varias enfermedades inmunorrelacionadas, incluyendo síndrome de Kawasaki, púrpura 15 trombocitopénica inmunitaria e inmunodeficiencias primarias. Como tales, se desarrollaron metodologías adicionales que empleaban varias técnicas, tales como cromatografía de intercambio iónico, para proporcionar formulaciones de IgG con mayor pureza y mayor concentración. Hoppe et al. (Munch Med Wochenschr 1967 (34) : 1749-1752) y Falksveden (patente sueca nº 348942) y Falksveden y Lundblad (Methods of Plasma Protein Fractionation 1980) estaban entre los primeros en emplear la cromatografía de intercambio iónico con este propósito. 20
Varios procedimientos modernos emplean una etapa de precipitación, tal como precipitación con caprilato (Lebing et al., Vox Sang 2003 (84) :193-201) y precipitación con etanol de la fracción (I+) II+III de Cohn (Tanaka et al., Braz J Med Biol Res 2000 (33) 37-30) acoplada a cromatografía en columna. Más recientemente, Teschner et al. (Vox Sang, 2007 (92) :42-55) han descrito un procedimiento para la producción de un producto de IVIG al 10 % en el que, en primer 25 lugar, se retira el crioprecipitado de los plasmas combinados y, a continuación, se realiza un fraccionamiento con etanol frío de Cohn-Oncley modificado, seguido del tratamiento S/D del intermedio, cromatografía de intercambio iónico, nanofiltración, y opcionalmente ultrafiltración/diafiltración.
Sin embargo, a pesar de la mejora en pureza, seguridad y rendimiento proporcionada por estos procedimientos de 30 fabricación de IgG, aún se pierde una cantidad significativa de IgG durante el procedimiento de fabricación. Por ejemplo, Teschner et al. informaron de que su procedimiento da como resultado un incremento en el rendimiento... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para preparar una composición de IgG enriquecida a partir de plasma, comprendiendo el procedimiento las etapas de:
(a) precipitar una fracción de plasma desprovisto de crioprecipitado, en una primera etapa de precipitación, con alcohol entre aproximadamente un 6 % y aproximadamente un 10 % a un pH de entre aproximadamente 7, 0 y aproximadamente 7, 5 para obtener un primer precipitado y un primer sobrenadante;
(b) precipitar la IgG del primer sobrenadante, en una segunda etapa de precipitación, con alcohol entre 10 aproximadamente un 20 % y aproximadamente un 25 % a un pH de entre aproximadamente 6, 7 y aproximadamente 7, 3 para formar un segundo precipitado;
(c) resuspender el segundo precipitado para formar una suspensión;
(d) precipitar la IgG de la suspensión formada en la etapa (c) , en una tercera etapa de precipitación, con alcohol entre aproximadamente un 22 % y aproximadamente un 28 % a un pH de entre aproximadamente 6, 7 y aproximadamente 7, 3 para formar un tercer precipitado;
(e) resuspender el tercer precipitado para formar una suspensión; y 20
(f) separar la fracción soluble de la suspensión formada en la etapa (e) , formando de este modo una composición de IgG enriquecida,
en el que al menos una de la primera etapa de precipitación, segunda de precipitación, o tercera etapa de precipitación 25 comprende la adición por pulverización del alcohol.
2. El procedimiento de la reivindicación 1, en el que todas de la primera etapa de precipitación, segunda etapa de precipitación, y tercera etapa de precipitación comprenden la adición por pulverización del alcohol.
3. El procedimiento de la reivindicación 1 o 2, en el que el pH de al menos una de la primera etapa de precipitación, segunda etapa de precipitación, o tercera etapa de precipitación se logra por la adición de una solución modificadora de pH después de la adición del alcohol.
4. El procedimiento de una cualquiera de las reivindicaciones 1 a 3, en el que el pH de todas de la primera etapa de 35 precipitación, segunda etapa de precipitación, y tercera etapa de precipitación se logra por la adición de una solución modificadora de pH después de la adición del alcohol.
5. El procedimiento de la reivindicación 3 o 4, en el que la adición de una solución modificadora de pH comprende la adición por pulverización de la solución modificadora de pH. 40
6. El procedimiento de una cualquiera de las reivindicaciones 3 a 5, en el que el pH de la etapa de precipitación se modifica antes y después de la adición de alcohol, durante y después de la adición de alcohol, o antes, durante y después de la adición de alcohol.
7. El procedimiento de una cualquiera de las reivindicaciones 1 a 6, en el que el pH de al menos una etapa de precipitación se mantiene durante toda la etapa de precipitación por el ajuste continuo del pH.
8. El procedimiento de una cualquiera de las reivindicaciones 1 a 7, en el que el procedimiento comprende además una etapa de purificación de cromatografía de intercambio iónico. 50
9. El procedimiento de la reivindicación 8, en el que el procedimiento comprende tanto una etapa de purificación de cromatografía de intercambio aniónico como una etapa de purificación de cromatografía de intercambio catiónico.
10. El procedimiento de una cualquiera de las reivindicaciones 1 a 9, en el que el procedimiento comprende además 55 una etapa de nanofiltración y/o una etapa de ultrafiltración/diafiltración.
11. El procedimiento de una cualquiera de las reivindicaciones 1 a 10, en el que la composición de IgG enriquecida obtenida en la etapa (f) contiene al menos un 85 %, preferentemente al menos un 90 % del contenido en IgG hallado en la fracción de plasma desprovisto de crioprecipitado usada en la etapa (a) . 60
12. El procedimiento de una cualquiera de las reivindicaciones 1 a 11, en el que la pureza de las γ-globulinas en la composición de IgG final es de al menos aproximadamente un 95 %, preferentemente al menos aproximadamente un 98 %, más preferentemente al menos aproximadamente un 99 %.
13. El procedimiento de la reivindicación 1, en el que el procedimiento comprende las etapas de:
(a) ajustar el pH de una fracción de plasma desprovisto de crioprecipitado a aproximadamente 7, 0;
(b) ajustar la concentración de etanol de la fracción de plasma desprovisto de crioprecipitado de la etapa (a) a aproximadamente un 25 % (v/v) a una temperatura de entre aproximadamente -7 º C y aproximadamente -9 º C, formando de este modo una mezcla; 5
(c) separar líquido y precipitado de la mezcla de la etapa (b) ;
(d) resuspender el precipitado de la etapa (c) con un tampón que contiene fosfato y acetato, en el que se ajusta el pH del tampón con entre 300 ml y 700 ml de ácido acético glacial por 1000 l de tampón, formando de este modo una 10 suspensión;
(e) mezclar dióxido de silicio (SiO2) finamente dividido con la suspensión de la etapa (d) durante al menos aproximadamente 30 minutos;
(f) filtrar la suspensión con un filtro-prensa, formando de este modo un filtrado;
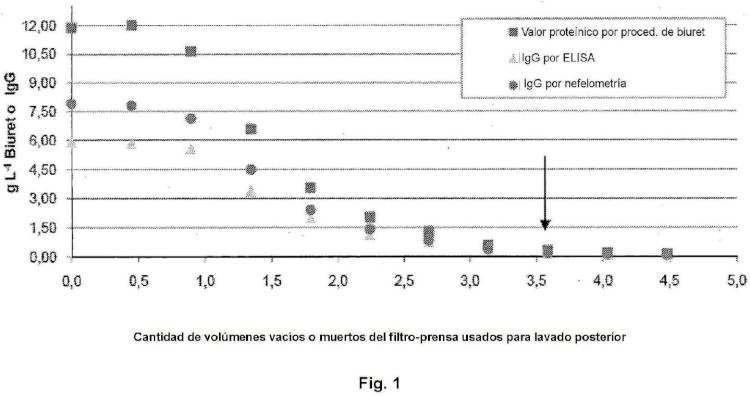
(g) lavar el filtro-prensa con al menos 3 volúmenes muertos del filtro-prensa de un tampón que contiene fosfato y acetato, en el que se ajusta el pH del tampón con entre 50 ml y 200 ml de ácido acético glacial por 1000 l de tampón, formando de este modo una solución de lavado; 20
(h) combinar el filtrado de la etapa (f) con la solución de lavado de la etapa (g) , formando de este modo una solución, y tratar la solución con un detergente;
(i) ajustar el pH de la solución de la etapa (h) a aproximadamente 7, 0 y añadir etanol hasta una concentración final de 25 aproximadamente un 25 %, formando de este modo un precipitado;
(j) separar líquido y precipitado de la mezcla de la etapa (i) ;
(k) disolver el precipitado en una solución acuosa que comprende un disolvente o detergente y mantener la solución 30 durante al menos 60 minutos;
(l) pasar la solución después de la etapa (k) a través de una columna de cromatografía de intercambio catiónico y eluir las proteínas absorbidas en la columna en un eluato;
(m) pasar el eluato de la etapa (1) a través de una columna de cromatografía de intercambio aniónico para generar un efluyente;
(n) pasar el efluyente de la etapa (m) a través de un nanofiltro para generar un nanofiltrado;
(o) pasar el nanofiltrado de la etapa (n) a través de una membrana de ultrafiltración para generar un ultrafiltrado; y
(p) someter a diafiltración el ultrafiltrado de la etapa (o) frente a un tampón de diafiltración para generar un diafiltrado que tiene una concentración de proteína de entre aproximadamente un 8 % (p/v) y aproximadamente un 12 % (p/v) , obteniendo de este modo una composición de IgG concentrada. 45
14. El procedimiento de la reivindicación 13, en el que se ajusta la concentración de etanol en al menos una de las etapas (b) y (i) introduciendo etanol en la fracción por pulverización.
15. El procedimiento de la reivindicación 13 o 14, en el que se ajusta el pH al pH apropiado después de la adición de 50 etanol en al menos una de las etapas (b) y (i) .
16. El procedimiento de la reivindicación 15, en el que se mantiene el pH para toda la reacción de precipitación por el ajuste continuo del pH en al menos una de las etapas (b) y (i) .
17. El procedimiento de una cualquiera de las reivindicaciones 13 a 16, en el que se ajusta el pH en al menos una etapa pulverizando una solución que puede ajustar el pH.
18. El procedimiento de la reivindicación 17, en el que se ajusta el pH pulverizando ácido acético glacial.
19. El procedimiento de una cualquiera de las reivindicaciones 13 a 18, en el que el procedimiento comprende además filtrar el diafiltrado a través de un filtro de 0, 22 μm o menos.
20. El procedimiento de una cualquiera de las reivindicaciones 13 a 19, en el que el plasma es plasma humano.
21. El procedimiento de una cualquiera de reivindicaciones 13 a 20, en el que la fracción de plasma desprovisto de crioprecipitado se forma por un procedimiento que comprende las etapas de:
(i) enfriar una mezcla de donaciones de plasmas combinados hasta una temperatura de entre aproximadamente 2 º C y aproximadamente 10 º C; 5
(ii) separar líquido y precipitado de la mezcla de la etapa (i) por centrifugación;
(iii) adicionar etanol en el sobrenadante líquido formado en la etapa (ii) hasta una concentración final de etanol entre aproximadamente un 5 % (v/v) y aproximadamente un 10 % (v/v) , formando de este modo una mezcla; 10
(iv) enfriar la mezcla formada en la etapa (iii) hasta entre aproximadamente -4 º C y aproximadamente 0 º C;
(v) separar líquido y precipitado de la mezcla de la etapa (iv) por centrifugación; y aislar el sobrenadante, formando de este modo una fracción de plasma desprovisto de crioprecipitado. 15
22. El procedimiento de una cualquiera de las reivindicaciones 13 a 21, en el que la temperatura de la mezcla de la etapa (b) es aproximadamente -7 º C.
23. El procedimiento de una cualquiera de las reivindicaciones 13 a 22, en el que el precipitado formado en la etapa (c) 20 se resuspende con entre aproximadamente 12 l y aproximadamente 18 l de tampón por kg de precipitado, preferentemente con aproximadamente 15 l de tampón por kg de precipitado.
24. El procedimiento de una cualquiera de las reivindicaciones 13 a 23, en el que la cantidad de dióxido de silicio añadida a la suspensión en la etapa (e) está entre aproximadamente 0, 02 gramos por gramo de precipitado formado 25 en la etapa (c) y aproximadamente 0, 06 gramos por gramo de precipitado formado en la etapa (c) , preferentemente en el que la cantidad de dióxido de silicio añadida a la suspensión en la etapa (e) es de aproximadamente 0, 04 gramos por gramo de precipitado formado en la etapa (c) .
25. El procedimiento de una cualquiera de las reivindicaciones 13 a 24, en el que se añade un coadyuvante de filtro a 30 la mezcla antes de la filtración en la etapa (f) .
26. El procedimiento de la reivindicación 25, en el que el coadyuvante de filtro es tierra de diatomeas.
27. El procedimiento de una cualquiera de las reivindicaciones 13 a 26, en el que la pureza de las γ-globulinas en el 35 filtrado formado en la etapa (f) es de al menos aproximadamente un 85 %.
28. El procedimiento de una cualquiera de las reivindicaciones 13 a 27, en el que el filtrado formado en la etapa (f) contiene menos de aproximadamente 10 mg de fibrinógeno por gramo de proteína total.
29. El procedimiento de una cualquiera de las reivindicaciones 13 a 28, en el que el filtrado formado en la etapa (f) contiene menos de aproximadamente 500 IU de actividad de PKA por gramo de proteína total.
30. El procedimiento de una cualquiera de las reivindicaciones 13 a 29, en el que el detergente usado en la etapa (h) comprende polisorbato-80 entre aproximadamente un 0, 1 % (p/v) y aproximadamente un 0, 3 % (p/v) . 45
31. El procedimiento de una cualquiera de las reivindicaciones 13 a 30, en el que la solución acuosa usada en la etapa (k) comprende Triton-X 100, polisorbato-80 y TNBP.
32. El procedimiento de una cualquiera de las reivindicaciones 13 a 31, en el que se mantiene la solución en la etapa 50 (k) a una temperatura de entre aproximadamente 18 º C y aproximadamente 25 º C.
33. El procedimiento de una cualquiera de las reivindicaciones 13 a 32, en el que el nanofiltro de la etapa (n) tiene un tamaño de poro medio de entre aproximadamente 15 nm y aproximadamente 72 nm, preferentemente de entre aproximadamente 19 nm y aproximadamente 35 nm, más preferentemente de aproximadamente 35 nm. 55
34. El procedimiento de una cualquiera de las reivindicaciones 13 a 33, en el que la membrana de ultrafiltración de la etapa (o) tiene un límite de peso molecular nominal (NMWCO) de aproximadamente 100 kDa o menos.
35. El procedimiento de una cualquiera de las reivindicaciones 13 a 34, en el que la concentración de proteína de la 60 composición es de aproximadamente un 10 % (p/v) .
36. El procedimiento de una cualquiera de las reivindicaciones 13 a 35, en el que la solución formada en la etapa (h) contiene al menos aproximadamente un 85 %, preferentemente al menos aproximadamente un 90 % de la IgG presente en la fracción de plasma desprovisto de crioprecipitado de la etapa (a) . 65
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Nuevo método de producción de lipoplejo para administración local y fármaco antitumoral que utiliza lipoplejo, del 24 de Junio de 2020, de Delta-Fly Pharma, Inc: Un método para producir un lipoplejo que comprende dioleilfosfatidiletanolamina (DOPE), fosfatidilcolina, un lípido catiónico y moléculas de ARNi, que comprende las etapas […]
Solución oftálmica de tartrato de brimonidina tópica, del 17 de Junio de 2020, de Sentiss Pharma Private Limited: Una composición oftálmica acuosa que comprende tartrato de brimonidina, hidroxipropilmetilcelulosa y desprovisto de polímero celulósico aniónico, junto con un conservante […]
Composición que contiene ácido graso poliinsaturado, del 17 de Junio de 2020, de SUNSTAR INC.: Utilización externa de una composición que comprende un componente (A) y un componente (B) mostrados a continuación, dispersándose el componente […]
Formulaciones líquidas de levotiroxina, del 17 de Junio de 2020, de TAP Pharmaceuticals AG: Una disolución farmacéutica que comprende: - de 0,001 % p/v a 0,01 % p/v de una levotiroxina; - al menos 70 % p/p de glicerol; - menos del 30 % p/p […]
Anticuerpos anti-IL-23 humanos, composiciones, procedimientos y usos, del 17 de Junio de 2020, de Janssen Biotech, Inc: un anticuerpo para IL-23p19 aislado, en donde dicho anticuerpo se genera completamente humano a partir de expresión de fagos y se une a […]
Estabilización de productos para el cuidado del cuerpo y del hogar contra la degradación por radiación UV utilizando derivados de merocianina, del 10 de Junio de 2020, de BASF SE: Uso de estabilizadores de formula **(Ver fórmula)** en donde L1, L2 y L3 independientemente uno del otro son hidrogeno; R4 […]