Micropartículas lipófilas que contienen un fármaco o un antígeno proteico y formulación que comprende las mismas.
Una micropartícula lipófila con un tamaño medio de partícula que varía entre 0,
1 y 200 μm, que comprende del 1 al 99,999 % en peso de una sustancia lipófila, ácido hialurónico o una sal inorgánica del mismo, y un principio activo seleccionado de entre el grupo que consiste en un fármaco proteico o peptídico y un antígeno, en la que la micropartícula lipófila se prepara mediante la disolución del principio activo en una disolución acuosa, que contiene ácido hialurónico o una sal inorgánica del mismo, y opcionalmente, otros componentes, añadiendo una sustancia tensioactiva lipófila y secando por pulverización la disolución resultante.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2000/000025.
Solicitante: LG LIFE SCIENCES, LTD..
Nacionalidad solicitante: República de Corea.
Dirección: 20, YOIDO-DONG, YOUNGDUNGPO-GU SEOUL 150-721 REPUBLICA DE COREA.
Inventor/es: KIM, MYUNG JIN, KIM, SUN JIN, KWON,Kyu Chan, KIM,JOON.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K38/21 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Interferones.
- A61K38/22 A61K 38/00 […] › Hormonas (derivados de pro-opiomelanocortina, pro-encefalina o pro-dinorfina A61K 38/33, p. ej. corticotropina A61K 38/35).
- A61K38/27 A61K 38/00 […] › Hormona de crecimiento [GH] (Somatotropina).
- A61K38/28 A61K 38/00 […] › Insulinas.
- A61K38/46 A61K 38/00 […] › Hidrolasas (3).
- A61K39/00 A61K […] › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K39/008 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos de Leishmania.
- A61K39/04 A61K 39/00 […] › Mycobacterium, p. ej. Mycobacterium tuberculosis.
- A61K39/09 A61K 39/00 […] › Streptococcus.
- A61K39/095 A61K 39/00 […] › Neisseria.
- A61K39/10 A61K 39/00 […] › Brucella; Bordetella, p. ej. Bordetella pertussis.
- A61K39/102 A61K 39/00 […] › Pasteurella; Haemophilus.
- A61K39/104 A61K 39/00 […] › Pseudomonas.
- A61K39/106 A61K 39/00 […] › Vibrio; Campylobacter.
- A61K39/108 A61K 39/00 […] › Escherichia; Klebsiella.
- A61K39/112 A61K 39/00 […] › Salmonella; Shigella.
- A61K39/12 A61K 39/00 […] › Antígenos virales.
- A61K39/13 A61K 39/00 […] › Virus de la poliomielitis.
- A61K39/135 A61K 39/00 […] › Virus de la fiebre aftosa.
- A61K39/145 A61K 39/00 […] › Orthomyxoviridae, p. ej. virus de la influenza.
- A61K39/165 A61K 39/00 […] › Virus de la parotiditis o del sarampión.
- A61K39/175 A61K 39/00 […] › Virus del moquillo canino.
- A61K39/205 A61K 39/00 […] › Rhabdoviridae, p. ej. virus de la rabia.
- A61K39/235 A61K 39/00 […] › Adenoviridae.
- A61K39/29 A61K 39/00 […] › Virus de la hepatitis.
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61K47/18 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Aminas; Amidas; Ureas; Compuestos de amonio cuaternario; Aminoácidos; Oligopéptidos que tienen hasta cinco aminoácidos.
- A61K47/34 A61K 47/00 […] › Compuestos macromoleculares obtenidos por reacciones distintas a aquellas en las que intervienen solamente enlaces insaturados carbono-carbono, p. ej. poliésteres, poly(amino ácidos), polisiloxanos, polifosfacinas, copolímeros de polialquilenglicol o poloxámeros (A61K 47/10 tiene prioridad).
- A61K47/42 A61K 47/00 […] › Proteínas; Polipéptidos; Sus productos de degradación; Sus derivados, p. ej. albúmina, gelatina or zeína (oligopéptidos que contienen hasta cinco aminoácidos A61K 47/18; poliaminoácidos A61K 47/34).
- A61K47/44 A61K 47/00 […] › Aceites, grasas o ceras previstas en dos o más grupos de A61K 47/02 - A61K 47/42; Aceites naturales o aceites naturales modificados, grasas o ceras, p. ej. aceite de ricino, aceite de ricino polietoxilado, cera Montana, lignito, goma laca, colofonía, cera de abeja o lanolina (glicéridos sintéticos, p. ej. triglicéridos de cadena mediana, A61K 47/14).
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/10 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Dispersiones; Emulsiones.
- A61K9/107 A61K 9/00 […] › Emulsiones.
- A61K9/113 A61K 9/00 […] › Emulsiones múltiples, p. ej. aceite-agua-aceite.
- A61K9/12 A61K 9/00 […] › Aerosoles; Espumas.
- A61K9/14 A61K 9/00 […] › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/16 A61K 9/00 […] › Aglomerados; Granulados; Microbolitas.
- A61K9/50 A61K 9/00 […] › Microcápsulas (A61K 9/52 tiene prioridad).
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- A61P31/06 A61P 31/00 […] › para la tuberculosis.
- A61P31/10 A61P 31/00 […] › Antifúngicos.
- A61P31/14 A61P 31/00 […] › para virus ARN.
- A61P31/16 A61P 31/00 […] › para virus de la gripe o rinovirus.
- A61P31/20 A61P 31/00 […] › para los virus DNA.
- A61P33/02 A61P […] › A61P 33/00 Agentes antiparasitarios. › Antiprotozoarios, p. ej. para la leishmaniasis, tricomoniasis, toxoplasmosis.
- A61P5/50 A61P […] › A61P 5/00 Medicamentos para el tratamiento de trastornos del sistema endocrino. › para aumentar o potenciar la actividad de la insulina.
PDF original: ES-2505696_T3.pdf
Fragmento de la descripción:
Micropartículas lipófilas que contienen un fármaco o un antígeno proteico y formulación que comprende las mismas
Campo de la invención La presente invención se refiere a micropartículas, dispersiones, formulaciones en emulsión de aceite en agua y formulaciones en aerosol de acuerdo con las reivindicaciones 1 - 19. 5
Antecedentes de la invención Es bien conocido que los fármacos o los antígenos proteicos adolecen de un problema de desnaturalización provocada por el calor, los disolventes orgánicos y/o un pH desfavorable (Weiqi Lu y col., PDA J. Pharm. Sci. Tech., 49, 13 - 19 (1995) ) . Habitualmente son administrados mediante inyección; sin embargo, debido a que sus actividades in vivo sólo duran un corto periodo de tiempo después de su administración, deben ser administrados 10 repetidamente cuando se requiere un tratamiento a largo plazo. Por ejemplo, para tratar el enanismo infantil por déficit hipofisario, debe inyectarse la hormona de crecimiento humana (hGH) diariamente o cada dos días durante un periodo de 6 meses o más. Por lo tanto, se han realizado muchos esfuerzos para desarrollar formulaciones eficaces de liberación sostenida de fármacos o de antígenos proteicos .
Por ejemplo, se han realizado amplios estudios para desarrollar una formulación de micropartículas de acción 15 sostenida preparada mediante el recubrimiento de un fármaco o de un antígeno proteico con un polímero sintético biodegradable, por ejemplo, polilactida, poliglicólido, poli (lactida-co-glicólido) , poli-orto-éster o polianhídrido, que libera de forma continua el fármaco o el antígeno según se degrada el polímero en el cuerpo (M. Chasin y R. Langer, ed., Biodegradable Polymers as Drug Deliver y Systems, Marcel Dekker (1990) ; y Heller, J., Adv. Drug Del. Rev., 10, 163 (1993) ) . Aunque este tipo de formulación tiene varias ventajas, adolece del grave problema de que el fármaco o 20 el antígeno experimentan una desnaturalización tras su contacto con un disolvente orgánico durante el proceso de preparación del mismo (Park, T. G. y col., J. Control. Rel., 33, 211 - 223 (1995) ) . El uso de un disolvente orgánico es imprescindible debido a que el polímero biodegradable sólo se disuelve en un disolvente orgánico, por ejemplo, cloruro de metileno, acetato de etilo, acetonitrilo, cloroformo o acetona.
Con objeto de evitar dicho contacto indeseable de un fármaco o de un antígeno con un disolvente orgánico, Lee y 25 col. han preparado una micropartícula mediante el recubrimiento de un antígeno con un polímero soluble en agua para obtener una partícula primaria; dispersando la partícula primaria en un disolvente orgánico que contiene un polímero biodegradable; y secando la dispersión resultante para obtener una micropartícula final (Lee, H. K. y col., J. Control. Rel., 44, 283 - 294 (1997) ; y la Patente de EE.UU. Nº 5.753.234) . Sin embargo, el proceso de preparación de dicha micropartícula es complicado y no es rentable. 30
También se han realizado intentos de desarrollar una formulación de liberación sostenida que contenga un polímero natural, por ejemplo, gelatina, colágeno, chitosan, carboximetil celulosa, alginato o ácido hialurónico. El polímero natural absorbe agua fácilmente para formar un gel con una elevada viscosidad que libera lentamente un fármaco o un antígeno. Por ejemplo, la Patente de EE.UU. Nº 5.416.017 desvela una formulación de liberación sostenida para inyección de eritropoyetina que contiene entre un 0, 01 y un 3 % de gel de ácido hialurónico; la Patente Japonesa 35 abierta a consulta por el público Nº 1-287041 (1989) , una formulación de liberación sostenida para inyección de insulina que contiene un 1 % de un gel de ácido hialurónico; la Patente Japonesa abierta a consulta por el público Nº 2 - 213 (1990) , una formulación de liberación sostenida de calcitonina o de hormona de crecimiento humana que contiene un 5 % de gel de ácido hialurónico; y Meyer, J. y col. (J. Controlled Rel., 35, 67 (1995) ) , una formulación de liberación sostenida de factor estimulante de las colonias de granulocitos (G-CSF) que contiene entre un 0, 5 y un 4 40 % de gel de ácido hialurónico.
Dichas formulaciones en gel de ácido hialurónico tienen un efecto de liberación sostenida debido a que los fármacos proteicos pasan lentamente a través de la matriz de gel con una elevada viscosidad. Sin embargo, un gel con una concentración de ácido hialurónico de varios % tiene una elevada viscosidad, por ejemplo, del orden de 105 a 107 centipoises, lo que hace difícil la inyección del mismo. Además, dado que tanto el fármaco como el ácido hialurónico 45 se disuelven en agua, una formulación de hialurónico que es fácilmente diluida por los fluidos corporales tras la inyección, con una subsiguiente rápida liberación del fármaco, habitualmente en un día. Por ejemplo, la Patente Japonesa abierta a consulta por el público Nº 1-287041 (1989) desvela que cuando se inyectó una formulación al 1 % de gel de ácido hialurónico que contiene insulina a un conejo, el efecto de disminución del nivel sanguíneo de glucosa era sostenido únicamente durante 24 horas; y Meyer, J. y col. (vide supra) y la Patente de EE.UU. Nº 50 5.416.017, que cuando se administran a un animal una formulación al 2 % de gel de ácido hialurónico que contiene G-CSF y una formulación al 1, 5 % de gel de ácido hialurónico que contiene interferón-α junto con proteína sérica, los niveles sanguíneos de estos fármacos proteicos caen repentinamente hasta por debajo de 1/10 de los niveles iniciales en 24 horas.
El hialuronato de bencilo (HYAFFâ¢, Fidia S.P.A.) , un éster sintético preparado mediante la esterificación del ácido 55 hialurónico natural con alcohol bencílico, no se disuelve en agua sino en un disolvente orgánico tal como dimetilsulfóxido (DMSO) . Se ha preparado una formulación de micropartículas de hialuronato de bencilo sólido que contiene un fármaco proteico mediante el método de emulsión-extracción con disolvente (Nightlinger, N.S. y col., Proceed. Intern. Sump. Control Rel. Bioact. Mater., 22º , artículo Nº 3205 (1995) ; y Ilum, L. y col., J. Controlled Rel., 29, 133 (1994) ) , que se lleva a cabo mediante la disolución del hialuronato de bencilo en DMSO; la dispersión del fármaco proteico en la disolución resultante; la adición de la dispersión resultante a un aceite mineral para formar una emulsión; y la adición de un disolvente que es miscible con el DMSO, por ejemplo, acetato de etilo, a la emulsión para extraer el DMSO de la misma, para obtener micropartículas sólidas que comprenden el fármaco 5 proteico e hialuronato de bencilo.
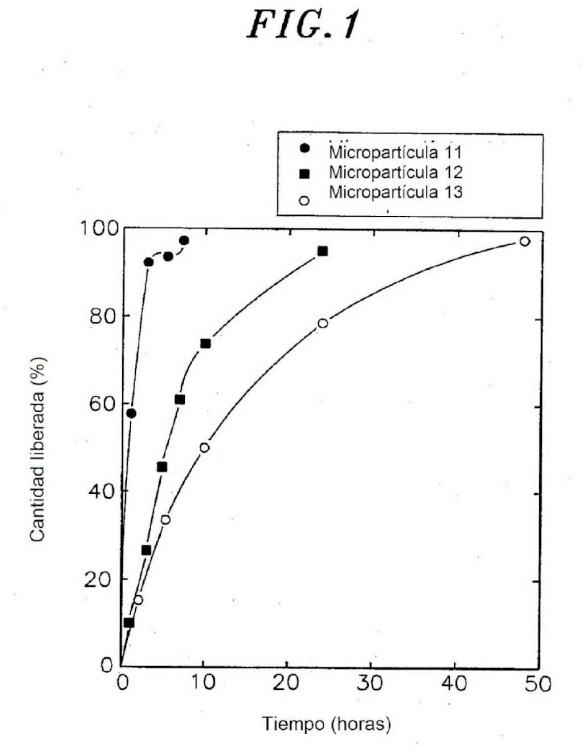
Sin embargo, la formulación de hialuronato de bencilo tiene el inconveniente de que el fármaco proteico puede ser fácilmente desnaturalizado por el disolvente orgánico usado en la etapa preparativa, y también por el propio hialuronato de bencilo hidrófobo. Un ensayo de liberación in vitro de una micropartícula de hialuronato de bencilo que comprende factor estimulante de las colonias de granulocitos y macrófagos (GM-CSF) demostró que 10 únicamente el 25 % del GM-CSF era liberado en los 2 días iniciales, y a continuación, ya no más GM-CSF (Nightlinger, N.S. y col., vide supra) , lo que sugiere que la mayor parte del fármaco proteico estaba desnaturalizado.
Mientras tanto se realizaron varios intentos de desarrollar una formulación oral de un fármaco proteico o de un antígeno, mediante el uso, en particular, del hecho de que una micropartícula que contiene un antígeno con un tamaño de partícula de 5 μm o menos puede ser fácilmente fagocitada por un fagocito. Por lo tanto se espera que un 15 antígeno pueda ser dirigido a una ubicación específica del cuerpo, por ejemplo, las placas de Payer del intestino delgado.
Sin embargo, es difícil para las células M de las placas de Peyer absorber un antígeno debido a su hidrofobicidad y elevado peso molecular. Para mejorar la absorción de un antígeno por parte de las células M, se han empleado un agente mejorador de la absorción, tal como una micela mixta de ácidos biliares - ácidos grasos, un quelante, ácidos 20 grasos, fosfolípidos, acrilcarnitina, tensioactivos, glicéridos de cadena media (Lee, V. H. L., Crit. Rev. Ther. Drug Carrier Systems, 5, 69 - 97 (1988) ; Yoshioka, S. y col., J. Pharm. Sci., 71, 593 - 597 (1982) ; Scott - Moncrieff, J. C. y col., J. Pharm. Sci., 83, 1465 - 1469 (1994) ; Muranishi, S. y col., Chem. Pharm. Bull., 25, 1159 - 1163 (1977) ; Fix, J. A. y col., Am. J. Physiol., 251, G332 - G340 (1986) ; Shao, Z. y col., Pharm. Res., 10, 143 - 250 (1993) ; Constantinides, P. P. y col., Proc. Int. Symp. Control. Release Bioactive Mater., 20, 184 - 185 (1993) ; y Bjork, E. y 25 col., J. Drug Targeting,... [Seguir leyendo]
Reivindicaciones:
1. Una micropartícula lipófila con un tamaño medio de partícula que varía entre 0, 1 y 200 μm, que comprende del 1 al 99, 999 % en peso de una sustancia lipófila, ácido hialurónico o una sal inorgánica del mismo, y un principio activo seleccionado de entre el grupo que consiste en un fármaco proteico o peptídico y un antígeno, en la que la micropartícula lipófila se prepara mediante la disolución del principio activo en una disolución acuosa, que contiene 5 ácido hialurónico o una sal inorgánica del mismo, y opcionalmente, otros componentes, añadiendo una sustancia tensioactiva lipófila y secando por pulverización la disolución resultante.
2. La micropartícula lipófila de la reivindicación 1, en la que el tamaño medio de partícula está en el intervalo de entre 1 y 50 μm.
3. La micropartícula lipófila de la reivindicación 1, en la que el fármaco está seleccionado de entre el grupo que 10 consiste en la hormona de crecimiento humana, la hormona de crecimiento bovina, la hormona de crecimiento porcina, la hormona liberadora de la hormona de crecimiento, el péptido liberador de la hormona de crecimiento, el factor estimulante de las colonias de granulocitos, el factor estimulante de las colonias de granulocitos y macrófagos, el factor estimulante de las colonias de macrófagos, eritropoyetina, la proteína morfogenética ósea, interferón, insulina, atriopeptina-III, un anticuerpo monoclonal, el factor de necrosis tumoral, el factor activador de los 15 macrófagos, interleucina, el factor degenerador tumoral, el factor de crecimiento insulinoide, el factor de crecimiento epidérmico, el activador tisular del plasminógeno y la urocinasa.
4. La micropartícula lipófila de la reivindicación 1, en la que el antígeno se obtiene a partir de: uno o más patógenos seleccionados de entre el grupo que consiste en adenovirus de tipo 4 y 7, el virus de la hepatitis A, el virus de la hepatitis B, el virus de la hepatitis C, el virus de la gripe A y B, el virus de la encefalitis japonesa B, el virus del 20 sarampión, el virus de las paperas, el virus de la rubéola, el virus de la polio, el virus de la rabia, el virus de la varicela, el virus de la fiebre amarilla y el virus de la inmunodeficiencia humana; uno o más patógenos seleccionados de entre el grupo que consiste en Bordetella pertussis, Borrelia burgdorferi, Eshccherichia coli enterotoxigénica, Haemophilus influenza de tipo b, Mycobacterium leprae, Mycobacterium tuberculosis, Neisseria meningitidis A y C, Neisseria meningitidis B, Pseudomonas aeruginosa, Pseudomonas cepacia, Salmonella typhi, Shigella spp., 25 Streptococcus pneumoniae y Vibrio cholerae; uno o más patógenos seleccionados de entre el grupo que consiste en Coccidiodes immitis, Leishmania sp. y Plasmodium sp.; uno o más patógenos responsables de las enfermedades seleccionadas de entre el grupo que consiste en carbunco sintomático bovino, fiebre epidémica bovina, carbunco bovino, enfermedad de Akabane bovina, fiebre aftosa bovina, mamitis bovina, inflamación nasotraqueal infecciosa bovina, diarrea vírica bovina, gastroenteritis infecciosa bovina, cólera porcina, diarrea epidémica porcina, gastritis 30 atrófica porcina, enfermedad porcina causada por pavovirus, enteritis porcina causada por rotavirus, enfermedad de Newcastle en pollos, enfermedad de Marek en pollos, encefalomielitis en pollos, rabia, moquillos canino, enteritis canina causada por parvovirus y hepatitis infecciosa canina, siendo el antígeno un antígeno atenuado, inactivado o recombinante; o ADN, ARN, plásmido, ADN u oligonucleótido de CpG extraído del patógeno.
5. La micropartícula lipófila de la reivindicación 1, en la que la sustancia lipófila está seleccionada de entre el grupo 35 que consiste en un lípido, un derivado lipídico, un ácido graso, un derivado de un ácido graso, una cera y una mezcla de los mismos.
6. La micropartícula lipófila de la reivindicación 5, en la que el lípido es lecitina, fosfatidilcolina, fosfatidiletanolamina, fosfatidilserina y fosfatidilinositol o fosfatidilserina, y el derivado lipídico es araquidoil fosfatidilcolina o estearoil fosfatidilcolina. 40
7. La micropartícula lipófila de la reivindicación 5, en la que el ácido graso es ácido mirístico, ácido palmítico o ácido esteárico, y el derivado de un ácido graso es estearato de glicerilo, palmitato de sorbitano, estearato de sorbitano, monooleato o polisorbato de sorbitano.
8. La micropartícula lipófila de la reivindicación 1, en la que la sal inorgánica del ácido hialurónico es hialuronato de sodio, hialuronato de potasio, hialuronato de amonio, hialuronato de calcio, hialuronato de magnesio, hialuronato de 45 cinc o hialuronato de cobalto.
9. La micropartícula lipófila de la reivindicación 1, que comprende adicionalmente un excipiente soluble en agua.
10. La micropartícula lipófila de la reivindicación 9, en la que el excipiente soluble en agua está seleccionado de entre el grupo que consiste en un carbohidrato, una proteína, un aminoácido, un ácido graso, una sal inorgánica, un tensioactivo, polietilenglicol y una mezcla de los mismos. 50
11. Una formulación en dispersión preparada mediante la dispersión de la micropartícula lipófila de una cualquiera de las reivindicaciones 1 y 9 en un medio lipófilo.
12. La formulación en dispersión de la reivindicación 11, en la que el medio lipófilo es un aceite comestible, un aceite mineral, escualeno, escualano, aceite de hígado de bacalao, mono, di o triglicéridos, o una mezcla de los mismos.
13. La formulación en dispersión de la reivindicación 12, en la que el aceite comestible es aceite de maíz, aceite de 55
oliva, aceite de cártamo, aceite de semilla de algodón, aceite de cacahuete, aceite de sésamo, aceite de girasol o una mezcla de los mismos.
14. La formulación en dispersión de la reivindicación 11, en la que el medio lipófilo comprende adicionalmente un agente dispersante o un conservante.
15. La formulación en dispersión de una cualquiera de las reivindicaciones 11 y 14, que se usa para inyección o para 5 administración oral.
16. Una formulación en emulsión de aceite en agua que comprende un medio de inyección acuoso y la formulación dispersante de la reivindicación 11
17. La formulación en emulsión de aceite en agua de la reivindicación 16, en la que el medio de inyección acuoso es agua destilada o una disolución tamponada. 10
18. La formulación en emulsión de aceite en agua de la reivindicación 16, en la que el principio activo es un antígeno y el medio de inyección acuoso comprende adicionalmente un segundo antígeno.
19. Una formulación en aerosol que comprende la micropartícula lipófila de una cualquiera de las reivindicaciones 1 a 10.
Patentes similares o relacionadas:
 CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
Compuestos y sus efectos sobre el control del apetito y la sensibilidad a la insulina, del 10 de Junio de 2020, de IMPERIAL COLLEGE INNOVATIONS LIMITED: Un éster de propionato de inulina para su uso en la terapia para la reducción del apetito, ingesta de alimentos y/o ingesta de calorías y/o para mejorar […]
Formulaciones de liberación sostenida utilizando vehículos no acuosos, del 29 de Abril de 2020, de Amylin Pharmaceuticals, LLC: Una formulación fabricada premezclada para inyección que comprende una suspensión de (i) un vehículo no acuoso farmacéuticamente aceptable que 5 comprende […]
Combinación de una insulina y un agonista de GLP-1, del 18 de Diciembre de 2019, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Combinación farmacéutica que comprende (a) Gly(A21)-Arg(B31)-Arg(B32)-insulina humana o/y una sal de la misma tolerable desde el punto de vista […]
Bifidobacterias para el tratamiento de diabetes y afecciones relacionadas, del 30 de Octubre de 2019, de Dupont Nutrition Biosciences ApS: Una bacteria de la especie Bifidobacterium animalis subesp. lactis cepa 420 (B420) para su uso en el tratamiento de una o más de las siguientes […]
Composición que comprende la proteína HIP/PAP o uno de sus derivados para el tratamiento de la resistencia a la insulina, del 11 de Septiembre de 2019, de THE HEALTHY AGING COMPANY: Proteína HIP/PAP, o uno de sus derivados, para su utilización para el tratamiento o la prevención de la resistencia a la insulina en sujetos no insulino-requirientes, […]
Inhibidores de fumagilol metap2 modificados o conjugados con polímeros para uso en el tratamiento de la obesidad, del 17 de Julio de 2019, de Syndevrx, Inc: Un compuesto para uso terapéutico para causar pérdida de peso en un sujeto que lo necesita, en donde el sujeto tiene sobrepeso u obesidad, en donde […]
Formulaciones novedosas de agonistas de la exendina y métodos de administración de los mismos, del 15 de Mayo de 2019, de Amylin Pharmaceuticals, LLC: Una formulación farmacéutica que es una forma farmacéutica líquida estable adecuada para la administración en múltiples usos que comprende del 0, 005% al 0, 4% (p/v) de un […]