Procedimiento para la purificación de DNAK.
Preparación de DnaK purificada recombinante obtenible mediante un procedimiento que comprende las etapas de
a) cromatografía de intercambio iónico,
b) cromatografía de hidroxilapatito, y
c) cromatografía de gelatina,
en la que la preparación de la Dnak tiene:
- una actividad de ATPasa sin la adición de ninguna otra proteína chaperona,
- una pureza del 98 % en peso de proteína, y
- está esencialmente exenta de impurezas estimulantes de los linfocitos T.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/060875.
Solicitante: BIOTECH TOOLS S.A.
Nacionalidad solicitante: Bélgica.
Dirección: RUE DE RANSBEEK 230 BLOCK V 1120 BRUSSELS BELGICA.
Inventor/es: HENOT,Frédéric, LEGON,Thierry, PIROTTON,SABINE, PLACIER,GAEL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/245 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Escherichia (G).
- C07K14/47 C07K 14/00 […] › de mamíferos.
PDF original: ES-2509351_T3.pdf


Fragmento de la descripción:
Procedimiento para la purificación de DNAK
La presente invención se refiere a un procedimiento para la purificación de proteínas de choque térmico.
La expresión de las proteínas de choque térmico (HSPs) puede ser regulada por aumento por todas las células en condiciones de estrés. Son chaperonas moleculares y están implicadas en el plegamiento de las proteínas.
Las HSPs se clasifican en aproximadamente seis familias y están muy conservadas a lo largo de la evolución.
Los complejos entre las HSPs y péptidos juegan un papel en la presentación del antígeno. Las HSPs también están implicadas en algunas enfermedades autoinmunes. Para una revisión, véase van Eden y col., Nature Reviews. Immunology 5 (2005) 318 -330.
La DnaK es el miembro bacteriano de la familia HSP 70. Se conocen procedimientos para la purificación de la DnaK, pero la pureza de las preparaciones es cuestionable. Típicamente, las preparaciones de la DnaK se consideran puras si sólo hay una banda detectable en una SDS-PAGE. No obstante, dichas preparaciones no son muy puras.
Schönfeld y col. J. Biol. Chem. 270 (1995) 2183 -2189 describen una DnaK pura mediante SDS-PAGE, pero el análisis de filtración en gel muestra al menos tres picos.
Los procedimientos para la purificación de las HSP son conocidos, véase por ejemplo, -Nandan y col. J., Immunological Methods (1994) 176: 255 -264, -Grossmann y col., Exp. cell Res. (2004) 297: 108 -117, -Peng y col., J. Immunological Methods (1997) 204: 13 -21 y -Jindal y col., Biotechnology (1995) 13: 1105 -1109.
Se han notificado datos incoherentes en el pasado relativos a las propiedades inmunológicas de las HSP, especialmente de la DnaK. La DnaK mejora el procesado de los antígenos a través del complejo mayor de histocompatibilidad (MHC) de clase I o de clase II en las células presentadoras del antígeno (Tobian y col., J. Immunological 172 (2004) , 5277 -5286; Tobian, Canaday, Harding J. Immunol. 173 (2004) 5130 -5137) . La DnaK natural, dependiendo de su origen, la dosis y la vía de administración, puede mostrar diferentes tipos de efectos inmunológicos, incluso contradictorios (van Eden, van der Zee y Prakken Nat Rev. Immunol. 5 (2005) : 318 -330) . Se han observado respuestas autoinmunes frente a las HSP autólogas en enfermedades inflamatorias crónicas, tales como la artritis reumatoide, la diabetes de tipo I y la aterosclerosis. Se sospecha que la reacción cruzada antigénica entre la HSP bacteriana y la HSP autóloga es la causa del desarrollo de autoinmunidad. Por otro lado, en ensayos clínicos de diabetes de tipo I y de artritis reumatoide, también se ha demostrado que la HSP promueve un cambio en los linfocitos T desde un perfil de secreción de citocinas proinflamatorias hacia un perfil de secreción de citocinas reguladoras, lo que sugiere una inmunorregulación de la enfermedad inflamatoria (Bloemendal y col., Clin. Exp. Immunol. 110 (1997) : 72 -78) . Más recientemente, Galdiero y col. han notificado que la DnaK no induce el aumento de la expresión de moléculas coestimulantes (CD80 / CD86) sobre linfocitos y macrófagos (Galdiero y col., Int. J. Immunopathol. Pharmacol. 18 (2005) 637 -644) .
Se cree que estas incoherencias se basan en los diferentes procedimientos de purificación, que producen DnaK junto con diversas impurezas y contaminantes. Además, dado que la DnaK es una ATPasa, se une a nucleótidos de adenina. Coexisten diferentes formas de DnaK y pueden ser purificadas: la DnaK cargada con ATP, la DnaK cargada con ADP y la DnaK exenta de nucleótidos. Estas diferentes formas de DnaK pueden tener diferentes efectos inmunológicos.
Es el objeto de la presente invención proporcionar un procedimiento para la purificación de DnaK que supere al menos algunos de los inconvenientes de la técnica anterior, especialmente proporcionar una DnaK con una pureza aumentada.
El problema es resuelto en un aspecto mediante una preparación de DnaK purificada recombinante, obtenible mediante un procedimiento que comprende las etapas de a) cromatografía de intercambio iónico, b) cromatografía de hidroxilapatito, y c) cromatografía de gelatina, en la que la preparación de la Dnak tiene:
- una actividad de ATPasa sin la adición de ninguna otra proteína chaperona, -una pureza del 98 % en peso de proteína, y
- está esencialmente exenta de impurezas estimulantes de los linfocitos T.
La proteína de choque térmico recombinante modificada se caracteriza por su actividad de ATPasa sin la adición de ninguna otra proteína chaperona. Un procedimiento de ensayo adecuado para la actividad de ATPasa se describe en los ejemplos.
Además, la preparación está exenta de impurezas estimulantes de los linfocitos T. Esto requiere un contenido en endotoxinas muy bajo. La preparación no muestra un efecto sobre los TH-1 (producción de interferón-y) ni los TH-2 (producción de IL-5 o de IL-13) . Esto se describe adicionalmente en los ejemplos.
La preparación está preferiblemente exenta de impurezas inmunoestimulantes, incluyendo impurezas estimulantes de los linfocitos T.
"Esencialmente exenta de impurezas inmunoestimulantes" significa:
- no se observa una proliferación de linfocitos T hasta 30 μg/ml -no se observa producción de TNF-α hasta 10 μg/ml.
La preparación DnaK recombinante purificada tiene:
a) una contaminación por ADN residual â 1 ng/mg de proteína b) una contaminación por proteínas residuales de la célula hospedadora (HCP) < 5 % en peso, y c) una contaminación por endotoxinas < 0, 5 U.E./μg de proteína.
La pureza de la DnaK purificada se calcula sobre una base de "peso por proteína", es decir, al menos el 98 % en peso de proteína.
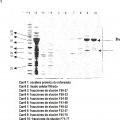
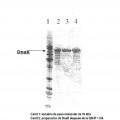
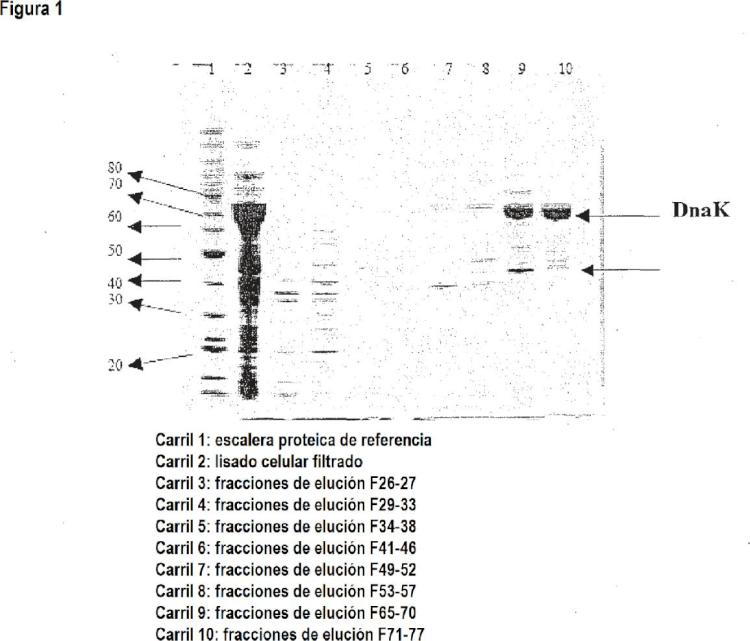
Preferiblemente, este valor se determina mediante el análisis de una SDS-PAGE en gel seguido de una tinción de coomassie y una densitometría.
El contenido en ADN es preferiblemente muy bajo, es decir â 1 ng/mg de proteína, preferiblemente â 0, 5 ng/mg de proteína. La contaminación por ADN se mide mediante el uso de una RT-PCR mediante el uso de cebadores específicos.
Las condiciones del ensayo dependen del tipo de sistema de expresión. Por ejemplo, para su expresión en E. coli, son adecuados los cebadores específicos del ADN 23S. Para P. pasteuris, los cebadores adecuados se eligen en el ADN 18S. Estos procedimientos son conocidos por una persona experta en la técnica.
Además, la contaminación por proteínas residuales de la célula hospedadora es < 5 % en peso, preferiblemente < 1 % en peso, más preferiblemente â 0, 0001 % en peso. Preferiblemente esto se determina en un ensayo de ELISA, disponible comercialmente en Cygnus Technologies Inc., Estados Unidos, con el nombre de producto "Kit E. coli host cell proteins", para medir las proteínas de las células de E. coli. El sistema de ensayo debe elegirse para que se corresponda con el sistema de expresión, es decir, Cygnus Technologies Inc. también ha desarrollado en los correspondientes ELISA para otros sistemas de expresión. Como alternativa, son adecuados otros procedimientos tales como una SDS-PAGE con tinción de plata, una HPLC o una inmunotransferencia Western.
La contaminación por endotoxinas es < 0, 5 U.E./μg de proteína según se muestra mediante el ensayo cinético de LAL, disponible comercialmente en Cambrex Corporation, Estados Unidos, con el nombre de producto "Kinetic-QCL®. Preferiblemente, el contenido es < 0, 1 U.E./μg de proteína, y preferiblemente < 0, 01 U.E./μg de proteína.
Ahora se ha comprendido por qué las DnaK pueden tener contaminaciones con impurezas inmunoestimulantes, especialmente
- proteínas,
- péptidos,
- ácidos nucleicos,
- lipopolisacáridos (LPS) .
La DnaK es una proteína chaperona y por lo tanto, se une a otras proteínas y péptidos.
Los procedimientos de purificación de la técnica anterior no eran obviamente capaces de eliminar ambas impurezas, las unidas y las no unidas, en las preparaciones de DnaK. Sorprendentemente, el procedimiento de purificación de la invención hace posible la obtención de una DnaK recombinante de elevada pureza, esencialmente exenta de impurezas inmunoestimulantes.
Para su uso en preparaciones farmacéuticas, especialmente como coadyuvante, es absolutamente necesario que la DnaK no contenga impurezas inmunoestimulantes.
Un aspecto adicional de la invención es un procedimiento para la purificación de una proteína de choque térmico
recombinante, preferiblemente la DnaK, a partir de un lisado celular, que comprende las etapas de a) cromatografía de intercambio iónico, b) cromatografía de hidroxilapatito, y c) cromatografía de gelatina.... [Seguir leyendo]
Reivindicaciones:
1. Preparación de DnaK purificada recombinante obtenible mediante un procedimiento que comprende las etapas de a) cromatografía de intercambio iónico, b) cromatografía de hidroxilapatito, y c) cromatografía de gelatina, en la que la preparación de la Dnak tiene:
- una actividad de ATPasa sin la adición de ninguna otra proteína chaperona, -una pureza del 98 % en peso de proteína, y -está esencialmente exenta de impurezas estimulantes de los linfocitos T.
2. La preparación de DnaK purificada recombinante de la reivindicación 1 con que tiene
- una contaminación por ADN residual â 1 ng/mg de proteína -una contaminación por proteínas residuales de la célula hospedadora (HCP) < 5 % en peso, y -una contaminación por endotoxinas < 0, 5 U.E./μg de proteína.
3. La preparación de DnaK recombinante de la reivindicación 1 o 2 en la que
- la contaminación por ADN residual es â 0, 5 ng/mg, y/o -la HCP es < 0, 1 % en peso, y/o -la contaminación por endotoxinas es â 0, 01 U.E./μg de proteína.
4. La preparación de DnaK recombinante de una cualquiera de las reivindicaciones 1 a 3, en la que la DnaK está hidrolizada.
5. La preparación de DnaK purificada recombinante de una cualquiera de las reivindicaciones 1 a 4, en la que la DnaK está
- en forma de un complejo con ADP, -en forma de un complejo con ATP, o -esencialmente exenta de nucleótidos.
6. Un procedimiento de purificación de una preparación de DnaK recombinante según se define en una de las reivindicaciones 1 a 5, a partir de un lisado celular, que comprende las etapas de
a) cromatografía de intercambio iónico, b) cromatografía de hidroxilapatito, y c) cromatografía de gelatina.
7. El procedimiento de la reivindicación 6 en el que la DnaK procede de bacterias saprófitas, preferiblemente de E. coli.
8. El procedimiento de una cualquiera de las reivindicaciones 6 a 7 en el que
- la cromatografía de intercambio iónico es una cromatografía de intercambio aniónico y/o -en el que la cromatografía de hidroxilapatito es una cromatografía de hidroxilapatito de tipo II.
9. El procedimiento de una cualquiera de las reivindicaciones 6 a 8 en el que la cromatografía de gelatina se lleva a cabo en sepharosa en gelatina.
10. Un procedimiento de formación de un complejo entre la DnaK recombinante y al menos un péptido o al menos una proteína que comprende las etapas de
a) combinar la DnaK recombinante de una cualquiera de las reivindicaciones 1 a 5 con ATP a una proporción molar HSP:ATP de 1:1 hasta 1:10; b) añadir al menos un péptido o al menos una proteína; y c) incubar a una temperatura de entre 10 º C y 60 º C, preferiblemente de entre 20 º C y 45 º C.
11. Una mezcla de DnaK recombinante según se define en las reivindicaciones 1 a 5 y al menos un péptido o al menos una proteína, preferiblemente en forma de un complejo.
12. La DnaK de una cualquiera de las reivindicaciones 1 a 5, o la mezcla o el complejo de la reivindicación 11, para su uso en diagnósticos in vivo.
13. Uso de la DnaK según se define en una de las reivindicaciones 1 a 5, o la mezcla o el complejo de la reivindicación 11, en diagnósticos in vitro.
14. La DnaK según se define en las reivindicaciones 1 a 5, o la mezcla o el complejo de la reivindicación 11, para su uso en la inducción de tolerancia, en el tratamiento o la prevención de alergia, de enfermedades autoinmunes, de rechazo de trasplantes o de enfermedades neurodegenerativas, o como un coadyuvante para inducir una respuesta humoral o una respuesta reguladora de los linfocitos T.
15. Un producto farmacéutico que comprende una preparación de DnaK purificada recombinante según se define en las reivindicaciones 1 a 5, o la mezcla o el complejo de la reivindicación 11.
Patentes similares o relacionadas:
Biomarcador de enfermedad autoinmunitaria, del 15 de Julio de 2020, de Tzartos, Socrates: Un método de diagnóstico o pronóstico de una enfermedad autoinmunitaria asociada con la formación de lesiones desmielinizadas del sistema nervioso central (SNC) […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Procedimientos y composiciones para el tratamiento de una afección genética, del 24 de Junio de 2020, de Sangamo Therapeutics, Inc: Una célula precursora de glóbulos rojos genomanipulada caracterizada por una modificación genómica dentro del exón 2 o el exón 4 de BCL11A o dentro de BCL11A-XL […]
Reactivos SIRP-alfa de alta afinidad, del 24 de Junio de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un polipéptido SIRPα de alta afinidad que comprende al menos una y no más de 15 modificaciones de aminoácidos dentro del dominio d1 de una secuencia SIRPα de tipo […]
Estructuras artificiales de poliepítopos para uso en inmunoterapia, del 17 de Junio de 2020, de Invectys: Un vector de expresión de ADN o una mezcla de vectores de expresión de ADN que codifica al menos dos epítopos de CD4 de la transcriptasa inversa de la telomerasa […]
Inmunoterapia WT1 para enfermedad angiogénica intraocular, del 17 de Junio de 2020, de INTERNATIONAL INSTITUTE OF CANCER IMMUNOLOGY, INC.: Una composición farmacéutica que comprende un péptido WT1 o péptido WT1 variante para su uso en el tratamiento y/o prevención de una enfermedad […]