Polipéptidos multímeros de HLA-G que incluyen al menos dos dominios alfa3 y usos farmacéuticos de los mismos.
Multímeros, caracterizados porque comprenden al menos dos monómeros,
estando cada uno de dichos monómeros seleccionado del grupo que consiste en un péptido P1 de fórmula X1-X2 en la que X1 representa un conector peptídico flexible que incluye un aminoácido de cisteína y X2 representa un dominio alfa3 de HLA-G.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2010/052917.
Solicitante: COMMISSARIAT A L'ENERGIE ATOMIQUE ET AUX ENERGIES ALTERNATIVES.
Nacionalidad solicitante: Francia.
Dirección: BATIMENT "LE PONANT D" 25, RUE LEBLANC 75015 PARIS FRANCIA.
Inventor/es: CAROSELLA, EDGARDO, DELFINO, LE MAOULT,JOËL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/47 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de mamíferos.
PDF original: ES-2515241_T3.pdf


Fragmento de la descripción:
Polipéptidos multímeros de HLA-G que incluyen al menos dos dominios alfa3 y usos farmacéuticos de los mismos La presente invención se refiere a polipéptidos multímeros y usos farmacéuticos de los mismos. La invención se refiere más específicamente a multímeros que comprenden dominios alfa3 de un antígeno HLA-G. La invención también se refiere a procedimientos de producción de tales multímeros, composiciones farmacéuticas que comprenden los mismos, además de a sus usos para tratar diversas enfermedades que incluyen rechazo de órgano/tejido.
Los antígenos del complejo mayor de histocompatibilidad (MHC) se dividen en tres clases principales, concretamente los antígenos de clase I, antígenos de clase II (HLA-DP, HLA-DQ y HLA-DR) y antígenos de clase III.
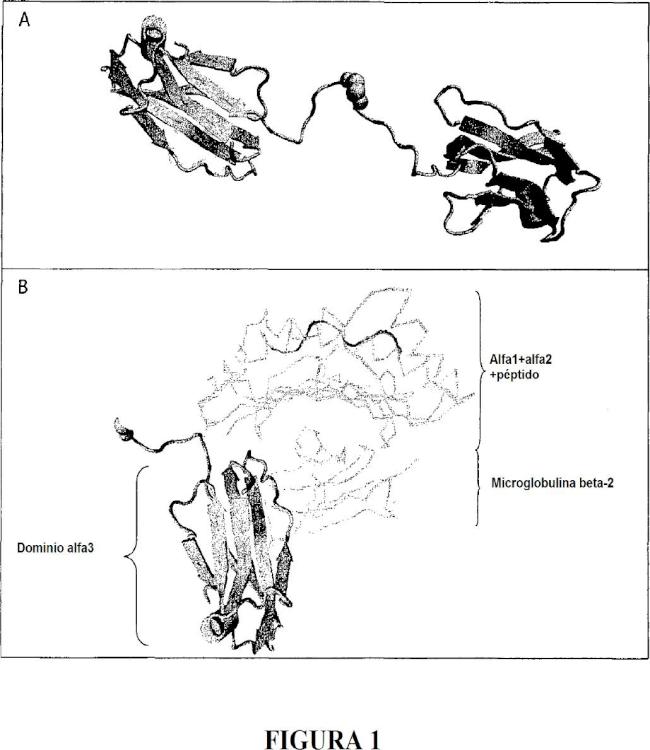
Los antígenos de clase I comprenden antígenos clásicos, HLA-A, HLA-B y HLA-C, que presentan 3 dominios globulares (α1, α2y α3) asociados a microglobulina beta2, además de antígenos no clásicos HLA-E, HLA-F y HLA-G.
HLA-G es una molécula de clase I de HLA no clásica expresada por trofoblastos extravellosos de placenta humana normal, células epiteliales tímicas y córnea. Los antígenos HLA-G se expresan esencialmente por las células citotrofoblásticas de la placenta y sirven de agentes inmunomoduladores que protegen el feto del sistema inmunitario materno (ausencia de rechazo por la madre) . Se ha descrito la secuencia del gen HLA-G [1, 2] y comprende 4396 pares de bases. Este gen está compuesto por 8 exones, 7 intrones y un extremo sin traducir de 3', correspondiente respectivamente a los siguientes dominios: exón 1: secuencia señal, exón 2: dominio extracelular alfa1, exón 3: dominio extracelular alfa2, exón 4: dominio extracelular alfa3, exón 5: región transmembrana, exón 6: dominio citoplásmico I, exón 7: dominio citoplásmico II (sin traducir) , exón 8: dominio citoplásmico III (sin traducir) y región sin traducir de 3'.
Se han identificado siete isoformas de HLA-G, entre las cuales 4 están unidas a la membrana (HLA-G1, HLA-G2, HLA-G3 y HLA-G4) y 3 son solubles (HLA-G5, HLA-G6 y HLA-G7) (véase [3] para revisión) .
La isoforma de la proteína HLA-G1 madura comprende los tres dominios externos (α1, α2y α3) , la región transmembrana y el dominio citoplásmico.
La isoforma de la proteína HLA-G2 no comprende el dominio α2, es decir, los dominios α1y α3 están directamente unidos, seguido del dominio transmembrana y el dominio citoplásmico.
La isoforma de la proteína HLA-G3 carece de tanto los dominios α2 como α3, es decir, comprende el dominio α1 directamente unido al dominio transmembrana y al dominio citoplásmico.
La isoforma de la proteína HLA-G4 carece del dominio α3, es decir, comprende el dominio α1, el dominio α2, el dominio transmembrana y el dominio citoplásmico.
Las isoformas de HLA-G soluble carecen todas de los dominios transmembrana y citoplásmicos. Más específicamente:
- La isoforma de la proteína HLA-G5 contiene los dominios α1, α2 y α3, además de una secuencia de péptidos del extremo C adicional de 21 residuos de aminoácidos codificada por el intrón 4 (como resultado de la retención del intrón 4 después del corte y empalme del transcrito y maduración de ARN) .
- La isoforma de la proteína HLA-G6 se corresponde con HLA-G5 sin α2, es decir, HLA-G6 contiene los dominios α1 y α3, además de una secuencia de péptidos del extremo C adicional de 21 residuos de aminoácidos codificada por el intrón 4 (como resultado de la retención del intrón 4 después del corte y empalme del transcrito y maduración de ARN) .
- La isoforma de la proteína HLA-G7 contiene solo el dominio alfa1, además de 2 residuos de aminoácidos del extremo C adicionales codificados por el intrón (como resultado de la retención del intrón 2 después del corte y empalme del transcrito y maduración de ARN) .
Todas estas isoformas se han descrito en [4, 5, 6] y la solicitud europea EP 0 677 582.
Estudios previos han mostrado que las proteínas HLA-G pueden inhibir respuestas alógenas tales como la respuesta de células de linfocitos T proliferativos, citólisis mediada por linfocitos T citotóxicos y citólisis mediada por células NK [7, 8, 9]. Más estudios recientes también han mostrado que HLA-G puede inducir la diferenciación de linfocitos T reguladores, que pueden entonces inhibir respuestas alógenas por sí mismos, y se sabe que participan en la tolerancia de aloinjertos [10, 11]. Debido a esta amplia función inhibidora, se ha mostrado que la expresión de HLA-G se correlaciona con una mejor aceptación de trasplantes alógenos, si HLA-G se expresa por el injerto o se detecta en el plasma de pacientes, como molécula soluble [12, 13, 14]. Como resultado, se han propuesto procedimientos basados en HLA-G para tratar rechazo de injerto en trasplante de órgano/tejido alógeno o xenógeno. También se han propuesto proteínas HLA-G para el tratamiento de cánceres (documento EP 1 054 688) , trastornos inflamatorios (documento EP 1 189 627) y, más generalmente, enfermedades inmunorrelacionadas. También se ha propuesto fusionar proteínas HLA
G con ligandos específicos con el fin de elegir como diana HLA-G para células o tejidos particulares (documento WO 2007/091078) . Debe observarse, sin embargo, que no se han proporcionado resultados o datos experimentales para mostrar que tales fusiones que eligen diana sean activas.
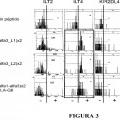
Se ha mostrado que HLA-G se une a tres receptores principales: ILT2/LILRB1/CD85j, ILT4/LILRB2/CD85d y KIR2DL4. ILT2 se expresa principalmente por linfocitos T, linfocitos B, células NK, monocitos y células dendríticas. ILT4 se expresa solo por células mieloides, es decir, principalmente monocitos y células dendríticas. KIR2DL4 se expresa principalmente por células NK deciduales y por un pequeño subconjunto de células NK periféricas. Debido a los amplios patrones de expresión de sus receptores inhibidores, HLA-G puede ejercer su función tolerogénica sobre todos los efectores de respuestas inmunitarias que son responsables de reacciones de inmunidad antiviral auto-inmunes, inmunidad antitumoral, enfermedades inflamatorias y rechazo de trasplantes.
KIR2DL4 es un receptor específico para HLA-G. KIR2DL4 se acopla sobre el dominio alfa1 de HLA-G, y más específicamente sobre los residuos Met76 y Gln79 que son característicos para HLA-G [15]. Se mostró adicionalmente que estos dos residuos son cruciales para la función inhibidora de HLA-G mediante KIR2DL4, y que mutándolos se previno la inhibición de la actividad citolítica de células NK que expresan KIR2DL4 por HLA-G in vitro. A pesar de su especificidad por HLA-G, KIR2DL4 probablemente no desempeña una función significativa en la función inhibidora de HLA-G, excepto en el contexto de embarazo, principalmente debido a su expresión que se limita a células NK deciduales, y debido a que in vitro e in vivo, se mostró que ILT desempeñó la función clave mediante la interacción con el dominio alfa3 de HLA-G. Es posible que el dominio alfa1 de HLA-G desempeñe una función directa en la función de HLA-G, mediante KIR2DL4 u otro receptor hasta ahora desconocido, pero las pruebas disponibles hasta la fecha señalan una función tolerogénica de HLA-G que está principalmente mediada, si no completamente, por la interacción de su dominio alfa3 con moléculas ILT2 y ILT4.
ILT2 e ILT4 no son receptores específicos para HLA-G, y se mostró que pueden unirse a otras moléculas de clase I de HLA mediante su dominio alfa3 [16, 17, 18]. Se ha descrito bien la capacidad del dominio de clase I de HLA para unirse a moléculas ILT. ILT2, en particular, se ha informado que se une “a la mayoría, si no a todas” de las moléculas de clase I de HLA.
Sin embargo, HLA-G es el ligando de mayor afinidad por ILT2 e ILT4, como se ilustra en la Tabla 1 de Shiroishi y col. [19].
Así, ILT2 y ILT4 se unen más fuertemente a HLA-G que a moléculas de clase I de HLA clásicas (véase [20, 21]) .
Esta capacidad de unión a ILT más fuerte de HLA-G en comparación con otras moléculas de clase I de HLA se ilustra particularmente bien por el hecho de que HLA-G en la superficie de células tumorales, pero no moléculas de clase I de HLA clásicas, puede cooperar con los receptores de ILT2 y/o ILT4 de efectores citolíticos con fuerza suficiente para bloquear la función de estos efectores y así proteger las células tumorales de la destrucción inmunitaria [22].
ILT2 e ILT4 no se unen a las mismas estructuras de HLA-G [21]. De hecho, ILT2 reconoce solo estructuras de HLA-G asociadas a β2 microglobulina (β2m) , mientras que ILT4 tiene... [Seguir leyendo]
Reivindicaciones:
1. Multímeros, caracterizados porque comprenden al menos dos monómeros, estando cada uno de dichos monómeros seleccionado del grupo que consiste en un péptido P1 de fórmula X1-X2 en la que X1 representa un conector peptídico flexible que incluye un aminoácido de cisteína y X2 representa un dominio alfa3 de HLA-G.
3. Multímeros según la reivindicación 1 o la reivindicación 2, caracterizados porque el conector peptídico flexible X1 comprende al menos 10-30 aminoácidos y hasta 100 aminoácidos e incluye una cisteína en su extremo N.
5. Multímeros según una cualquiera de las reivindicaciones 1 a 4, caracterizados porque dicho conector peptídico flexible comprende esencialmente residuos de aminoácidos de glicina y serina.
6. Multímeros según una cualquiera de las reivindicaciones 1 a 5, caracterizados porque el monómero de alfa3 es 15 proporcionado en SEC ID Nº : 3.
7. Multímero según una cualquiera de las reivindicaciones 1 a 6, caracterizado porque está en forma de un dímero de alfa3 que tiene dos monómeros de SEC ID Nº : 3 asociados juntos mediante un puente disulfuro entre residuos de cisteína presentes en el extremo N del conector X1.
8. Una composición farmacéutica que comprende un multímero según una cualquiera de las reivindicaciones 1 a 7 y al 20 menos un vehículo o soporte farmacéuticamente aceptable.
9. Los multímeros según una cualquiera de las reivindicaciones 1 a 7 o la composición farmacéutica según la reivindicación 8, para su uso en el tratamiento de rechazo de injerto.
10. Los multímeros según una cualquiera de las reivindicaciones 1 a 7 o la composición farmacéutica según la reivindicación 8 para su uso en el tratamiento de una enfermedad inflamatoria o una enfermedad autoinmune.
Patentes similares o relacionadas:
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Biomarcador de enfermedad autoinmunitaria, del 15 de Julio de 2020, de Tzartos, Socrates: Un método de diagnóstico o pronóstico de una enfermedad autoinmunitaria asociada con la formación de lesiones desmielinizadas del sistema nervioso central (SNC) […]
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Procedimientos y composiciones para el tratamiento de una afección genética, del 24 de Junio de 2020, de Sangamo Therapeutics, Inc: Una célula precursora de glóbulos rojos genomanipulada caracterizada por una modificación genómica dentro del exón 2 o el exón 4 de BCL11A o dentro de BCL11A-XL […]
Reactivos SIRP-alfa de alta afinidad, del 24 de Junio de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un polipéptido SIRPα de alta afinidad que comprende al menos una y no más de 15 modificaciones de aminoácidos dentro del dominio d1 de una secuencia SIRPα de tipo […]
Inmunoterapia WT1 para enfermedad angiogénica intraocular, del 17 de Junio de 2020, de INTERNATIONAL INSTITUTE OF CANCER IMMUNOLOGY, INC.: Una composición farmacéutica que comprende un péptido WT1 o péptido WT1 variante para su uso en el tratamiento y/o prevención de una enfermedad […]
Estructuras artificiales de poliepítopos para uso en inmunoterapia, del 17 de Junio de 2020, de Invectys: Un vector de expresión de ADN o una mezcla de vectores de expresión de ADN que codifica al menos dos epítopos de CD4 de la transcriptasa inversa de la telomerasa […]