Plásmido auto-supresor.
Un procedimiento de producción de un plásmido sin gen marcador de selección que comprende las etapas de:
a) cultivar un plásmido que contiene un gen marcador de selección flanqueado por sitios diana de recombinasa específica de sitio seleccionado de Ecdif, cer psi, pif y mwr en un primer entorno de célula huésped que es incapaz de efectuar la recombinación entre los sitios diana de recombinasa específica de sitio, en el que el primer entorno de célula huésped comprende una mutación inactivante en uno o más de los genes que codifican PepA, ArgR y ArcA; y
b) posteriormente cultivar el plásmido en un segundo entorno de célula huésped que puede efectuar la recombinación entre los sitios diana de recombinasa específica de sitio, de forma que el gen marcador de selección se escinde, en el que el segundo entorno de célula huésped contiene versiones activas de PepA y ArgR o ArcA, y comprende una recombinasa específica de sitio seleccionada de XerC y XerD.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2011/000975.
Solicitante: COBRA BIOLOGICS LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: Stephenson Building, Keele University Science Park Keele ST5 5SP REINO UNIDO.
Inventor/es: CRANENBURGH,ROCKY MARC, LECKENBY,MATTHEW WILLIAM.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N15/64 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Métodos generales para la preparación del vector, para su introducción en la célula o para la selección del huésped que contiene el vector.
PDF original: ES-2506466_T3.pdf
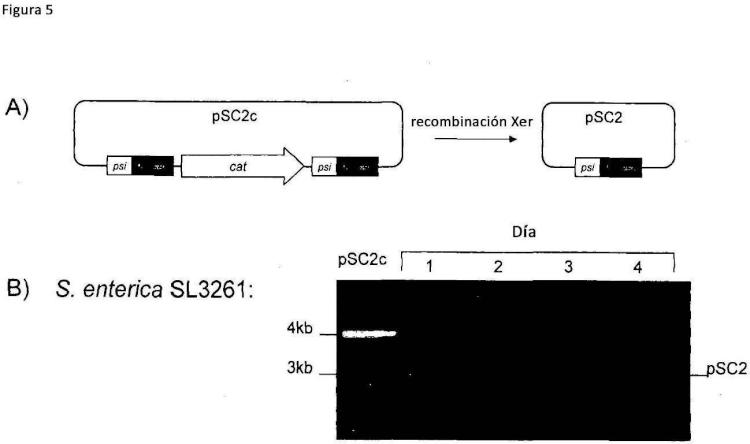
Fragmento de la descripción:
Plásmido auto-supresor Campo de la invención
La presente invención se refiere a procedimientos de producción de plásmidos sin gen marcador de selección. En particular, la invención se refiere a procedimientos de cultivo de un plásmido que contiene un gen marcador de selección en condiciones que permiten la selección basándose en la expresión del gen marcador de selección, y la posterior escisión del gen marcador de selección. La invención también se refiere a usos de los plásmidos producidos por un procedimiento tal para la producción de proteína recombinante para fines terapéuticos y de vacuna, producción de ADN terapéutico y vacunas de ADN y administración de protema recombinante y ADN a un paciente usando vectores bacterianos vivos.
Todos los documentos citados en el presente documento se incorporan por referencia.
Antecedentes de la invención
Los plásmidos son moléculas de ADN auto-replicantes que existen naturalmente en bacterias, arqueas y algunos eucariotas unicelulares, tales como levadura. En los últimos años se han convertido en esenciales para la industria de la biotecnología para la expresión de genes de proteína recombinante y como terapéuticos de ADN y vacunas. Para tales aplicaciones, los plásmidos que codifican genes de interés se modifican y replican generalmente en una célula huésped bacteriana tal como Escheríchia coli. Los plásmidos frecuentemente codifican un gen de resistencia a antibióticos para permitir que la selección de antibióticos se use para identificar las células que contienen el plásmido tras la transformación, con el antibiótico selectivo añadido al medio de crecimiento para destruir células que han perdido el plásmido.
Sin embargo, hay varias desventajas de usar antibióticos para la selección y mantenimiento de plásmidos. En primer lugar, la expresión constitutiva del gen de resistencia a antibióticos en la célula huésped produce una carga metabólica sobre la célula que reduce la viabilidad y aumenta la frecuencia de pérdida de plásmidos. En segundo lugar, los antibióticos representan un contaminante adicional en la fabricación, y la presión de selección se reduce por la degradación del antibiótico durante la fermentación. En tercer lugar, para terapéuticos de ADN y vacunas, el uso de genes de resistencia a antibióticos lleva el riesgo de transferencia a patógenos en el entorno, conduciendo a cepas patógenas resistentes a antibióticos. Esto es un riesgo elevado cuando se usan cepas bacterianas vivas como vectores para la administración de genes a un paciente. Hay, por tanto, un requisito de desarrollar un mecanismo de selección de plásmidos sin el uso de genes de resistencia a antibióticos.
Se han desarrollado tecnologías alternativas que requieren un gen marcador de selección expresado, tal como una copia funcional de un gen esencial que complementa una copia suprimida sobre el cromosoma del huésped. El gen timidilato sintasa thyA (McNeil y col., 2, Appl. Environ. Microbiol., 66: 1216-1219) o el gen asd que participa en la síntesis de ácido diaminopimélico (Degryse 1991, Mol. Gen. Genet. 227: 49-51) se han usado como genes selectivos sobre plásmidos en células en las que los genes cromosómico no son funcionales. Tanto este enfoque como la selección de antibióticos comparten el mismo inconveniente importante: la presencia y expresión de un gen marcador de selección que produce una carga metabólica significativa a la célula y hace la pérdida de plásmidos selectivamente ventajosa (Bentley y col., 199, Biotechnol. Bioeng. 35: 668-681).
Se han desarrollado dos tecnologías más que evitan el requisito de expresión del gen marcador de selección y, por tanto, conducen a una carga metabólica reducida sobre la célula. ORT (valoración de operador-represor) utiliza una célula bacteriana modificada en la que un gen cromosómico esencial se coloca bajo el control de un promotor inducible. Una proteína represora se une a secuencias de operador adyacentes a un promotor para prevenir la expresión del gen esencial, haciendo así que la célula muera a menos que esté presente un inductor. Cuando una célula bacteriana ORT se transforma con un plásmido de múltiples copias que contiene la secuencia del operador, el represor se valora por el plásmido y la expresión del gen esencial se activa, permitiendo así el crecimiento celular y, por tanto, la selección y mantenimiento de plásmidos (Cranenburgh y col., 21. Nucleic Acids Res. 29: e26).
El otro sistema sin gen marcador de selección, o/VSELECT, utiliza el origen de replicación pMB1 que se encuentra sobre la mayoría de los plásmidos usados en la investigación y desarrollo genético molecular. pMB1 orí produce naturalmente un ARN antisentido para regular su número de copias, y las células or/'SELECT se modifican de forma que este ARN interaccione con el ARNm de una secuencia codificante correspondiente manipulada en una fusión de genes con tanto un represor que regula un gen esencial como un gen de toxina, de forma que la presencia del plásmido se requiere para la supervivencia celular (Cranenburgh 25, documento W6/3412).
La desventaja de ambos de estos sistemas de expresión sin gen marcador de selección es que los cromosomas de las células microbianas necesitan estar genéticamente modificadas. Esto puede ser técnicamente exigente en muchas especies, e incluso en especies que son fácilmente susceptibles a manipulación genética requiere tiempo y es laborioso. Por tanto, sigue existiendo la necesidad de desarrollar un sistema de selección de plásmidos que esté
libre de genes marcadores de selección y que no requiera modificación genética de la célula huésped.
Descripción de la invención
Los inventores han desarrollado un sistema de producción de un plásmido sin gen marcador de selección. En el desarrollo de este sistema, los inventores han descubierto sorprendentemente que un plásmido sin gen marcador de selección puede mantenerse en una célula huésped sin un sistema de mantenimiento de plásmidos. Este hallazgo es inesperado, debido a que el experto habría esperado que un plásmido se hubiera perdido de una célula huésped en ausencia de un sistema de mantenimiento de plásmidos. Este sorprendente hallazgo es probable que sea debido a la gran disminución en la carga metabólica puesta en la célula tras la escisión del gen marcador de selección.
Por tanto, en un primer aspecto la invención se refiere a un procedimiento de producción de un plásmido sin gen marcador de selección que comprende las etapas de:
a) cultivar un plásmido que contiene un gen marcador de selección flanqueado por sitios diana de recombinasa específica de sitio en un primer entorno de célula huésped que es incapaz de efectuar la recombinación entre los sitios diana de recombinasa específica de sitio; y
b) posteriormente cultivar el plásmido en un segundo entorno de célula huésped que puede efectuar la recombinación entre los sitios diana de recombinasa específica de sitio, de forma que el gen marcador de selección se escinde.
Entorno de célula huésped
El término entorno de célula huésped engloba la propia célula huésped y las condiciones del entorno de célula huésped. Por tanto, el entorno de célula huésped se altera si el plásmido se mueve de una primera célula huésped a una segunda célula huésped o si las condiciones de la célula huésped se alteran. En el caso posterior, el primer y segundo entornos de células huésped están temporalmente separados. Las condiciones en una célula huésped se alteran generalmente alterando las condiciones en las que la célula se cultiva. Las condiciones que pueden alterarse incluyen, pero no se limitan a, osmolaridad, temperatura, presencia o ausencia de un inductor, la fase de crecimiento de la célula y la presencia de sustancias químicas que alteran la estructura secundaria del ADN o superenrollamiento.
Por tanto, en un segundo aspecto la invención se refiere a un procedimiento de producción de un plásmido sin gen marcador de selección que comprende las etapas de:
a) cultivar un plásmido que contiene un gen marcador de selección flanqueado por sitios diana de recombinasa específica de sitio en una primera célula huésped que es incapaz de efectuar la recombinación entre los sitios diana de recombinasa específica de sitio; y
b) posteriormente cultivar el plásmido en una segunda célula huésped que puede efectuar la recombinación entre los sitios diana de recombinasa específica de sitio, de forma que el gen marcador de selección se escinde.
En un tercer aspecto la invención se refiere a un procedimiento de producción de un plásmido sin gen marcador de selección que comprende las etapas de:
... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento de producción de un plásmido sin gen marcador de selección que comprende las etapas de:
a) cultivar un plásmido que contiene un gen marcador de selección flanqueado por sitios diana de recombinasa específica de sitio seleccionado de Ecdif, cer psi, pif y mwr en un primer entorno de célula huésped que es incapaz de efectuar la recombinación entre los sitios diana de recombinasa específica de sitio, en el que el primer entorno de célula huésped comprende una mutación inactivante en uno o más de los genes que codifican PepA, ArgR y ArcA; y
b) posteriormente cultivar el plásmido en un segundo entorno de célula huésped que puede efectuar la recombinación entre los sitios diana de recombinasa específica de sitio, de forma que el gen marcador de selección se escinde, en el que el segundo entorno de célula huésped contiene versiones activas de PepA y ArgR o ArcA, y comprende una recombinasa específica de sitio seleccionada de XerC y XerD.
2. El procedimiento de la reivindicación 1 que comprende además la etapa de:
c) mantener el plásmido sin gen marcador de selección en cultivo celular.
3. El procedimiento de la reivindicación 1 o la reivindicación 2 que comprende además la etapa de:
d) aislar el plásmido sin gen marcador de selección del segundo entorno de célula huésped.
4. El procedimiento de una cualquiera de las reivindicaciones precedentes, en el que el primer entorno de célula huésped y el segundo entorno de célula huésped están dentro de diferentes células.
5. El procedimiento de una cualquiera de las reivindicaciones 1-3, en el que el primer entorno de célula huésped y el segundo entorno de célula huésped se forman dentro de la misma célula huésped.
6. El procedimiento de la reivindicación 5, en el que el primer entorno de célula huésped y el segundo entorno de célula huésped están temporalmente separados.
7. El procedimiento de una cualquiera de las reivindicaciones precedentes, en el que el gen marcador de selección es un gen de resistencia a antibióticos.
8. El procedimiento de una cualquiera de las reivindicaciones 1-6, en el que el gen marcador de selección permite la producción de un metabolito esencial, pero ausente, del primer y/o el segundo entorno de célula huésped.
9. El procedimiento según una cualquiera de las reivindicaciones precedentes, en el que el primer entorno de célula huésped y/o el segundo entorno de célula huésped es una célula bacteriana Gram-negativa.
1. El procedimiento según la reivindicación 9, en el que el primer entorno de célula huésped y el segundo entorno de célula huésped están seleccionados independientemente de los géneros Escherichia, Salmonella, Shigella, Agrobacterium, Pseudomonas y Vibrio.
11. El procedimiento de una cualquiera de las reivindicaciones precedentes, en el que el plásmido codifica uno o más genes de interés.
Patentes similares o relacionadas:
Métodos y composiciones para modificar un locus objetivo, del 12 de Febrero de 2020, de REGENERON PHARMACEUTICALS, INC.: Un método para la modificación en serie de un locus objetivo en una célula, que comprende: (a) proporcionar la célula que comprende el locus objetivo, en donde el locus objetivo […]
Uso combinado de un vector que codifica un receptor modificado y su agonista exógeno en el tratamiento de convulsiones, del 22 de Enero de 2020, de UCL Business Ltd: Un vector que codifica un receptor modificado, y un agonista exógeno para dicho receptor, para su uso en un método de tratamiento de un trastorno convulsivo […]
Montaje de ADN mediado por nucleasas, del 8 de Enero de 2020, de REGENERON PHARMACEUTICALS, INC.: Un método in vitro para ensamblar en forma continua dos o más ácidos nucleicos de doble cadena, que comprende: (a) poner en contacto un primer […]
Métodos para inducir la capacidad de respuesta a un agente antiangiogénico, del 25 de Diciembre de 2019, de VASCULAR BIOGENICS LTD: Un vector que comprende la secuencia de nucleótidos indicada en SEQ ID NO:19 para su uso para tratar un tumor en un sujeto que lo necesita en combinación […]
Escisión e inserción de genes grandes, del 4 de Septiembre de 2019, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Procedimiento para alterar un ácido nucleico diana en una célula que comprende introducir en la célula uno o varios primeros ácidos nucleicos externos que codifican dos o más […]
Sistema de expresión y secreción, del 26 de Junio de 2019, de F. HOFFMANN-LA ROCHE AG: Una molécula de ácido nucleico que codifica un primer polipéptido y un segundo polipéptido, enlazada de forma funcional a una secuencia señal que codifica […]
Secuencias de serotipo 8 de virus adeno-asociado (AAV), vectores que las contienen y usos de las mismas, del 20 de Junio de 2019, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una molécula de ácido nucleico recombinante: (a) que codifica una proteína de la cápside vp1 de AAV8 que tiene una secuencia que comprende los aminoácidos 1 a 738 de la […]
Silenciamiento génico y supresión del silenciamiento génico simultáneos en la misma célula, del 5 de Junio de 2019, de COMMONWEALTH SCIENTIFIC AND INDUSTRIAL RESEARCH ORGANISATION: Una célula eucariota que comprende, i) un primer polinucleótido de interés que codifica un ARN diana, ii) un primer polinucleótido exógeno que codifica […]