Proceso enantioselectivo para preparar un ácido alcanoico sustituido.
Proceso para preparar un compuesto de Fórmula (Ia) y productos intermedios del mismo:
**Fórmula**
que comprende las etapas de:
Etapa 1. Hacer reaccionar un Compuesto C1 con una primera fuente de hidrógeno, un primer complejo de ligando-metal que consiste esencialmente en un primer ligando conjugado con un primer aducto metálico, en un primer disolvente en presencia de un primer aditivo opcional a una primera temperatura elevada y a una primera presión elevada para proporcionar un Compuesto C3 sustancialmente puro:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/012294.
Solicitante: JANSSEN PHARMACEUTICA N.V..
Nacionalidad solicitante: Bélgica.
Dirección: TURNHOUTSEWEG 30 2340 BEERSE BELGICA.
Inventor/es: MARYANOFF, BRUCE, E., KINNEY, WILLIAM A., TELEHA, CHRISTOPHER, A., GHOSH,Shyamali.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D211/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › Compuestos heterocíclicos que contienen ciclos hidrogenados de piridina, no condensados con otros ciclos.
PDF original: ES-2474165_T3.pdf
Fragmento de la descripción:
Proceso enantioselectivo para preparar un ïcido alcanoico sustituido.
CAMPO DE LA INVENCIïN
La presente invenciïn se refiere a un proceso para la preparaciïn enantioselectiva de un compuesto antagonista de integrina de ïcido alcanoico sustituido. Mïs concretamente, el proceso se refiere a una sïntesis enantioselectiva de un antagonista dual de integrina αVï3/αVβ5 de ïcido alcanoico piperidina sustituido.
ANTECEDENTES DE LA INVENCIïN
La importancia de una sïntesis econïmicamente viable de molïculas quirales de un solo enantiïmero estï bien establecida y comprendida. En ningïn sector resulta esto mïs evidente que en la industria farmacïutica, en la que un enantiïmero de una molïcula quiral farmacolïgica puede presentar mejores (o diferentes) propiedades terapïuticas frente a otro enantiïmero.
Si bien en muchos casos la resoluciïn quiral sigue siendo a menudo el mïtodo de elecciïn para la producciïn a gran escala, la hidrogenaciïn asimïtrica sigue siendo la alternativa catalïtica mïs extendida debido a los beneficios econïmicos y ambientales frente a las tecnologïas de resoluciïn mïs antiguas en las que el enantiïmero no deseado debe reciclarse o eliminarse.
Sin embargo, a pesar de las ventajas inherentes del uso de la catïlisis asimïtrica para producir molïculas de un solo enantiïmero, el proceso no es fïcilmente aplicable a escala industrial debido a diversos factores tales como la fïcil disponibilidad del catalizador quiral para el pïblico o el uso autorizado en la cantidad necesaria a un precio asequible, la presencia de impurezas en el catalizador, que pueden inhibir la eficacia del propio catalizador o quedar incorporadas en el producto final donde son difïciles de eliminar y que no existe una ïnica familia de ligandos, y mucho menos un miembro individual de una familia, que conduzca a una alta selectividad enantiomïrica con todos los sustratos.
Por otra parte, no existe una metodologïa general, aunque se han descrito ampliamente reducciones de hidrogenaciïn asimïtrica estereoselectiva de diversos sustratos (Ohta T, Miyake T, Seido N, Kumabayashi H y Takaya H, J. Org. Chem. 1995, 60, 357; Dobbs DA, Vanhessche KPM, Brazi E, Rautenstrauch V, Lenoir J-Y, Genet J-P, Wiles J, y Bergens SH, Angew. Chem., Int. Ed. Engl. 2000, 39, 1992; Menges F y Pfaltz A, Adv. Synth. Catal. 2002, 344, 40; Tang W y Zhang X, Chem. Rev. 2003, 103, 3029; Ohta T, Takaya H, Kitamura M, Nagai K y Noyori R,
J. Org. Chem. 1987, 52, 3174; Liqin Q, Li Y. M, Kwong FY, Yu W-Y, Fan Q-H y Chan ASC, Adv. Synth. Catal. 2007, 349, 517; Hayashi T, Kawamura N e Ito Y, J. Am. Chem. Soc. 1987, 109, 7876; Uemura T, Zhang X, Matsumura K, Sayo N, Kumobayashi H, Ohta T, Nozaki K y Takaya H, J. Org. Chem. 1996, 61, 5510; Tellers DM, McWilliams JC, Humphrey G, Journet M, DiMichele L, Hinksmon J, McKeown AE, Rosner T, Sun Y, y Tillyer RD, J. Am. Chem. Soc. 2006, 128, 17063; Cossy J y Belotti D, Biorg. Med. Chem. Lett 2001, 11, 1989; Blaser HU, Malan C, Pugin B, Steiner H, Spindler F y Studer M, Adv. Synth. Catal. A 2003, 345, 103 y las referencias en los mismos; Romero DL, Manninen PR, Han F y Romero AG, J. Org. Chem. 1999, 64, 4980-4985; patente de Estados Unidos 6.465.664; y, patente de EE.UU. 6.787.655. Sigue existiendo la necesidad de un proceso de hidrogenaciïn enantiomïricamente eficaz y diastereomïricamente selectivo para un antagonista de integrina quiral con una mïxima conversiïn a producto, que tenga el mayor exceso enantiomïrico y diastereomïrico del isïmero deseado.
RESUMEN DE LA INVENCIïN
La presente invenciïn se refiere a un proceso de hidrogenaciïn asimïtrica para preparar un compuesto de Fïrmula (I) y productos intermedios del mismo:
en la que R2, W, Z y q son tal como se definen en el presente documento, en el que α representa un ïtomo de cadena de carbono quiral y, en la que β representa un ïtomo miembro del anillo de carbono quiral.
Se describieron diversos antagonistas duales de integrina αVï3/αVβ5 de ïcido alcanoico de Fïrmula (III) y Fïrmula (IV) :
en De Corte BL, Kinney WA, Liu L, Ghosh S, l Brunner, Hoekstra WJ, Santulli RJ, Tuman RW, Baker J, Bums C, Proost JC, Tounge BA, Damiano BP, Mar y anoff BE, Johnson DL y Galemmo RA Jr., Bioorg. Med. Chem. Lett, 2004, 14, 5227; y se describen en las publicaciones de patente de Estados Unidos US2004/0077684 y US2004/0224986, citados en las mismas como compuesto de Fïrmula (I) y Fïrmula (II) , cada uno de los cuales se incorpora en el presente documento por referencia en su totalidad y a todos los efectos.
Ademïs, en la publicaciïn de patente de Estados Unidos US2004/0077684 y en la publicaciïn de patente de EE.UU. US2004/0224986 se describen compuestos estereoisïmeros y racïmicos de Fïrmula (III) y Fïrmula (IV) . Tales compuestos pueden prepararse de forma asimïtrica utilizando el presente proceso para proporcionar compuestos estereoisïmeros representativos de los compuestos de Fïrmula (I) y Fïrmula (II) de la presente invenciïn.
La presente invenciïn se refiere a un proceso de hidrogenaciïn asimïtrica para preparar un compuesto de Fïrmula (Ia) y productos intermedios del mismo:
y se denomina en el presente documento ïcido (3S, 3'S) -4-[1- (3-5, 6, 7, 8-tetrahidro-[1, 8]naftiridin-2-il-propionil) piperidin-4-il]-3- (1, 2, 3, 4-tetrahidro-quinolin-3-il) -butïrico.
El compuesto de Fïrmula (Ia) se ha descrito en la publicaciïn de patente de Estados Unidos US2004/0077684, en la publicaciïn de patente de EE.UU. US2004/0224986 (CIP de US2004/0077684) y en la solicitud de patente de EE.UU. 11/897484 (continuaciïn de US2004/0224986) , que se incorporan en el presente documento por referencia en su totalidad y a todos los efectos. El compuesto de Fïrmula (Ia) se denominï en las mimas isïmero Compuesto 19-4 del ïcido 1, 2, 3, 4-tetrahidro-β-[[1-[1-oxo-3- (5, 6, 7, 8-tetrahidro-1, 8-naftiridin-2il) propil]-4-piperidinil]metil]-3-quinolinpropanoico. El compuesto de Fïrmula (Ia) se sintetizï como se describe en el Esquema E (de manera alternativa, como en el Esquema F) y el Ejemplo 15 del mismo.
El proceso de la presente invenciïn es una hidrogenaciïn enantiomïrica y diastereomïrica eficaz y estereoselectiva que mejora la conversiïn y el exceso enantiomïrico del producto deseado mediante condiciones de reacciïn optimizadas para el compuesto de Fïrmula (Ia) y productos intermedios del mismo, mejorando el control de la formaciïn de isïmeros geomïtricos mediante la reducciïn de la olefina estereoselectiva y evitando sustancialmente la separaciïn de isïmeros utilizando la cromatografïa en columna quiral secuencial.
El proceso de la presente invenciïn proporciona un exceso diastereomïrico y enantiomïrico y una conversiïn mejorados de un enantiïmero deseado de un compuesto de Fïrmula (Ia) y productos intermedios del mismo.
DESCRIPCIïN DETALLADA DE LA INVENCIïN
Tambiïn se describe en el presente documento, como se muestra en el Esquema A, un proceso para preparar un compuesto de Fïrmula (I) y Fïrmula (II) :
en las que α representa un ïtomo de cadena de carbono quiral; W estï seleccionado del grupo que consiste en -alquilo C0-6 (R1) , -alquilo C1-6 (R1a) , -alquilo C0-6-arilo (R1, R8) , -alquilo C0-6-heterociclilo (R1, R8) , -alcoxi C0-6 (R1) , -alcoxi C0-6-arilo (R1, R8) y -alcoxi C0-6-heterociclilo (R1, R8) , R1 estï seleccionado del grupo que consiste en hidrïgeno, -N (R4) 2, -N (R4) (R5) , -N (R4) (R6) , -heterociclilo (R8) y -heteroarilo (R8) ; R1a estï seleccionado del grupo que consiste en -C (R4) (=N-R4) , -C (=N-R4) -N (R4) 2, -C (=N-R4) -N (R4) (R6) , -C (=NR4) -N (R4) -C (=O) -R4, -C (=N-R4) -N (R4) -C (=O) -N (R4) 2, -C (=N-R4) -N (R4) -CO2-R4, -C (=NR4) -N (R4) -SO2-alquilo C1-8 (R7) y -C (=N-R4) -N (R4) -SO2-N (R4) 2; R4 estï seleccionado del grupo que consiste en hidrïgeno y -alquilo C1-8 (R7) ; R5 estï seleccionado del grupo que consiste en -C (=O) -R4, -C (=O) -N (R4) 2, -C (=O) -cicloalquilo (R8) , -C (=O) -heterociclilo (R8) , -C (=O) -arilo (R8) , -C (=O) -heteroarilo (R8) , -C (=O) -N (R4) -cicloalquilo (R8) , -C (=O) -N (R4) -arilo (R8) , -CO2-R4, -CO2-cicloalquilo (R8) , -CO2-arilo (R8) , -C (R4) (=N-R4) , -C (=N-R4) -N (R4) 2, -C (=N-R4) -N (R4) (R6) , -C (=NR4) -N (R4) -C (=O) -R4, -C (=N-R4) -N (R4) -C (=O) -N (R4) 2, -C (=N-R4) -N (R4) -CO2-R4, -C (=NR4) -N (R4) -SO2-alquilo C1-8 (R7) , -C (=N-R4) -N (R4) -SO2-N (R4) 2, -N (R4) -C (R4) (=N-R4) , -N (R4) -C (=N-R4) -N (R4) 2, -N (R4) -C (=N-R4) -N (R4) (R6) , -N (R4) -C (=N-R4) -N (R4) -C (=O) -R4, -N (R4) -C (=N-R4) -N (R4) -C (=O) -N (R4) 2, -N (R4) -C (=N-R4) -N (R4) -CO2-R4, -N (R4) -C (=N-R4) -N (R4) -SO2-alquilo C1-8 (R7) , -N (R4) -C (=N-R4) -N (R4) -SO2-N (R4) 2, -SO2-alquilo... [Seguir leyendo]
Reivindicaciones:
1. Proceso para preparar un compuesto de Fïrmula (Ia) y productos intermedios del mismo:
que comprende las etapas de:
Etapa 1. Hacer reaccionar un Compuesto C1 con una primera fuente de hidrïgeno, un primer complejo de ligando-metal que consiste esencialmente en un primer ligando conjugado con un primer aducto metïlico, en un primer disolvente en presencia de un primer aditivo opcional a una primera temperatura elevada y a una primera presiïn elevada para proporcionar un Compuesto C3 sustancialmente puro:
en el que la primera fuente de hidrïgeno estï seleccionada de entre hidrïgeno gaseoso o un exceso de ïcido fïrmico, el primer ligando estï seleccionado del grupo que consiste en (R) -PhanePhos, (S) -PhanePhos, (R) -An-PhanePhos, (S) -An-PhanePhos, (R) -Xyl-PhanePhos, (S) -Xyl-PhanePhos, (R) -MeOXyl-PhanePhos, (S) -MeOXyl-PhanePhos, (R) -iPr-PhanePhos, (S) -iPr-PhanePhos, (R, R) -Me-DuPhos, (S, S) -Me-DuPhos, (R) -P-Phos, (S) -P-Phos, (R) -Xyl-P-Phos, (S) -Xyl-P-Phos, (R) -Ph-PHOX, (S) -Ph-PHOX, (R) -iPr-PHOX, (S) -iPr-PHOX, (R) -Me-BoPhoz, (S) -Me-BoPhoz, CF3Ph- (R) -Me-BoPhoz, CF3Ph- (S) -Me-BoPhoz, (R) -fenetil- (R) -Me-BoPhoz, (R) -fenetil (S) -Me-BoPhoz, 3, 4-diCl-Ph- (R) -Me-BoPhoz, 3, 4-diCl-Ph- (S) -Me-BoPhoz, Xyl- (R) -Me-BoPhoz, Xyl- (S) -Me-BoPhoz, (R) -Binol- (R) -Me-BoPhoz, (R) -Binol- (S) -Me-BoPhoz, (S) -Binol- (S) -Me-BoPhoz, (S) -Binol- (R) -Me-BoPhoz, PCy- (R) -Me-BoPhoz, PCy- (S) -Me-BoPhoz, (R) -iPr-BoPhoz, (S) -iPr-BoPhoz, (R) -fenetil- (S) -BoPhoz, (R) fenetil- (R) -BoPhoz, (S) -fenetil- (R) -BoPhoz, (S) -fenetil- (S) -BoPhoz, (R) -Ph-BoPhoz, (S) -Ph-BoPhoz, (R) -Bn-BoPhoz y (S) -Bn-BoPhoz, el primer aducto metïlico estï seleccionado del grupo que consiste en [Rh (COD) 2]BF4, [Rh (COD) 2]OTf, [Rh (etileno) 2Cl]2, [Rh (etileno) 2 (acac) ], [Rh (CO) 2 (acac) ], [Rh (COD) (acac) ], [Ru (COD) (CF3COO) 2]2, [Ru (COD) (metilalilo) 2], [Ru (benceno) Cl2]2, [Ru (p-cimeno) Cl2]2, [Ir (COD) Cl]2, [Ir (COD) 2]BF4 e [Ir (COD) 2]BArF, el primer disolvente estï seleccionado del grupo que consiste en MeOH, EtOH, IPA, DCE, THF, tolueno, EtOAc, DMF y mezclas de los mismos, el primer aditivo opcional estï seleccionado del grupo que consiste en AcOH, Et3N, HBF4, eterato de HBF4, HCl, eterato de HCl, CF3COOH, CH3COOH y TsOH, y, cuando estï presente, se encuentra en una cantidad de hasta aproximadamente 1, 2 Eq., la primera temperatura se encuentra en un intervalo comprendido entre aproximadamente 25ïC y aproximadamente 70ïC, y la primera presiïn se encuentra en un intervalo comprendido entre aproximadamente 3 bar y aproximadamente 30 bar; Etapa 2. Hacer reaccionar Compuesto C3 con una segunda fuente de hidrïgeno y un agente de hidrogenaciïn en un segundo disolvente en presencia de un segundo aditivo opcional a una segunda temperatura elevada y a una segunda presiïn elevada para proporcionar una mezcla isomïrica de un Compuesto C4 y Compuesto C5:
en el que la segunda fuente de hidrïgeno es hidrïgeno gaseoso, el agente de hidrogenaciïn estï seleccionado de entre Pd/C al 10% o un segundo complejo de ligando-metal, en el que el segundo complejo de ligando-metal consiste esencialmente en un segundo ligando y un aducto metïlico [Ir (COD) Cl]2 combinado con yodo en una cantidad de hasta aproximadamente 0, 1 Eq., en el que el Pd/C al 10% estï presente en un intervalo de porcentaje en peso comprendido entre aproximadamente un 5% (p/p) y aproximadamente un 20% (p/p) , y en el que el segundo ligando estï seleccionado del grupo que consiste en (R) -P-Phos, (S) -P-Phos, (R) -Xyl-P- Phos, (S) -Xyl-P-Phos, (S) -Tol-P-Phos, (R) -Me-BoPhoz, (S) -Me-BoPhoz, (R) -Xyl-Binap y (S) -Xyl-Binap, el segundo disolvente estï seleccionado del grupo que consiste en MeOH, DCE, EtOH, IPA, THF, tolueno, EtOAc y MTBE y mezclas de los mismos, el segundo aditivo opcional estï seleccionado del grupo que consiste en Et3N, iPr2-NH, Cy2NH, (R) -Ph-etil-NH2, (S) -Ph-etil-NH2, KI, KOH, K2CO3, ïcido (R/S) -canforsulfïnico y CH3COOH, y, cuando estï presente, se encuentra en una cantidad de hasta aproximadamente 1, 2 Eq., la segunda temperatura se encuentra en un intervalo comprendido entre aproximadamente 40ïC y aproximadamente 60ïC, y la segunda presiïn se encuentra en un intervalo comprendido entre aproximadamente 3 bar y aproximadamente 25 bar, o se encuentra en un intervalo comprendido entre aproximadamente 10 bar y aproximadamente 25 bar, o se encuentra en un intervalo comprendido entre aproximadamente 3 bar y aproximadamente 10 bar; Etapa 3. Separar el Compuesto C4 y el Compuesto C5 a partir de la mezcla isomïrica; Etapa 4. Deshidrogenar opcionalmente el Compuesto C5 a Compuesto C3, y a continuaciïn repetir la Etapa 2 utilizando dicho Compuesto C3 deshidrogenado como material de partida; Etapa 5. Desproteger el Compuesto C4 para proporcionar un Compuesto C6:
Etapa 6. Hacer reaccionar Compuesto C6 con un Compuesto C7 para proporcionar un Compuesto C8:
y
Etapa 7. Convertir el Compuesto C8 en el compuesto de Fïrmula (Ia) .
2. Proceso para preparar un Compuesto C2 sustancialmente puro que comprende la etapa de: hacer reaccionar un Compuesto C1 con una primera fuente de hidrïgeno, un primer complejo de ligando-metal que consiste esencialmente en un primer ligando conjugado con un primer aducto metïlico, en un primer disolvente en presencia de un primer aditivo opcional a una primera temperatura elevada y a una primera presiïn elevada para proporcionar un Compuesto C2 sustancialmente puro.
en el que el primer ligando estï seleccionado del grupo que consiste en (R) -PhanePhos, (S) -PhanePhos, (R) -An-PhanePhos, (S) -An-PhanePhos, (R) -Xyl-PhanePhos, (S) -Xyl-PhanePhos, (R) -MeOXyl-PhanePhos, (S) -MeOXyl-PhanePhos, (R) -iPr-PhanePhos, (S) -iPr-PhanePhos, (R, R) -Me-DuPhos, (S, S) -Me-DuPhos, (R) -P-Phos, (S) -P-Phos, (R) -Xyl-P-Phos, (S) -Xyl-P-Phos, (R) -Ph-PHOX, (S) -Ph-PHOX, (R) -iPr-PHOX, (S) -iPr-PHOX, (R) -Me-BoPhoz, (S) -MeBo-Phoz, CF3Ph- (R) -Me-BoPhoz, CF3Ph- (S) -Me-BoPhoz, (R) -fenetil- (S) -Me-BoPhoz, 3, 4-diCl-Ph- (R) -Me-Bo-Phoz, 3, 4-diCl-Ph- (S) -Me-BoPhoz, Xyl- (R) -Me-BoPhoz, Xyl- (S) -Me-BoPhoz, (R) -Binol- (R) -Me-BoPhoz, (R) -Binol- (S) -Me-BoPhoz, (S) -Binol- (S) -Me-BoPhoz, (S) -Binol- (R) -Me-BoPhoz, PCy- (R) -Me-BoPhoz, PCy- (S) -Me-Bo-Phoz, (R) -iPr-BoPhoz, (S) -iPr-BoPhoz, (R) -Et-BoPhoz, (S) -Et-BoPhoz, (R) -fenetil- (S) -BoPhoz, (R) -fenetil- (R) -BoPhoz, (S) -fenetil (R) -BoPhoz, (S) -fenetil- (S) -BoPhoz, (R) -Ph-BoPhoz, (S) -Ph-BoPhoz, (R) -Bn-BoPhoz y (S) -Bn-BoPhoz, el primer aducto metïlico estï seleccionado del grupo que consiste en [Ir (COD) 2]BArF, [Ir (COD) 2]BF4, [Ir (COD) Cl]2, [Rh (etileno) 2Cl]2, [Rh (etileno) 2 (acac) ], [Rh (COD) Cl]2 y [Rh (COD) (acac) ], el primer disolvente estï seleccionado del grupo que consiste en MeOH, DCE, EtOH, IPA, THF, tolueno, EtOAc, DMF, y mezclas de los mismos, el primer aditivo opcional estï seleccionado del grupo que consiste en Et3N, HBF4, CH3COOH y TsOH, y, cuando estï presente, se encuentra en una cantidad de hasta aproximadamente 1, 2 Eq., la primera temperatura se encuentra en un intervalo comprendido entre aproximadamente 50ïC y aproximadamente 70ïC, y la primera presiïn se encuentra en un intervalo comprendido entre aproximadamente 10 bar y aproximadamente 30 bar.
3. Proceso en el que se lleva adelante Compuesto C2 tal como se define en la reivindicaciïn 2 en lugar de Compuesto C3 en las etapas 2 a 7 de la reivindicaciïn 1 para proporcionar un isïmero (αR, βR) y un isïmero (αR, βS) de Fïrmula (Ia) .
4. Proceso segïn la reivindicaciïn 1, en el que la primera fuente de hidrïgeno es hidrïgeno gaseoso; el primer complejo de ligando-metal es (R) -Me-BoPhoz&[Ir (COD) Cl]2; el primer disolvente es DCE; la primera temperatura es aproximadamente 70ïC; la primera presiïn es aproximadamente 25 bar; la segunda fuente de hidrïgeno es hidrïgeno gaseoso; y el agente de hidrogenaciïn estï seleccionado de entre Pd/C al 10% o un segundo complejo de ligando-metal, en el que, cuando el agente de hidrogenaciïn es un segundo complejo de ligando-metal seleccionado de (R) -Me-Bo-Phoz&[Ir (COD) Cl]2 combinado con yodo en una cantidad de aproximadamente 0, 1 Eq., entonces el segundo disolvente es EtOAc; la segunda temperatura es aproximadamente 50ïC; y la segunda presiïn es aproximadamente 25 bar; y, en el que, cuando el agente de hidrogenaciïn estï seleccionado de Pd/C al 10% en una cantidad de aproximadamente un 10% (p/p) ; el segundo disolvente es IPA; el segundo aditivo opcional es Et3N en una cantidad de aproximadamente 0, 75 Eq.; la segunda temperatura es aproximadamente 40ïC; y la segunda presiïn es aproximadamente 10 bar.
5. Proceso para preparar un compuesto de Fïrmula (Ia) y productos intermedios del mismo, que comprende las etapas:
Etapa 1. Hacer reaccionar Compuesto D1 con una primera fuente de hidrïgeno, un primer complejo de ligando-metal que consiste esencialmente en un primer ligando conjugado con un primer aducto metïlico, en un primer disolvente en presencia de un primer aditivo opcional a una primera temperatura elevada y a una primera presiïn elevada para proporcionar un Compuesto D3 sustancialmente puro:
en el que la primera fuente de hidrïgeno estï seleccionada de entre hidrïgeno gaseoso o un exceso de ïcido fïrmico, el primer ligando estï seleccionado del grupo que consiste en (R) -Xyl-PhanePhos, (S) -Xyl-PhanePhos, (R) - PhanePhos, (S) -PhanePhos, (R) -An-PhanePhos, (S) -An-PhanePhos, (R) -MeOXyl-PhanePhos, (S) -MeOXyl- PhanePhos, PCy- (R) -Me-BoPhoz y PCy- (S) -Me-BoPhoz, el primer aducto metïlico estï seleccionado del grupo que consiste en [Rh (COD) 2]BF4, [Rh (COD) 2]OTf, [Ru (COD) (CF3COO) 2]2, [Ru (COD) (metilalilo) 2], [Ru (benceno) Cl2]2 e [Ir (COD) Cl]2, el primer disolvente estï seleccionado del grupo que consiste en MeOH, EtOH, IPA, DCE, THF, tolueno, EtOAc, DMF y mezclas de los mismos, el primer aditivo opcional estï seleccionado del grupo que consiste en AcOH, Et3N, HBF4, eterato de HBF4, HCl, eterato de HCl, CF3COOH, CH3COOH y TsOH, y, cuando estï presente, se encuentra en una cantidad de hasta aproximadamente 1, 2 Eq., la primera temperatura se encuentra en un intervalo comprendido entre aproximadamente 25ïC y aproximadamente 70ïC, la primera presiïn se encuentra en un intervalo comprendido entre aproximadamente 3 bar y aproximadamente 30 bar; Etapa 2. Opcionalmente convertir el grupo hidroxi del Compuesto D3 para proporcionar el Compuesto C3 que tiene un grupo -O-Me, y llevar adelante el Compuesto C3 segïn la Etapa 2 de la reivindicaciïn 1; Etapa 3. Hacer reaccionar Compuesto D3 con una segunda fuente de hidrïgeno y un agente de hidrogenaciïn en un segundo disolvente en presencia de un segundo aditivo opcional a una segunda temperatura elevada y a una segunda presiïn elevada para proporcionar una mezcla isomïrica de un Compuesto D4 y Compuesto D5:
en el que la segunda fuente de hidrïgeno es hidrïgeno gaseoso, el agente de hidrogenaciïn estï seleccionado de entre Pd/C al 10% o un segundo complejo de ligando-metal, en el que el segundo complejo de ligando-metal consiste esencialmente en un segundo ligando y un aducto metïlico [Ir (COD) Cl]2 combinado con yodo en una cantidad de hasta aproximadamente 0, 1 Eq., en el que el Pd/C al 10% estï presente en un intervalo de porcentaje en peso comprendido entre aproximadamente un 5% (p/p) y aproximadamente un 20% (p/p) , y en el que el segundo ligando estï seleccionado del grupo que consiste en (R) -P-Phos, (S) -P-Phos, (R) -Xyl-P- Phos, (S) -Xyl-P-Phos, (S) -Tol-P-Phos, (R) -Me-BoPhoz, (S) -Me-BoPhoz, (R) -Xyl-Binap y (S) -Xyl-Binap, el segundo disolvente estï seleccionado del grupo que consiste en MeOH, DCE, EtOH, IPA, THF, tolueno, EtOAc y MTBE y mezclas de los mismos, el segundo aditivo opcional estï seleccionado del grupo que consiste en Et3N, iPr2-NH, Cy2NH, (R) -Ph-etil-NH2, (S) -Ph-etil-NH2, KI, KOH, K2CO3, ïcido (R/S) -canforsulfïnico y CH3COOH, y, cuando estï presente, se encuentra en una cantidad de hasta aproximadamente 1, 2 Eq., la segunda temperatura se encuentra en un intervalo comprendido entre aproximadamente 40ïC y aproximadamente 60ïC, y
la segunda presiïn se encuentra en un intervalo comprendido entre aproximadamente 3 bar y aproximadamente 25 bar, o se encuentra en un intervalo comprendido entre aproximadamente 10 bar y aproximadamente 25 bar, o se encuentra en un intervalo comprendido entre aproximadamente 3 bar y aproximadamente 10 bar; Etapa 4. Convertir el grupo hidroxi en la mezcla isomïrica de Compuesto D4 y Compuesto D5 en un grupo -O-Me para proporcionar una mezcla isomïrica de Compuesto C4 y Compuesto C5; y llevar adelante la mezcla isomïrica de Compuesto C4 y Compuesto C5 segïn la Etapa 3 de la reivindicaciïn 1.
6. Proceso para preparar un Compuesto D2 sustancialmente puro que comprende la etapa de:
hacer reaccionar un Compuesto D1 con una primera fuente de hidrïgeno, un primer complejo de ligando-metal que consiste esencialmente en un primer ligando conjugado con un primer aducto metïlico, en un primer disolvente en presencia de un primer aditivo opcional a una primera temperatura elevada y a una primera presiïn elevada para proporcionar un Compuesto D2 sustancialmente puro:
en el que el primer ligando estï seleccionado del grupo que consiste en (R) Xyl PhanePhos, (S) Xyl PhanePhos,
(R) PhanePhos, (S) PhanePhos, (R) An PhanePhos, (S) An PhanePhos, (R) Me BoPhoz, (S) Me BoPhoz, (R) MeOXyl PhanePhos, (S) MeOXyl PhanePhos, (R) iPr PhanePhos, (S) iPr PhanePhos, PCy (R) Me BoPhoz y PCy (S) Me BoPhoz, el primer aducto metïlico estï seleccionado del grupo que consiste en [Rh (COD) 2]BF4, [Rh (COD) 2]OTf, [Rh (etileno) 2Cl]2, [Rh (etileno) 2 (acac) ], [Rh (CO) 2 (acac) ], [Rh (COD) Cl]2, [Rh (COD) (acac) ], [Ru (COD) (CF3COO) 2]2, [Ru (COD) (CH3COO) 2], [Ru (COD) (metilalilo) 2], [Ru (benceno) Cl2]2, [Ru (p-cimeno) Cl2]2, [Ru (mesitileno) Cl2]2, [Ir (COD) Cl]2, [Ir (COD) 2]BF4 e [Ir (COD) 2]BArF, la primera temperatura se encuentra en un intervalo comprendido entre aproximadamente 25ïC y aproximadamente 70ïC, y la primera presiïn se encuentra en un intervalo comprendido entre aproximadamente 3 bar y aproximadamente 30 bar.
7. Proceso en el que se lleva adelante Compuesto D2 tal como se define en la reivindicaciïn 6 en lugar de Compuesto D3 en las etapas 2 a 7 de la reivindicaciïn 5 para proporcionar un isïmero (αR, βR) y un isïmero (αR, βS) de Fïrmula (I) .
8. Proceso segïn la reivindicaciïn 5, en el que la primera fuente de hidrïgeno es hidrïgeno gaseoso; el primer complejo de ligando-metal es (R) -Xyl-PhanePhos&[Ru (COD) (CF3COO) 2]2; el primer disolvente es MeOH; la primera temperatura es aproximadamente 40ïC; la primera presiïn es aproximadamente 10 bar; la segunda fuente de hidrïgeno es hidrïgeno gaseoso; y el agente de hidrogenaciïn estï seleccionado de entre Pd/C al 10% o un segundo complejo de ligando-metal, en el que, cuando el agente de hidrogenaciïn es un segundo complejo de ligando-metal seleccionado de (R) -Me-Bo-Phoz&[Ir (COD) Cl]2 combinado con yodo en una cantidad de aproximadamente 0, 1 Eq., entonces el segundo disolvente es EtOAc; la segunda temperatura es aproximadamente 50ïC; y la segunda presiïn es aproximadamente 25 bar; y, en el que, cuando el agente de hidrogenaciïn estï seleccionado de Pd/C al 10% en una cantidad de aproximadamente un 10% (p/p) ; el segundo disolvente es MeOH; el segundo aditivo opcional es Et3N en una cantidad de aproximadamente 0, 75 Eq.; la segunda temperatura es aproximadamente 40ïC; y la segunda presiïn es aproximadamente 10 bar.
9. ïster terc-butïlico del ïcido (Z) -4- (3-carboxi-2-quinolin-3-il-alil) -piperidina-1-carboxïlico.
Patentes similares o relacionadas:
Materiales orgánicos de transporte de huecos que contienen un líquido iónico, del 14 de Noviembre de 2017, de ABENGOA RESEARCH, S.L: La presente invención se refiere a composiciones de transporte de huecos que contienen un material orgánico de transporte de carga y una sal que contiene un […]
Procedimiento para la producción de 3-piperidinoles quirales sustituidos en posición 1 empleando oxidorreductasas, del 23 de Noviembre de 2016, de OLON S.p.A: Un procedimiento para la preparación de un compuesto de fórmula (I) **Fórmula** en la que el carbono quiral es la configuración (S); R se […]
Transaminación enzimática de análogos de ciclopamina, del 6 de Enero de 2016, de INFINITY PHARMACEUTICALS, INC: Un proceso para preparar un compuesto de la fórmula (II): **Fórmula** o una sal del mismo; de un compuesto de la fórmula (I): **Fórmula** […]
Método para preparación de tamices moleculares tipo CHA utilizando agentes novedosos para orientación de estructuras, del 8 de Octubre de 2014, de CHEVRON U.S.A. INC.: Un método para preparar un tamiz molecular tipo CHA que comprende poner en contacto bajo condiciones de cristalización: al menos una fuente de al menos un óxido […]
3-Cianoquinolinas sustituidas como inhibidores de las proteínas tirosina quinasas, del 12 de Marzo de 2014, de WYETH HOLDINGS LLC: Un compuesto de Fórmula 1 que tiene la estructura:**Fórmula** en la que: X es fenilo opcionalmente monosustituido, disustituido o trisustituido […]
DERIVADOS DE POLICÉTIDOS PRENILADOS Y SU APLICACIÓN PARA EL TRATAMIENTO DE ENFERMEDADES INFECCIOSAS, del 22 de Octubre de 2012, de UNIVERSIDAD DE LA LAGUNA: Derivados de policétidos prenilados y su aplicación para el tratamiento de enfermedades infecciosas.La presente invención describe una familia de […]
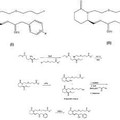 Análogos de piperidinilprostaglandina como agentes hipotensores oculares, del 21 de Marzo de 2012, de ALLERGAN, INC.: Un compuesto de fórmula general:
o una sal farmacéuticamente aceptable del mismo, en la que la línea de puntos indica la presencia o ausencia de un enlace […]
Análogos de piperidinilprostaglandina como agentes hipotensores oculares, del 21 de Marzo de 2012, de ALLERGAN, INC.: Un compuesto de fórmula general:
o una sal farmacéuticamente aceptable del mismo, en la que la línea de puntos indica la presencia o ausencia de un enlace […]
BASES BIS(AMIDA) DE CINC, del 15 de Febrero de 2011, de LUDWIG-MAXIMILIANS-UNIVERSITAT MÜNCHEN: Un compuesto de la fórmula general (I) (R 1 R 2 N)2-Zn·aMgX 1 2·bLiX 2 (I) R 1 y R 2 se seleccionan independientemente entre alquilo, alquenilo o alquinilo lineal […]