VACUNAS CONTRA EL VHC.
Vacuna contra el virus de la hepatitis C (VHC) que comprende al menos los tres péptidos siguientes:
a) AYAAQGYKVLVLNPSVAAT o una parte del mismo que contiene al menos un epítopo y b) GEVQVVSTATQSFLATCINGVCWTV o una parte del mismo que contiene al menos un epítopo y c) HMWNFISGIQYLAGLSTLPGNPA o una parte del mismo que contiene al menos un epítopo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2004/007540.
Solicitante: INTERCELL AG.
Nacionalidad solicitante: Austria.
Dirección: CAMPUS VIENNA BIOCENTER 6 1030 VIENNA AUSTRIA.
Inventor/es: ZAUNER, WOLFGANG, BUSCHLE, MICHAEL, KLADE, CHRISTOPH, ZETTLMEISSL, GERD, DR., LINGNAU, KAREN, FRISCH,JURGEN.
Fecha de Publicación: .
Fecha Solicitud PCT: 9 de Julio de 2004.
Clasificación PCT:
- A61K39/29 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Virus de la hepatitis.
- C07K14/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Togaviridae, p. ej. Flavivirus, virus de la peste, virus de la fiebre amarilla, virus de la hepatitis C, virus de la encefalitis japonesa.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
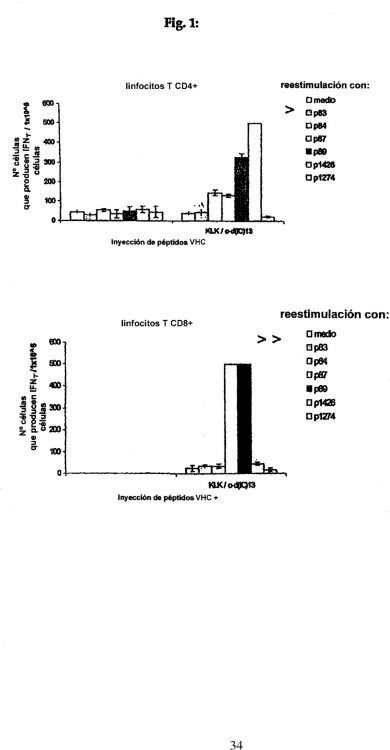
Fragmento de la descripción:
La presente invención se refiere a vacunas contra el VHC.
El sistema inmunitario es una compleja red de tipos de células y moléculas interrelacionadas, que se ha desarrollado para proteger organismos multicelulares de microorganismos infecciosos. Se puede dividir en inmunidad innata (o natural) en personas mayores evolutiva e inmunidad adaptativa (o adquirida). El sistema 5 inmunitario innato reconoce patrones, que son normalmente comunes y esenciales para los patógenos. Para este número limitado de estructuras moleculares se han desarrollado receptores codificados de la línea germinal. En comparación, las células del sistema inmunitario adaptativo - linfocitos B y T - pueden reconocer una enorme variedad de estructuras antigénicas. Los receptores, denominados según los tipos de células que los expresan, receptor de linfocitos B (BCR, sus versiones solubles se denominan anticuerpos) y receptor de linfocitos T (TCR, 10 sólo formas asociadas a la celular), 27, son generados por recombinación somática y muestran una distribución clonal. Así, inicialmente sólo hay un número pequeño de células con una cierta especificidad. Cuando el antígeno se encuentra con estas células empieza a dividirse (expansión clonal) para generar una población efectora capaz de hacer frente al antígeno. Después de la eliminación de antígeno una subpoblación especializada de células que reconoce específicamente este antígeno permanece como memoria inmunológica. Tomados juntos el sistema 15 inmunitario adaptativo está retardado (comparado con la inmunidad innata), sin embargo es específico y mejora con la exposición repetida a un patógeno/antígeno dado.
Los linfocitos T presentan un papel central en la inmunidad adaptativa. Sus receptores (los TCR) reconocen “complejo principal de histocompatibilidad” (MHC o HLA): complejos peptídicos en la superficie de las células. Estos péptidos se denominan epítopos de linfocitos T y representan productos de degradación de antígenos. Hay dos 20 clases principales de linfocitos T: los linfocitos T citotóxicos positivos CD8 (CTL) están restringidos al MHC de clase I. Los linfocitos T auxiliares (HTL) positivos CD4 están restringidos al MHC de clase II. Los HTL son esenciales para muchas características de inmunidad adaptativa: activación de las denominadas “células que presentan antígeno profesional” (las APC), conmutación de clase de inmunoglobulina (Ig), la reacción del centro germinal y maduración de la afinidad Ig, activación de CTL, memoria inmunológica, regulación de la respuesta inmunitaria y otras. 25
Las moléculas MHC recogen péptidos dentro de la célula y los presentan en la superficie de las células en los TCR de los linfocitos T. Hay dos clases principales de MHC, la clase I reconocida por CTL positivos CD8 y la clase II reconocida por HTL positivos CD4.
Las moléculas de MHC de clase I constan de una cadena alfa anclada en la membrana de 45 kDa y la b2-inmunoglobulina unida mediante enlaces no covalentes (b2m) de 12 kDa. La resolución de la estructura 30 tridimensional por cristalografía de rayos X (Stern and Wiley 1.994) revela que la cadena alfa posee una hendidura, que está cerrada en ambos extremos y tiene cabida para péptidos de 8 a 11 aminoácidos de longitud. Las moléculas de clase I se expresan de manera ubicua y los péptidos que presentan se originan de proteínas citoplasmáticas. Estas son degradadas por el proteosoma y los péptidos resultantes son transportados de manera activa al retículo endoplasmático (RE). Allí, con la ayuda de diversas carabinas, se forman complejos MHC:péptido y son 35 transportados a la superficie de las células (Heemels 1.995). Así, la clase I MHC se enfrenta al proteoma de una célula en su superficie y permite que los linfocitos T reconozcan patógenos intracelulares o células malignas.
Las moléculas de MHC de clase II constan de dos proteínas ancladas en la membrana (cadena alfa y beta) de 35 kDa y 30 kDa, respectivamente. Estas forman juntas una hendidura, abierta en ambos extremos, que puede tener cabida para péptidos de longitud variable, normalmente de 12 a 25 aminoácidos. A pesar de estas diferencias, las 40 moléculas de clase I y II poseen en común una similitud estructural sorprendente (Stern and Wiley 1.994). Las moléculas de clase II sólo se expresan en células dendríticas (DC) incluyendo APC profesional, linfocitos B y macrófagos/monocitos. Estas células están especializadas en absorber y tratar antígenos en la ruta endosómica. Inmediatamente después de su biosíntesis, las moléculas de clase II se complejan por la denominada cadena invariante (li), que evita la unión de péptidos en el RE. Cuando las vesículas que contienen complejos de clase II:li 45 se fusionan con productos de degradación que contienen endosomas, de antígeno exógeno, se degrada li hasta que la hendidura que une MHC sólo se compleja por el denominado péptido CLIP. Lo último es con ayuda de carabinas como HLA-DM intercambiado por péptidos antigénicos (Villadangos 2.000). Finalmente, los complejos MHC:péptido se presentan de nuevo en la superficie de las APC, que interactúan de numerosas formas con HTL.
Siendo tanto poligénico como extremadamente polimórfico, el sistema MHC es muy complejo. Para la cadena alfa 50 de clase I en seres humanos hay tres locus del gen denominados HLA-A, -B y –C. Igualmente, hay tres locus de cadena alfa de clase II (DRA, DQA, DPA); para los locus de cadena beta de clase II la situación es incluso más compleja ya que hay cuatro cadenas beta DR diferentes (DRB1,2,3,5) más DQB y DPB. Excepto DRA de cadena alfa de DR monomórfico, cada locus de genes está presente en muchos alelos diferentes (docenas a cientos) en la población (Klein 1.986). Los diferentes alelos presentan especificidades de unión en gran parte distintas para 55 péptidos. Los alelos se designan, por ejemplo, HLA-A*0201 o HLA-DRB1*0401 o HLA-DPA*0101/DPB*0401.
Se han identificado epítopos de linfocitos T por una variedad de propuestas (Van den Eynde 1.997). Se han usado por ejemplo líneas de linfocitos T y clones para cribar bibliotecas de expresión de ADNc por ejemplo en el contexto de células COS transinfectadas con la apropiada molécula HLA. Alternativamente, se han perseguido propuestas bioquímicas. Lo último implicaba la elución de ligandos naturales a partir de moléculas de MHC en la superficie de células diana, la separación de estos péptidos por diversas etapas cromatográficas, análisis de su 5 reactividad con linfocitos en ensayos de reconstitución de epítopos y secuenciación por espectrometría de masas (Wölfel et al., 1.994, Cox et al. 1.994).
Recientemente, la llegada de ensayos de detección de citocinas altamente sensibles como el ELIspot de IFN-gamma permitió usar linfocitos directamente ex vivo para el cribado de péptidos sintéticos superpuestos (Maecker 2.001, Kern 2.000, Tobery 2.001). Principalmente, Kern et al. (1.999 y 2.000) usaron series de conjuntos de péptidos 10 9meros superpuestos para mapear epítopos de linfocitos T CD8+ in vitro. Más tarde, Tobery et al. 2.001 modificaron esta propuesta y demostraron que se pueden usar conjuntos que contengan tantos como 64 péptidos 20meros para cribar epítopos de linfocitos T tanto CD8+ como CD4+ en ratones. Estos dos procedimientos estaban basados en el control de la respuesta específica del antígeno por medición de producción de IFN-gamma o por coloración intracelular (Kern et al 2.000) o en ensayo ELIspot (Tobery et al. 2.001). Mediante el uso de mezclas de 15-meros 15 las respuestas de los linfocitos T CD4+ son aproximadamente iguales a las detectadas cuando se usaba proteína soluble completa como antígeno, mientras que - no sorprendentemente - las respuestas de los linfocitos T CD8+ son significativamente mayores que las respuestas con frecuencia insignificantes detectadas con estimulación de proteínas solubles. Además, las respuestas de los linfocitos T CD8+ para una mezcla de péptidos de 15 aminoácidos son similares a las obtenidas con una mezcla de péptidos de 8-12 aminoácidos, seleccionados para 20 representar epítopos mínimos de MHC clase I conocidos. Lo más probablemente las peptidasas asociadas a la membrana celular son responsables de “cortar” los péptidos a la longitud óptima en estas circunstancias (Maecker et al. 2.001).
Una alternativa interesante es cribar bibliotecas combinatorias de péptidos sintéticos con linfocitos específicos. Por ejemplo, una biblioteca de decapéptidos que consta de 200 mezclas dispuestas en un formato de barrido 25 posicional, se ha usado con éxito para la identificación de ligandos peptídicos que estimulen...
Reivindicaciones:
1. Vacuna contra el virus de la hepatitis C (VHC) que comprende al menos los tres péptidos siguientes:
a) AYAAQGYKVLVLNPSVAAT o una parte del mismo que contiene al menos un epítopo y
b) GEVQVVSTATQSFLATCINGVCWTV o una parte del mismo que contiene al menos un epítopo y
c) HMWNFISGIQYLAGLSTLPGNPA o una parte del mismo que contiene al menos un epítopo. 5
2. Vacuna contra el VHC según la reivindicación 1, caracterizada porque comprende los siguientes péptidos:
GYKVLVLNPSVAAT,
DLMGYIPAV,
CINGVCWTV y
HMWNFISGIQYLAGLSTLPGNPA 10
3. Vacuna contra el VHC según la reivindicación 1 ó 2, caracterizada porque comprende el péptido KFPGGGQIVGGVYLLPRRGPRLGVRATRK.
4. Vacuna contra el VHC según la reivindicación 1, caracterizada porque comprende el péptido DLMGYIPAV.
5. Vacuna contra el VHC según la reivindicación 1, caracterizada porque comprende el péptido CINGVCWTV como un epítopo que contiene parte de GEVQVVSTATQSFLATCINGVCWTV. 15
6. Vacuna contra el VHC según la reivindicación 1, caracterizada porque comprende el péptido HMWNFISGIQYLAGLSTLPGNPA.
7. Vacuna contra el VHC según la reivindicación 1, caracterizada porque comprende el péptido GYKVLVLNPSVAAT como un epítopo que contiene parte de AYAAQGYKVLVLNPSVAAT.
8. Vacuna contra el VHC según una cualquiera de las reivindicaciones 1 a 7, caracterizada porque contiene 20 además un péptido inmunoestimulador que comprende una secuencia R1-XZXZNXZX-R2, en la cual N es un número entero entre 3 y 7, de preferencia 5, X es un resto de aminoácido natural y/o no natural cargado positivamente, Z es un resto de aminoácido seleccionado del grupo constituido por L, V, I, F y/o W y R1 y R2 se seleccionan independientemente uno de otro del grupo constituido por -H, -NH2, -COCH3, -COH, un péptido con hasta 20 restos de aminoácido o un grupo reactivo peptídico o un conector peptídico con o sin péptido; X-R2 puede ser una amida, 25 éster o tioéster del resto de aminoácido C-terminal del péptido (“Péptido A”).
9. Vacuna contra el VHC según una cualquiera de las reivindicaciones 1 a 8, caracterizada porque contiene además una molécula de ácido oligodesoxinucleico (ODN) inmunoestimuladora con la estructura de acuerdo con la fórmula (I).
30
en la que:
R1 se selecciona de hipoxantina y uracilo,
cualquier X es O o S,
cualquier NMP es un monofosfato o monotiofosfato de 2' desoxinucleósido, seleccionado del grupo constituido por monofosfato o monotiofosfato de desoxiadenosina, desoxiguanosina, desoxiinosina, desoxicitosina, desoxiuridina, desoxitimidina, 2-metil-desoxiinosina, 5-metil-desoxicitosina, desoxipseudouridina, desoxiribosapurina, 5 2-amino-desoxiribosapurina, 6-S-desoxiguanina, 2-dimetil-desoxiguanosina o N-isopentenil-desoxiadenosina,
NUC es un 2' desoxinucleósido, seleccionado del grupo constituido por desoxiadenosina, desoxiguanosina, desoxiinosina, desoxicitosina, desoxiinosina, desoxitimidina, 2-metil-desoxiuridina, 5-metil-desoxicitosina, desoxipseudouridina, desoxiribosapurina, 2-amino-desoxiribosapurina, 6-S-desoxiguanina, 2-dimetil-desoxiguanosina o N-isopentenil-desoxiadenosina, 10
a y b son números enteros de 0 a 100 con la condición de que a + b esté entre 4 y 150 y
B y E sean grupos comunes para los extremos 5' o 3' de moléculas de ácidos nucleicos (“I-/U-ODN”).
10. Vacuna contra el VHC según una cualquiera de las reivindicaciones 1 a 9, caracterizada porque contiene además un adyuvante de Al(OH)3.
11. Vacuna contra el VHC según una cualquiera de las reivindicaciones 1 a 10, caracterizada porque contiene 15 además un péptido policatiónico inmunoestimulador.
12. Vacuna contra el VHC según una cualquiera de las reivindicaciones 8 a 11, caracterizada porque dicho Péptido A es KLKL5KLK.
13. Vacuna contra el VHC según una cualquiera de las reivindicaciones 9 a 12, caracterizada porque dicho I-/U-ODN es oligo d(IC)13. 20
14. Vacuna contra el VHC según una cualquiera de las reivindicaciones 1 a 13, caracterizada porque contiene además un oligodesoxinucleótido inmunoestimulador que contiene un motivo CpG.
15. Vacuna contra el VHC según una cualquiera de las reivindicaciones 1 a 14, caracterizada porque está liofilizada en una forma que es reconstituible en 15 min a 37ºC.
16. Vacuna contra el VHC según una cualquiera de las reivindicaciones 1 a 15, caracterizada porque contiene 25 entre 20 g y 10 mg de cada péptido.
17. Vacuna contra el VHC según una cualquiera de las reivindicaciones 1 a 16, caracterizada porque está liofilizada y contiene trazas de ácido acético.
18. Uso de una vacuna según una cualquiera de las reivindicaciones 1 a 17, para la preparación de un medicamento para la prevención y el tratamiento de una infección por VHC. 30
19. Procedimiento para la preparación de una vacuna según una cualquiera de las reivindicaciones 1 a 17, caracterizado por las siguientes etapas:
- sintetizar químicamente los al menos tres péptidos como están definidos en las reivindicaciones 1 a 17,
- solubilizar estos péptidos mediante una disolución acuosa que contenga al menos un ácido orgánico seleccionado del grupo constituido por ácido fórmico, ácido acético, ácido propiónico, ácido butírico y formas 35 halogenadas o hidroxiladas de los mismos,
- mezclar los péptidos solubilizados y
- liofilizar opcionalmente los péptidos mezclados.
Patentes similares o relacionadas:
Activación de células NK inducida por péptidos, del 15 de Abril de 2020, de UNIVERSITY OF SOUTHAMPTON: Complejo que comprende una molécula de HLA-C de MHC clase I y un péptido capaz de activar la inmunidad mediada por células NK, comprendiendo o […]
Vacuna contra el virus de la fiebre del Nilo, del 23 de Octubre de 2019, de MERIAL: Un vector de expresión que comprende: - un polinucleótido, en el que el polinucleótido codifica las proteínas prM, M y E del virus de la fiebre del Nilo (WN), y […]
Composiciones para vacunas contra el virus del dengue y su uso, del 19 de Junio de 2019, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Una glicoproteína E del virus del dengue quimérico que comprende una cadena principal de la glicoproteína E del virus del dengue que comprende sustituciones […]
Partículas de vectores lentivíricos que tienen eficiencia de transducción mejorada para células que expresan DC-SIGN, del 3 de Abril de 2019, de Immune Design Corp: Un método para generar una partícula de vector lentivírico pseudotipada que comprende: (a) cultivar en un medio de cultivo que comprende kifunensina, una […]
Pestivirus, del 6 de Febrero de 2019, de INTERVET INTERNATIONAL B.V: Un virus aislado que es un miembro de los pestivirus, estando dicho virus caracterizado por que a) el virus es el agente causante de los temblores […]
Virus recombinante del sarampión que expresa polipéptidos del virus de Chikungunya y sus aplicaciones, del 19 de Septiembre de 2018, de INSTITUT PASTEUR: Una construcción de ácido nucleico que comprende un polinucleótido que codifica las proteínas estructurales CE3- E2-6K-E1 de un virus de Chikungunya (CHIKV), estando […]
Vacuna inactivada del virus del dengue con adyuvante libre de aluminio, del 30 de Agosto de 2017, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una composición inmunogénica para su uso en la administración a un ser humano que comprende al menos un virus del dengue inactivado completo […]
Modelo primate de la familia de los cercopitécidos infectado por una cepa del VHB de genotipo humano, del 21 de Junio de 2017, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE: Utilización de una cepa de VHB aislada de un genotipo D humano que comprende la secuencia SEQ ID NO: 1 para infectar un macaco de la subfamilia […]