SISTEMA DE EXPRESIÓN DE PLANTAS DERIVADO DE VIRUS DE ARN DE DOS COMPONENTES.
Sistema para replicar o para replicar y expresar una secuencia de interés en una planta,
que comprende: (i) un precursor de ADN de un replicón de ARN, derivando dicho replicón de ARN de un virus de ARN monocatenario de sentido positivo y que comprende al menos una secuencia de interés, conteniendo dicho precursor de ADN de dicho replicón de ARN, en la ORF de replicasa o en una ORF de proteína de desplazamiento de dicho replicón de ARN, uno o más intrones cerca o en lugares ricos en A/U de secuencias derivadas de dicho virus de ARN; y (ii) un precursor de ADN de un replicón auxiliar, en el que dicho replicón auxiliar (a) no puede desplazarse sistémicamente en una planta tanto en presencia como en ausencia de dicho replicón de ARN (i), y (b) puede expresar una planta o una o más proteínas necesarias para el desplazamiento sistémico de dicho replicón de ARN (i), por lo que la no posibilidad de desplazamiento sistémico de dicho replicón auxiliar se debe a la ausencia de un origen funcional de ensamblaje de las partículas virales o se debe a una incompatibilidad de dicha una o más proteínas definidas en el punto (b) con dicho replicón auxiliar (ii); por lo que dicho replicón de ARN (i) puede replicar o replicar y expresar dicha secuencia de interés en una planta, pero no puede desplazarse sistémicamente en una planta en ausencia de dicha una o más proteínas expresadas por dicho replicón auxiliar (ii)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/000492.
Solicitante: ICON GENETICS GMBH.
Nacionalidad solicitante: Alemania.
Dirección: BRIENNERSTRASSE 12A 80333 MUNCHEN ALEMANIA.
Inventor/es: GLEBA,YURI, KLIMYUK,VICTOR, MARILLONNET,SYLVESTRE, ENGLER,CAROLA.
Fecha de Publicación: .
Fecha Solicitud PCT: 19 de Enero de 2005.
Clasificación Internacional de Patentes:
- C12N15/82B
Clasificación PCT:
- C12N15/82 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › para células vegetales.
Clasificación antigua:
- C12N15/82 C12N 15/00 […] › para células vegetales.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania.
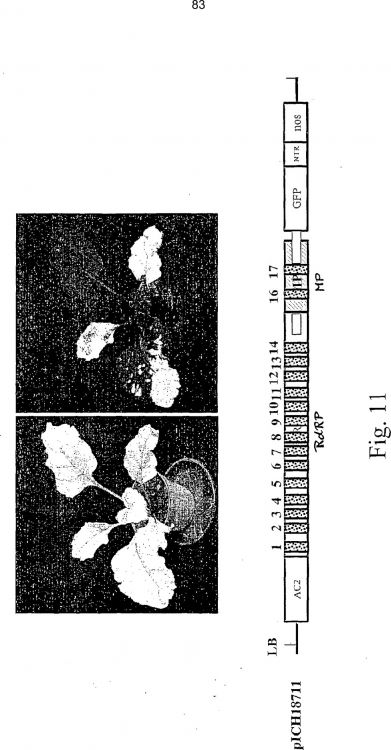
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere a un sistema de vector viral para la replicación o para la expresión de una secuencia de interés en una planta. La invención también proporciona un proceso para replicar y/o expresar una secuencia de interés en una planta. Este proceso puede usarse para expresar una proteína de interés en plantas, particularmente en plantas de cultivo. El sistema puede basarse en una gran diversidad de vectores virales diferentes.
ANTECEDENTES DE LA INVENCIÓN
Los sistemas de expresión basados en virus se pueden usar para la producción rápida de proteínas en plantas (como revisión véase: Porta & Lomonossoff, 1996, Mol. Biotechnol., 5 209-221; Yusibov et al., 1999, Curr.Top. Microbiol. Immunol., 240, 81-94) y son una herramienta poderosa para los estudios funcionales en genómica (Dalmay et al., 2000, Plant Cell, 12 369-379; Ratcliff et al., 2001, Plant J., 25, 237-245; Escobar et al., 2003, Plant Cell, 15, 1507-1523). Numerosas publicaciones y patentes en el campo describen sistemas basados en vectores virales de ADN y ARN (Kumagai et al., 1994, Proc. Natl. Acad. Sci. USA, 90, 427-430; Mallory et al., 2002, Nature Biotechnol 20, 622-625; Mor et al., 2003, Biotechnol. Bioeng, 81; 430-437; documentos US5316931; US5589367; US5866785; US5491076; US5977438; US5981236; WO02088369; WO02097080; WO9854342). Los sistemas de vectores virales existentes normalmente están limitados a un estrecho intervalo de hospedadores, en términos de su mejor rendimiento e incluso el nivel de expresión de dichos vectores, en su hospedador más favorable, está muy por debajo de los límites biológicos superiores del sistema.
Los virus de ARN son los más adecuados para usar como vectores de expresión, ya que ofrecen un nivel de expresión más alto en comparación con los virus de ADN. Existen varias patentes publicadas que describen vectores virales adecuados para la expresión sistémica de material transgénico en plantas (documentos US5316931; US5589367; US5866785). En general, estos vectores pueden expresar un gen extraño como una fusión traduccional con una proteína viral (documentos US5491076; US5977438), a partir de un promotor subgenómico adicional (documentos US5466788; US5670353; US5866785), o a partir de ARN viral policistrónico usando elementos IRES para la traducción de proteínas independiente (documento WO0229068). El primer planteamiento -fusión traduccional de una proteína recombinante con una proteína estructural viral (Hamamoto et al., 1993, Bio Technology, 11, 930-932; Gopinath et al., 2000, Virology, 267, 159-173; documentos JP6169789; US5977438) proporciona un rendimiento significativo. Sin embargo, el uso de este planteamiento es limitado, ya que la proteína recombinante no se puede separar fácilmente de la proteína viral. Una de las versiones de este planteamiento emplea la fusión traduccional mediante una secuencia peptídica reconocida por una proteasa viral específica de sitio o mediante un péptido catalítico (Dolja et al., 1992, Proc. Natl. Acad. Sci. USA, 89, 10208-10212; Gopinath et al., 2000, Virology, 267, 159-173; documentos US5162601; US5766885; US5491076).
Los procesos de expresión que utilizan vectores virales construidos en promotores subgenómicos heterólogos proporcionan un buen nivel de producción de proteínas (documento US5316931). La desventaja más importante de estos vectores y de muchos otros es su capacidad limitada en relación con el tamaño del ADN a amplificar. Normalmente, las construcciones estables incluyen insertos de no más de un kb. En algunas áreas de la genómica funcional en las plantas, puede que esto no sea tal limitación importante puesto que G. della-Cioppa et al. (documento WO993651) describieron el uso de vectores virales basados en TMV para expresar genotecas de ADNc en planta con objeto de silenciar genes endógenos. Adicionalmente, como estos vectores son capaces de desplazamiento sistémico y de producir proteínas de cubierta, desde la síntesis de proteínas recombinantes se dedican recursos significativos de la planta. Los bajos niveles de expresión conseguidos hasta ahora con estos sistemas de expresión viral en plantas son una razón principal de por qué estos sistemas son apenas competitivos con otros sistemas de expresión como los sistemas de expresión bacterianos, fúngicos o en células de insectos. Los bajos niveles de expresión dan lugar a costes muy elevados aguas abajo para el aislamiento y la purificación de proteínas en un enorme fondo de material de plantas. Por lo tanto, los costes para el procesamiento aguas abajo disminuyen rápidamente, a medida que aumenta la producción de la proteína o el producto de interés por unidad de biomasa vegetal. La seguridad biológica de estos vectores es también otra cuestión, ya que pueden formar partículas virales infecciosas.
Turpen (documentos US 5 811.653; US 5.889.191; US 5.965.794) desarrolló un sistema alternativo de dos componentes que necesitaba un virus auxiliar; este planteamiento se basa en un sistema de un virus y un virus auxiliar, mediante el cual el virus auxiliar proporciona una función replicasa, mientras que el replicón principal carece de actividad replicasa. Este sistema no es práctico porque la ARN polimerasa dependiente de ARN viral (replicasa) no funciona eficazmente con los ARN de sustrato proporcionados en trans. Una posible explicación de dicha ineficacia es que la ARN polimerasa dependiente de ARN del TMV es un heterodímero que consiste en una proteína de 126 kDa y una proteína completamente leída de 183 kDa (Watanabe et al., 1999, J. Virol., 73, 2633-2640). Se demostró que al menos un componente de este heterodímero, la proteína de 126 kDa, parecía funcionar principalmente en cis (Lewandowsky & Dawson, 2000, Virology, 271, 90-98). Existen varias publicaciones relacionadas con la complementación en trans de otras funciones virales, como el desplazamiento célula a célula y sistémico. Un hospedador transgénico u otro virus pueden proporcionar en trans el MP y la CP. Por ejemplo, mutantes del TMV con desplazamientos de fase de lectura dentro del gen MP o CP no fueron capaces de infectar local o sistémicamente plantas de tabaco inoculadas, pero adquirieron las funciones perdidas en las plantas de tabaco transgénicas que expresaban el gen MP o CP de tipo silvestre (Holt & Beachy, 1991, Virology, 181, 109-117; Osbourn, Sarkar & Wilson, 1990, Virology, 179, 921-925). Estos trabajos no abordaron la cuestión de crear vectores basados en virus para la expresión de una secuencia heteróloga de interés, sino que más bien estudiaron las funciones biológicas de diferentes proteínas virales. Otro trabajo describe la complementación del desplazamiento de larga distancia de un TMV carente de CP que expresaba GFP mediante un TMV quimérico que portaba la ORF3 del umbravirus de la roseta del cacahuete (GRV) (Ryabov, Robinson & Taliansky, 1999, Proc. Natl. Acad. Sci. USA, 96, 1212-12170). Sin embargo, como se deduce de los resultados, la eficacia de la expresión de la GFP en hojas de plantas sistémicas infectadas conjuntamente por el TMV carente de CP que expresa la GFP y el TMV que tiene la CP sustituida por la ORF3 del GRV fue significativamente menor que en plantas infectadas por el TMV sistémico que expresa la GFP. Parece que este bajo nivel de expresión puede deberse a la presencia y competición de ambos vectores virales en hojas sistémicas. Además, todos los experimentos mencionados anteriormente conducen a la formación de partículas virales infecciosas en hojas sistémicas y por lo tanto no son aceptables para su uso en el medio ambiente desde el punto de vista de seguridad biológica.
Otro sistema propuesto por C. Masuta et al. (documento US 5.304.731) propone el uso de un virus satélite de ARN del CMV para usarse como un transportador de la secuencia heteróloga de interés y un virus auxiliar que proporciona las funciones necesarias para la replicación del ARN del CMV. Hasta donde alcanza el conocimiento de los inventores, el sistema es altamente ineficaz.
Una cuestión importante con los sistemas de expresión en plantas basados en virus de la técnica anterior es la seguridad biológica. Por un lado, la elevada infectividad del virus recombinante es muy deseada para facilitar la propagación del virus en toda la planta y en las plantas colindantes, aumentando por lo tanto la producción del producto génico deseado. Por otro lado, dicha infectividad elevada compromete la contención del material recombinante puesto que puede producirse fácilmente la propagación a plantas no deseadas. Por consiguiente, son muy deseados los sistemas de expresión en plantas basados en virus más seguros.
...
Reivindicaciones:
1. Sistema para replicar o para replicar y expresar una secuencia de interés en una planta, que comprende:
(i) un precursor de ADN de un replicón de ARN, derivando dicho replicón de ARN de un virus de ARN monocatenario de sentido positivo y que comprende al menos una secuencia de interés, conteniendo dicho precursor de ADN de dicho replicón de ARN, en la ORF de replicasa o en una ORF de proteína de desplazamiento de dicho replicón de ARN, uno o más intrones cerca o en lugares ricos en A/U de secuencias derivadas de dicho virus de ARN; y
(ii) un precursor de ADN de un replicón auxiliar, en el que dicho replicón auxiliar
(a) no puede desplazarse sistémicamente en una planta tanto en presencia como en ausencia de dicho replicón de ARN (i), y
(b) puede expresar una planta o una o más proteínas necesarias
para el desplazamiento sistémico de dicho replicón de ARN (i),
por lo que la no posibilidad de desplazamiento sistémico de dicho
replicón auxiliar se debe a la ausencia de un origen funcional de
ensamblaje de las partículas virales o se debe a una incompatibilidad
de dicha una o más proteínas definidas en el punto (b) con dicho
replicón auxiliar (ii);
por lo que dicho replicón de ARN (i) puede replicar o replicar y expresar dicha secuencia de interés en una planta, pero no puede desplazarse sistémicamente en una planta en ausencia de dicha una o más proteínas expresadas por dicho replicón auxiliar (ii).
2. El sistema de acuerdo con la reivindicación 1, en el que dicho replicón auxiliar (ii) puede expresar, en una planta, una proteína de cubierta y/o una proteína de desplazamiento necesaria o útil para dicho desplazamiento sistémico de dicho replicón de ARN (i) en dicha planta.
3. El sistema de acuerdo con la reivindicación 1 ó 2, en el que dicho replicón de ARN (i) no puede expresar una proteína necesaria para el desplazamiento sistémico de dicho replicón de ARN (i) en dicha planta.
4. El sistema de acuerdo con la reivindicación 3, en el que dicho replicón de ARN (i) carece de una fase de lectura abierta de la proteína de cubierta y dicha secuencia de interés es más grande que 1 kb.
5. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en el que dicho replicón de ARN (i) está basado en o contiene componentes de un tobamovirus.
6. El sistema de acuerdo con la reivindicación 5, en el que dicho tobamovirus es un virus del mosaico del tabaco.
7. El sistema de acuerdo con la reivindicación 5 ó 6, en el que dicho replicón de ARN (i) está basado en un tobamovirus en el que la fase de lectura abierta de la proteína de cubierta se sustituye por dicha secuencia de interés.
8. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en el que dicho replicón de ARN (i) está basado en o contiene componentes del virus del mosaico de la alfalfa.
9. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en el que dicho replicón de ARN (i) está basado en o contiene componentes del virus X de la patata.
10. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en el que dicho replicón de ARN (i) esta basado en o contiene componentes del virus de mosaico del guisante pinto.
11. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a10, en el que dicho precursor de dicho replicón auxiliar (ii) es ADN que codifica dicho replicón auxiliar (ii), por lo que dicho ADN puede producir dicho replicón auxiliar (ii) en las células de dicha planta.
12. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 11, en el que dicho precursor de dicho replicón de ARN (i) o dicho precursor de dicho replicón auxiliar (ii) están incluidos en agrobacterias.
13. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 12, en el que el sistema comprende adicionalmente una planta, o semillas de la misma, para replicar o para replicar y expresar dicha secuencia de interés.
14. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 13, en el que dicha planta es una planta dicotiledónea, preferiblemente una planta Solanácea, más preferiblemente una planta de Nicotiana, más preferiblemente de tabaco.
15. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 14, en el que dicha planta es transgénica y expresa una proteína viral necesaria o útil para el desplazamiento célula a célula de dicho replicón de ARN (i) o de dicho replicón auxiliar (ii).
16. El sistema de acuerdo con la reivindicación 15, en el que dicha proteína viral es una proteína de desplazamiento del virus del mosaico del tabaco.
17. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 16, en el que dicho replicón de ARN (i) y dicho replicón auxiliar (ii) carecen de homología en regiones funcionalmente solapantes.
18. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 17, mediante el cual dicho replicón de ARN (i) y dicho replicón auxiliar (ii) carecen de una homología propensa a la recombinación en una recombinación de región en la que entre dicho replicón de ARN (i) y dicho replicón auxiliar (ii) se crearía un replicón de ARN que podría expresar una proteína necesaria para el desplazamiento sistémico y que podría desplazarse sistémicamente en dicha planta.
19. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 18, en el que la homología de secuencia entre dicho replicón de ARN (i) y dicho
replicón auxiliar (ii) en cualquiera de los segmentos de secuencia que tiene al menos 100 nucleótidos es como máximo del 80%.
20. El sistema de acuerdo con la reivindicación 19, en el que dichos segmentos de secuencia se localizan cadena abajo de las ORF de replicasa de dicho replicón de ARN (i) y dicho replicón auxiliar (ii).
21. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 20, en el que dicho replicón auxiliar (ii) carece de una ORF de proteína de desplazamiento pero contiene un ORF de replicasa y una ORF que codifica una proteína necesaria para el desplazamiento sistémico de dicho replicón de ARN (i), estando la última ORF bajo el control de un promotor subgenómico, derivando dicho promotor subgenómico de un virus de ARN de una cepa diferente del virus del ARN a partir del cual deriva el promotor subgenómico que controla la expresión de dicha secuencia de interés en dicho replicón de ARN (i).
22. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 21, en la que la secuencia de dicho replicón de ARN (i) y la secuencia de dicho replicón auxiliar (ii) no se solapan.
23. El sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 22, en el que dicho precursor de ADN de dicho replicón de ARN (i) contiene uno o más intrones en la ORF de replicasa de dicho replicón de ARN (i).
24. Un proceso de replicación o de replicación y expresión de una secuencia de interés en una planta, que comprende proporcionar células de una planta con
(i) un precursor de ADN de un replicón de ARN, derivando dicho replicón de ARN de un virus de ARN monocatenario de sentido positivo y comprendiendo al menos una secuencia de interés, conteniendo dicho precursor de ADN de dicho replicón de ARN, en la ORF de replicasa o en una ORF de la proteína de desplazamiento de dicho replicón de ARN, uno
o más intrones cerca o en lugares ricos en A/U de secuencias derivadas de dicho virus de ARN; y
(ii) un precursor de ADN de un replicón auxiliar, en el que dicho replicón auxiliar
(a) no puede desplazarse sistémicamente en dicha planta tanto en presencia como en ausencia de dicho replicón de ARN (i), y
(b) puede expresar, en una planta, o una o más proteínas necesarias para el desplazamiento sistémico de dicho replicón de ARN (i),
por lo que la no posibilidad de desplazamiento sistémico de dicho replicón auxiliar se debe a la ausencia de un origen funcional de ensamblaje de las partículas virales o se debe a una incompatibilidad de dicha una o más proteínas definidas en el punto (b) con dicho replicón auxiliar (ii);
por lo que dicho replicón de ARN (i) puede replicar o replicar y expresar dicha secuencia de interés en una planta, pero no puede desplazarse sistémicamente en dicha planta en ausencia de dicha una o más proteínas expresadas por dicho replicón auxiliar (ii).
25. El proceso de acuerdo con la reivindicación 24, en el que dicha planta se proporciona con dicho replicón de ARN (i) y/o dicho replicón auxiliar (ii) por transfección con agrobacterias que contienen en su ADN-T dicho precursor de dicho replicón (i) y/o con agrobacterias que contienen en su ADN-T dicho precursor de dicho replicón auxiliar (ii).
26. El proceso de acuerdo con una cualquiera de las reivindicaciones 24 a 25, en el que una parte de dicha planta, como una hoja, se proporciona con dicho replicón de ARN (i) y dicho replicón auxiliar (ii) pero no otras partes de dicha planta.
27. El proceso de acuerdo con una cualquiera de las reivindicaciones 24 a 26, en el que dicha secuencia de interés puede replicarse o replicarse y expresarse sistémicamente en partes de dicha planta no proporcionadas ni con dicho replicón de ARN (i) ni dicho replicón auxiliar (ii).
28. El proceso de acuerdo con una cualquiera de las reivindicaciones 24 a 26, en el que dicha planta es un planta dicotiledónea, preferiblemente una
planta Solanácea, más preferiblemente una planta de Nicotiana, más preferiblemente dicha planta es tabaco.
29. El proceso de acuerdo con la reivindicación 24, en el que dicho replicón
5 auxiliar (ii) deriva de un virus de ARN monocatenario de sentido positivo y dicho precursor de ADN que codifica dicho replicón auxiliar (ii) contiene secuencias para la función de replicón de dicho replicón auxiliar (ii), seleccionándose dichas secuencias para la función de replicón de una ORF de replicasa y de una ORF de la proteína de desplazamiento y derivando de una secuencia de dicho virus de ARN, dichas secuencias para la función de replicón presentan, en lugares seleccionados de dicha secuencia de dicho virus de ARN, la inserción de uno o más intrones, ocasionando dicha inserción una frecuencia de formación de replicón auxiliar aumentada en comparación con la de un replicón auxiliar que no presenta dicha inserción.
30. El proceso de acuerdo con la reivindicación 29, en el que dichas células de una planta que se proporcionan con dicho replicón de ARN (i) y dicho replicón auxiliar (ii) comprenden la transformación transitoria mediada por Agrobacterium con dicho precursor de ADN (i) y dicho precursor de ADN (ii).
31. El uso del sistema de acuerdo con una cualquiera de las reivindicaciones 1 a 23 para expresar una proteína de interés en una planta a partir de dicha secuencia de interés.
Patentes similares o relacionadas:
UTILIZACIÓN DE CONSTRUCTOS QUE COMPRENDEN MOTIVOS DE SECUENCIAS DE RECOMBINACIÓN PARA LA EXPRESIÓN GÉNICA MEJORADA EN MUSGO, del 19 de Mayo de 2011, de GREENOVATION BIOTECH GMBH: Un método para amplificar la expresión génica en una célula de planta de musgo, que comprende 1) proporcionar al menos un primer constructo de ácido nucleico heterólogo que […]
NUEVO CULTIVAR CON FRUTOS Y SEPALOS CONVERTIDOS EN FRUTOS DE ALTO INTERES PARA SU CONSUMO FRESCO Y PROCESADO INDUSTRIAL, del 10 de Mayo de 2011, de UNIVERSIDAD POLITECNICA DE VALENCIA UNIVERSIDAD DE ALMERIA CONSEJO SUPERIOR DE INVESETIGACIONES CIENTIFICAS: Nuevo cultivar con frutos y sépalos convertidos en frutos de alto interés para su consumo fresco y procesado industrial.En la presente invención se describen secuencias […]
 SISTEMA NUCLEAR GENETICO REVERSIBLE PARA LA ESTERILIDAD MASCULINA EN PLANTAS TRANSGENICAS, del 1 de Abril de 2011, de PIONEER HI-BRED INTERNATIONAL, INC.: Método de fabricación de una planta estéril masculina que comprende (a) proporcionar una planta que comprende una molécula de ADN recombinante que comprende (i) […]
SISTEMA NUCLEAR GENETICO REVERSIBLE PARA LA ESTERILIDAD MASCULINA EN PLANTAS TRANSGENICAS, del 1 de Abril de 2011, de PIONEER HI-BRED INTERNATIONAL, INC.: Método de fabricación de una planta estéril masculina que comprende (a) proporcionar una planta que comprende una molécula de ADN recombinante que comprende (i) […]
SECUENCIAS DE ADN CON ACTIVIDAD ANTI-REPRESORA, del 17 de Agosto de 2010, de CHROMAGENICS B.V.: Una secuencia de ADN aislada y/o recombinante que tiene actividad anti-represora, seleccionada dicha secuencia del grupo que consiste en: (a) […]
SECUENCIAS DE ADN CON ACTIVIDAD ANTI-REPRESORA, del 17 de Agosto de 2010, de CHROMAGENICS B.V.: Una secuencia de ADN aislada y/o recombinante que tiene actividad anti-represora, seleccionada dicha secuencia del grupo que consiste en: (a) el SEQ ID: 27 […]
SECUENCIAS DE ADN CON ACTIVIDAD ANTI-REPRESORA, del 17 de Agosto de 2010, de CHROMAGENICS B.V.: Una secuencia de ADN aislada y/o recombinante que tiene actividad anti-represora, seleccionada dicha secuencia del grupo que consiste en: (a) el SEQ ID: 44 de la Figura […]
SECUENCIAS DE ADN CON ACTIVIDAD ANTI-REPRESORA, del 17 de Agosto de 2010, de CHROMAGENICS B.V.: Un constructo de ADN recombinante proveído de una secuencia de ADN que tiene actividad anti-represora, dicho constructo de ADN recombinante que comprende […]
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]