PROCEDIMIENTO DE TRATAMIENTO DE UN CRECIMIENTO CELULAR ANÓMALO.
Uso de (R)-3-[1-(2,6-dicloro-3-fluoro-fenil)-etoxi]-5-(1-piperidin-4-il-1H-pirazol-4-il)-piridin-2-ilamina,
o una sal farmacéuticamente aceptable de la misma, para la fabricación de un medicamento para el tratamiento de crecimiento celular anómalo en un mamífero, en el que el crecimiento celular anómalo está mediado por quinasa de linfoma anaplásico (ALK)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2006/003397.
Solicitante: PFIZER PRODUCTS INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: EASTERN POINT ROAD GROTON, CT 06340 ESTADOS UNIDOS DE AMERICA.
Inventor/es: CHRISTENSEN,James Gail , ZOU,Yahong.
Fecha de Publicación: .
Fecha Solicitud PCT: 23 de Noviembre de 2006.
Clasificación PCT:
- A61K31/4545 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo un ciclo de seis eslabones con el nitrógeno como heteroátomo del ciclo, p. ej. pipamperona, anabasina.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
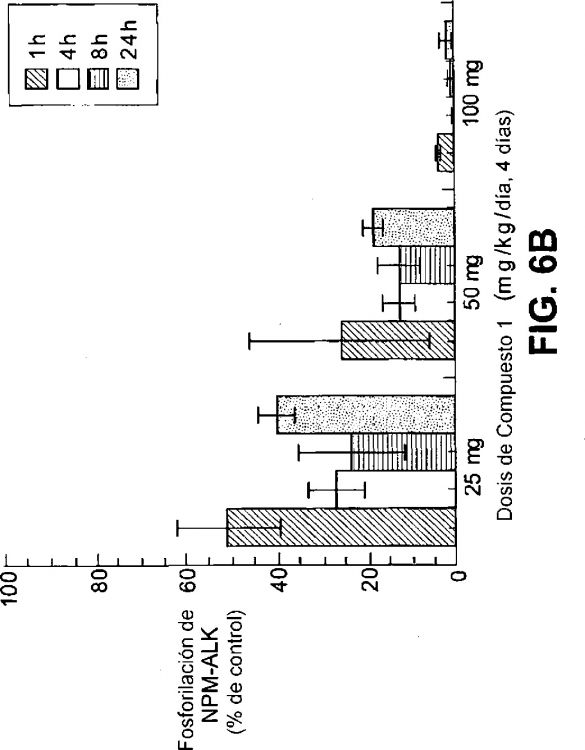
Fragmento de la descripción:
Procedimiento de tratamiento de un crecimiento celular anómalo.
Campo de la invención
La presente invención se refiere al uso de (R)-3-[1-(2,6-dicloro-3-fluoro-fenil)-etoxi]-5-(1-piperidin-4-il-1H-pira-zol-4-il)-piridin-2-ilamina, o una sal farmacéuticamente aceptable de la misma, para la fabricación de un medicamento para tratar el crecimiento celular anómalo en un mamífero, en el que el crecimiento celular anómalo está mediado por quinasa de linfoma anaplásico (ALK).
Antecedentes de la invención
El compuesto (R)-3-[1-(2,6-dicloro-3-fluoro-fenil)-etoxi]-5-(1-piperidin-4-il-1H-pirazol-4-il)-piridin-2-ilamina representado por la fórmula 1
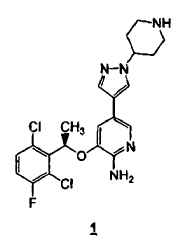
es una potente molécula pequeña inhibidora de la actividad de c-Met/HGFR (receptor del factor de crecimiento de hepatocitos) quinasa y de ALK (quinasa de linfoma anaplásico). El compuesto 1 tiene propiedades antitumorales que se median farmacológicamente a través de la inhibición de c-Met/HGFR que está implicada en la regulación del crecimiento y de la progresión metastásica de una amplia diversidad de tipos tumorales y ALK que está implicada en la patogénesis de ALCL (linfoma anaplásico de células grandes). El compuesto 1 se desvela en el documento WO 2006/021884 (Solicitud de Patente Internacional Nº PCT/IB2005/002837) y (documento US 2006/0046991 Solicitud de Patente de Estados Unidos Nº 11/212.331). Adicionalmente, el racemato del compuesto Nº 1 se desvela en el documento WO 2006/0128724 (Solicitud de Patente Internacional Nº PCT/IB05/002695) y (documento US 2006/0128724 (Solicitud de Patente de Estados Unidos Nº 11/213.039).
Los cánceres humanos comprenden un conjunto diverso de enfermedades que colectivamente son una de las principales causas de muerte en los países desarrollados por todo el mundo (American Cancer Society, Cancer Facts and Figures 2005. Atlanta: American Cancer Society; 2005). La progresión de los cánceres está causada por una serie compleja de acontecimientos genéticos y moleculares múltiples que incluyen mutaciones génicas, traslocaciones cromosómicas y anomalías cariotípicas (Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100: 57-70). Aunque las causas genéticas subyacentes del cáncer son diversas y complejas, se ha observado que cada tipo de cáncer muestra rasgos comunes y capacidades adquiridas que facilitan su progresión. Estas capacidades adquiridas incluyen crecimiento celular desregulado, capacidad prolongada para adquirir vasos sanguíneos (es decir, angiogénesis) y capacidad de las células tumorales para proliferar de forma local así como metastatizar a sitios de órganos secundarios (Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100: 57-70). Por lo tanto, la capacidad para identificar nuevos agentes terapéuticos que 1) inhiben las dianas moleculares que se alteran durante la progresión del cáncer o 2) se dirigen a procesos múltiples que son comunes a la progresión del cáncer en una diversidad de tumores representa una necesidad no satisfecha.
Una gran cantidad de bibliografía indica que c-Met/HGFR es una de las RTK más frecuentemente mutada o activada de otra forma anómala en diversos cánceres humanos (Christensen JG, Burrows J, Salgia R. c-Met as a target in human cancer and characterization of inhibitors for therapeutic intervention. Cancer Letters 2005; 225: 1-26). Los tipos de tumores en los que se ha indicado que c-Met/HGFR estaba genéticamente alterada por mutación o amplificación génica incluyen sin limitación indicios oncológicos con una fuerte necesidad médica no satisfecha tales como cánceres renal, metastásico colorrectal, glioma, de pulmón de células no pequeñas, gástrico y de cabeza y cuello (Christensen JG, Burrows J, Salgia R. c-Met as a target in human cancer and characterization of inhibitors for therapeutic intervention. Cancer Letters 2005; 225: 1-26).
Se ha implicado a las mutaciones de HGFR en carcinoma renal (véase, por ejemplo, L. Schmidt, K. Junker, N. Nakaigawa, T. Kinjerski, G. Weirich, M. Miller, y col., Novel mutations of the MET proto-oncogene in papillary renal carcinomas, Oncogene 1999; 18: 2343-2350; L. Schmidt, F.M. Duh, F. Chen, T. Kishida, G. Glenn, P. Choyke, y col., Germline and somatic mutations in the tyrosine kinase domain of the MET proto-oncogene in papillary renal carcinomas. Nat. Genet 1997; 16: 68-73; L. Schmidt, K. Junker, G. Weirich, G. Glenn, P. Choyke, I. Lubensky, y col., Two North American families with hereditary papillary renal carcinoma and identical novel mutations in the MET proto-oncogene, Cancer Res. 1998; 58: 1719-1722). Se ha asociado a las mutaciones de HGFR con carcinoma de cabeza y cuello (véase, por ejemplo, M.F. Di Renzo, M. Olivero, T. Martone, A. Maffe, P. Maggiora, A.D. Stefani, y col., Somatic mutations of the MET oncogene are selected during metastatic spread of human HNSC carcinomas, Oncogene 2000; 19: 1547-1555; D.M. Aebersold, O. Landt, S. Berthou, G. Gruber, K.T. Beer, R.H. Greiner, Y. Zimmer, Prevalence and clinical impact of Met Y1253D-activating point mutation in radiotherapy treated squamous cell cancer of the oropharynx, Oncogene 2003; 22: 8519-8523). Se ha conectado a las mutaciones de HGFR con carcinoma de pulmón (véase, por ejemplo, P.C. Ma, T. Kijima, G. Maulik, E.A. Fox, M. Sattler, J.D. Griffin, y col., c-MET mutational analysis in small cell lung cancer: novel juxtamembrane domain mutations regulating cytoskeletal functions, Cancer Res. 2003; 63: 6272-6281; P.C. Ma, S. Jagdeesh, R. Jagadeeswaran, E.A. Fox, J.G. Christensen, G. Maulik, y col., c-MET expression/activation, functions, and mutations in non-small cell lung cancer, Proc. Am. Assoc. Cancer Res. 2004; 63: 1875.
Adicionalmente, se ha implicado a las mutaciones de HGFR en otros indicios que incluyen sin limitación carcinomas hepatocelulares infantiles, cáncer gástrico humano, cáncer de estómago tipo cirroso, cáncer colorrectal y melanoma maligno. (Véase, por ejemplo, W.S. Park, S.M. Dong, S.Y. Kim, E.Y. Na, M.S. Shin, J.H. Pi, y col., Somatic mutations in the kinase domain of the Met/hepatocyte growth factor receptor gene in childhood hepatocellular carcinomas, Cancer Res. 1999; 59: 307-310; J.H. Lee, S.U. Han, H. Cho, B. Jennings, B. Gerrard, M. Dean, y col., A novel germ line juxtamembrane Met mutation in human gastric cancer, Oncogene 2000; 19: 4947-4953; A. Lorenzato, M. Olivero, S. Patane, E. Rosso, A. Oliaro, P.M. Comoglio, M.F. Di Renzo, Novel somatic mutations of the MET oncogene in human carcinoma metastases activating cell motility and invasion, Cancer Res. 2002; 62: 7025-7030; H. Kuniyasu, W. Yasui, Y. Kitadai, H. Yokozaki, H. Ito, E. Tahara, Frequent amplification of the c-met gene in scirrhous type stomach cancer, Biochem. Biophys. Res. Commun. 1992; 189: 227-232; M.F. Di Renzo, M. Olivero, A. Giacomini, H. Porte, E. Chastre, L. Mirossay, y col., Overexpression and amplification of the met/HGF receptor gene during the progression of colorectal cancer, Clin. Cancer Res. 1995; 1: 147-154; T. Hara, A. Ooi, M. Kobayashi, M. Mai, K. Yanagihara, I. Nakanishi, Amplification of c-myc, K-sam, and c-met in gastric cancers: detection by fluorescence in situ hybridization, Lab. Invest. 1998; 78: 1143-1153).
La relación de mutaciones de HGFR con función y potencial oncogénico también se ha establecido (véase por ejemplo, M. Jeffers, L. Schmidt, N. Nakaigawa, C.P. Webb,G. Weirich, T. Kishida, y col., Activating mutations for the met tyrosine kinase receptor in human cancer, Proc. Natl Acad. Sci. USA 1997; 94: 11445-11450; M. Jeffers, M. Fiscella, C.P. Webb, M. Anver, S. Koochekpour, G.F. Vande Woude, The mutationally activated Met receptor mediates motility and metastasis, Proc. Natl Acad. Sci. USA 1998; 95: 14417-14422).
Finalmente, se ha implicado a las mutaciones de HGFR en tumores de ratones y se han estudiado en ellos (véase por ejemplo, H. Takayama, W.J. LaRochelle, R. Sharp, T. Otsuka, P. Kriebel, M. Anver, y col., Diverse tumorigenesis associated with aberrant development in mice overexpressing hepatocyte growth factor/scatter factor, Proc. Natl Acad. Sci. USA 1997; 94: 701-706; T. Otsuka, H. Takayama, R. Sharp, G. Celli, W.J. LaRochelle, D.P. Bottaro, y col., c-Met autocrine activation induces development of malignant melanoma and acquisition of the metastatic phenotype, Cancer Res. 1998; 58: 5157-5167; M.I. Gallego, B. Bierie, L. Hennighausen, Targeted expression of HGF/SF in mouse mammary epithelium leads to metastatic adenosquamous carcinomas through the activation of multiple...
Reivindicaciones:
1. Uso de (R)-3-[1-(2,6-dicloro-3-fluoro-fenil)-etoxi]-5-(1-piperidin-4-il-1H-pirazol-4-il)-piridin-2-ilamina, o una sal farmacéuticamente aceptable de la misma, para la fabricación de un medicamento para el tratamiento de crecimiento celular anómalo en un mamífero, en el que el crecimiento celular anómalo está mediado por quinasa de linfoma anaplásico (ALK).
2. El uso de la reivindicación 1, en el que el mamífero es un ser humano.
3. El uso de la reivindicación 1, en el que el mamífero es un perro.
4. El uso de una cualquiera de las reivindicaciones precedentes, en el que el compuesto o sal farmacéuticamente aceptable del mismo se administra como una composición farmacéutica que comprende (R)-3-[1-(2,6-dicloro-3-fluoro-fenil)-etoxi]-5-(1-piperidin-4-il-1H-pirazol-4-il)-piridin-2-ilamina y al menos un vehículo farmacéuticamente aceptable.
Patentes similares o relacionadas:
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Conectores autoinmolativos no lineales y conjugados de los mismos, del 22 de Julio de 2020, de Byondis B.V: Compuesto conector-farmaco con la formula (I) **(Ver fórmula)** o sal, hidrato o solvato farmaceuticamente aceptables del mismo, donde […]