PROCEDIMIENTO PARA LA PREPARACIÓN DE UNA FORMA POLIMÓRFICA DE ATORVASTATINA CÁLCICA.
Procedimiento para la preparación de atorvastatina cálcica, o un hidrato de la misma,
caracterizado porque presenta unos datos seleccionados de entre el grupo constituido por un patrón de difracción de rayos X que presenta picos en 5,3 ± 0,2 y 8,3 ± 0,2 grados dos theta y un pico ancho en 18-23 ± 0,2 grados dos theta; y un espectro de RMN 13C de estado sólido que presenta señales en 21,9, 25,9, 118,9, 122,5, 128,7, 161,0 y 167,1 ppm, que comprende las etapas siguientes a) disolver una sal metálica, de amonio o de alquilamonio de atorvastatina en un disolvente para formar una solución de sal de atorvastatina, b) eliminar impurezas de la solución de sal de atorvastatina, c) poner en contacto la solución de sal de atorvastatina con una sal de calcio, y d) aislar la atorvastatina cálcica o el hidrato de la misma
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E04027375.
Solicitante: TEVA PHARMACEUTICAL INDUSTRIES LTD..
Nacionalidad solicitante: Israel.
Dirección: 5 BASEL STREET, P.O. BOX 3190 49131 PETAH TIQVA ISRAEL.
Inventor/es: ARONHIME, JUDITH, AYALON, ARI, LEVINGER, MICHAL, ROYTBLAT, SOFIA, NIDDAM, VALERIE, LIFSHITZ, REVITAL.
Fecha de Publicación: .
Fecha Solicitud PCT: 16 de Noviembre de 2000.
Fecha Concesión Europea: 25 de Agosto de 2010.
Clasificación Internacional de Patentes:
- A61K31/40 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con cinco eslabones con un nitrógeno como único heteroátomo de un ciclo, p. ej. sulpirida, succinimida, tolmetina, buflomedil.
- C07D207/34 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 207/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros no condensados con otros ciclos, con solamente un átomo de nitrógeno como heteroátomo. › con heteroátomos o con átomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno, p. ej. radicales éster o nitrilo, unidos directamente a los átomos de carbono del ciclo.
Clasificación PCT:
- A61K31/40 A61K 31/00 […] › que tienen ciclos con cinco eslabones con un nitrógeno como único heteroátomo de un ciclo, p. ej. sulpirida, succinimida, tolmetina, buflomedil.
- C07D207/335 C07D 207/00 […] › Radicales sustituidos por átomos de nitrógeno que no forma parte de un radical nitro.
Clasificación antigua:
- A61K31/40 A61K 31/00 […] › que tienen ciclos con cinco eslabones con un nitrógeno como único heteroátomo de un ciclo, p. ej. sulpirida, succinimida, tolmetina, buflomedil.
- C07D207/335 C07D 207/00 […] › Radicales sustituidos por átomos de nitrógeno que no forma parte de un radical nitro.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Chipre.
Fragmento de la descripción:
Procedimiento para la preparación de una forma polimórfica de atorvastatina cálcica.
Campo de la invención
La presente invención se refiere a procedimientos para preparar una forma cristalina novedosa de atorvastatina cálcica.
Antecedentes de la invención
La atorvastatina es un miembro de la clase de los fármacos denominados estatinas. Los fármacos de estatina son actualmente los fármacos terapéuticamente más eficaces disponibles para reducir la concentración de partículas de lipoproteínas de baja densidad (LDL) en el flujo sanguíneo de los pacientes con riesgo de enfermedades vasculares. Se ha relacionado un nivel elevado de LDL en el flujo sanguíneo con la formación de lesiones coronarias que obstruyen el flujo de sangre y pueden provocar fisuras y trombosis. Goodman y Gilman, The Pharmacological Basis of Therapeutics 879 (9ª ed. 1996). Se ha puesto de manifiesto que la reducción de los niveles de LDL en plasma reduce el riesgo de acontecimientos clínicos en pacientes con enfermedades cardiovasculares y pacientes que no presentan ninguna enfermedad cardiovascular pero sí hipercolesterolemia. Scandinavian Simvastatin Survival Study Group, 1994; Lipid Research Clinics Program, 1984a, 1984b.
El mecanismo de acción de los fármacos de estatina ha sido dilucidado con cierto detalle. Dichos fármacos interfieren con la síntesis de colesterol y otros esteroles en el hígado inhibiendo competitivamente la enzima 3-hidroxi-3-metil-glutaril-coenzima A reductasa ("HMG-CoA reductasa"). La HMG-CoA reductasa cataliza la conversión de HMG a mevalonato, que es la etapa determinante de la velocidad en la biosíntesis del colesterol, y de este modo su inhibición lleva a una reducción de la concentración de colesterol en el hígado. La lipoproteína de muy baja densidad (VLDL) es el vehículo biológico para transportar colesterol y triglicéridos desde el hígado a las células periféricas. La VLDL es catabolizada en las células periféricas que liberan ácidos grasos que se pueden almacenar en adipocitos o ser oxidados por el músculo. La VLDL se convierte en lipoproteína de densidad intermedia (IDL), que es eliminada por un receptor de LDL o se convierte en LDL. La producción disminuida de colesterol provoca un aumento del número de receptores de LDL y una correspondiente reducción en la producción de partículas de LDL mediante el metabolismo de IDL.
Atorvastatina es el nombre químico común del ácido [R-(R*,R*)]-2-(4-fluorofenil)-β,δ-dihidroxi-5-(1-metiletil)-3-fenil-4-[(fenilamino)carbonil]-1H-pirrol-1-heptanoico. El ácido libre tiende a la lactonización. La estructura molecular de la lactona está representada por la fórmula (I).
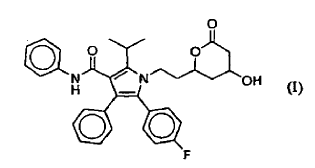
La atorvastatina está comercializada en forma de sal de hemi calcio de trihidrato con el nombre LIPITOR por Warner-Lambert Co.
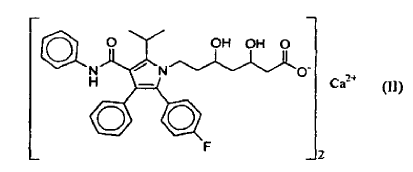
La atorvastatina fue dada a conocer al público y reivindicada por primera vez en la patente US nº 4.681.893. La sal de hemi calcio representada en la fórmula (II) (en adelante designada "atorvastatina cálcica") se da a conocer en la patente US nº 5.273.995. Dicha patente da a conocer la obtención de la sal de calcio mediante cristalización a partir de una solución de salmuera resultante de la transposición de la sal sódica con CaCl2, y se purifican adicionalmente por recristalización a partir de una mezcla 5:3 de acetato de etilo y hexano. Las dos patentes anteriores se incorporan a la presente memoria como referencia.
La presente invención incluye un procedimiento para la preparación de una nueva forma cristalina de atorvastatina cálcica en los estados hidratado y anhídrido. El polimorfismo es la propiedad de algunas moléculas y complejos moleculares de asumir más de una forma cristalina o amorfa en estado sólido. Una molécula individual, tal como la atorvastatina de la fórmula (I) o el complejo salino de fórmula (II), puede dar lugar a una variedad de sólidos con diferentes propiedades físicas, tales como solubilidad, patrón de difracción de rayos X y espectro de RMN 13C en estado sólido. Las diferencias en las propiedades físicas de los polimorfos resultan de la orientación y las interacciones intermoleculares de las moléculas adyacentes (complejos) en el sólido. En consecuencia, los polimorfos son sólidos distintos que comparten la misma fórmula molecular y que pueden ser considerados análogos a una célula unitaria en metalurgia, aunque presentando propiedades físicas ventajosas y/o desventajosas distintas en comparación con otras formas de la familia de polimorfos. Una de las propiedades físicas más importantes de los polimorfos farmacéuticos es su solubilidad en solución acuosa, particularmente su solubilidad en los jugos gástricos de un paciente. Por ejemplo, en el caso en el que la absorción a través del tracto gastrointestinal es lenta, a menudo resulta deseable en un fármaco inestable a las condiciones del estómago o el intestino del paciente que el mismo se disuelva lentamente, de tal modo que no se acumule en un entorno perjudicial para él. Por otro lado, en el caso en el que la eficacia de un fármaco se correlaciona con los niveles de pico en flujo sanguíneo del mismo, una propiedad compartida por los fármacos de estatina, y siempre y cuando el fármaco sea rápidamente absorbido por el sistema gastrointestinal, es probable que una forma con una disolución más rápida exhiba una mayor eficacia en comparación con una cantidad comparable de una forma con una disolución más lenta.
La patente US nº 5.969.156 da a conocer tres polimorfos de atorvastatina designados formas I, II y IV por los inventores de las mismas. Aunque los inventores de la patente US nº 5.969.156 reivindican determinadas ventajas de procesamiento y terapéuticas de sus formas sobre la atorvastatina cálcica amorfa, se pueden obtener ventajas por otras formas distintas, y en consecuencia no descubiertas, de atorvastatina cálcica.
Sumario de la invención
La presente invención da a conocer un procedimiento para la preparación de una nueva forma V de atorvastatina cálcica en sus estados anhídrido e hidratado, la cual presenta la ventaja de tener una mayor solubilidad en agua que la atorvastatina de forma I.
Breve descripción de los dibujos
La figura 1 es un difractograma de rayos X en polvo de la atorvastatina cálcica de forma V;
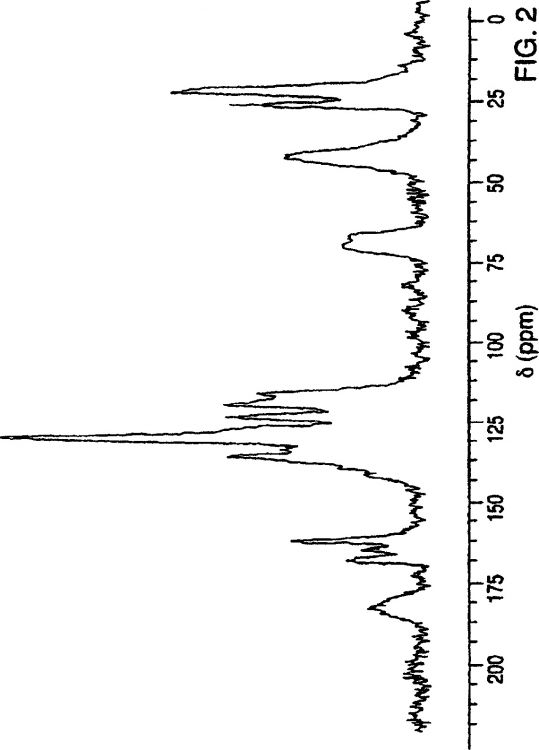
la figura 2 es un espectro de RMN 13C en estado sólido de la atorvastatina cálcica de forma V.
Descripción detallada de la invención
La nueva forma cristalina de atorvastatina cálcica de forma V se distingue bien de las modificaciones cristalinas obtenidas llevando a cabo los procedimientos descritos en las patentes US nº 5.273.995 y nº 5.969.156 utilizando las técnicas de difracción de rayos X en polvo y resonancia magnética nuclear 13C en estado sólido.
El difractograma de rayos X en polvo de la forma V (figura 1) presenta dos picos medios en 5,3
El espectro de RMN 13C de estado sólido de la forma V está caracterizado porque presenta los siguientes desplazamientos químicos:

Este espectro de RMN 13C de estado sólido (figura 2) se distingue bien de los de las formas I, II, III y IV conocidas, y también se distingue del de la forma amorfa, que da lugar a un patrón...
Reivindicaciones:
1. Procedimiento para la preparación de atorvastatina cálcica, o un hidrato de la misma, caracterizado porque presenta unos datos seleccionados de entre el grupo constituido por un patrón de difracción de rayos X que presenta picos en 5,3
2. Procedimiento para la preparación de atorvastatina cálcica, o un hidrato de la misma, caracterizado porque presenta unos datos seleccionados de entre el grupo constituido por un patrón de difracción de rayos X que presenta picos en 5,3
3. Procedimiento según la reivindicación 2, en el que el cristal semilla de atorvastatina cálcica es atorvastatina cálcica, o un hidrato de la misma, caracterizado porque presenta unos datos seleccionados de entre el grupo constituido por un patrón de difracción de rayos X que presenta picos en 5,3
4. Procedimiento según cualquiera de las reivindicaciones 1 a 3, en el que la sal de calcio se añade en una cantidad que proporciona medio mol de Ca2+ por mol de atorvastatina en la solución de sal de atorvastatina.
5. Procedimiento según la reivindicación 4, en el que las sales de atorvastatina y de calcio se combinan a una temperatura elevada.
6. Procedimiento según la reivindicación 5, en el que dicha temperatura elevada es superior a 40ºC e inferior a 80ºC.
7. Procedimiento según la reivindicación 6, en el que dicha temperatura elevada es superior a 50ºC e inferior a 70ºC.
8. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que la sal de atorvastatina es una sal metálica de atorvastatina.
9. Procedimiento según la reivindicación 8, en el que la sal metálica de atorvastatina es una sal sódica de atorvastatina.
10. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que la sal de calcio es acetato de calcio.
Patentes similares o relacionadas:
Novedosa forma cristalina de la sal 1-(5-(2,4-difluorofenil)-1-((3-fluorofenil)sulfonil)-4-metoxi-1H-pirrol-3-il)-N-metilmetanamina, del 22 de Julio de 2020, de DAEWOONG PHARMACEUTICAL CO., LTD.: Una forma cristalina I de clorhidrato de 1-(5-(2,4-difluorofenil)-1-((3-fluorofenil)sulfonil)-4-metoxi-1H-pirrol-3-il)- N-metilmetanamina que tiene picos en ángulos de difracción […]
Análogos de (E)-N''-(1-feniletiliden) benzohidrazida sustituida como inhibidores de desmetilasas de histonas, del 15 de Julio de 2020, de UNIVERSITY OF UTAH RESEARCH FOUNDATION: Un compuesto que tiene una estructura representada por una fórmula: **(Ver fórmula)** en donde m es 1; n es un número entero de 0 a […]
Nueva sal de adición de ácido de 1-(5-(2,4-difluorofenil)-1-((3-fluorofenil)sulfonil)-4-metoxi-1H-pirrol-3-il)-N-metilmetanamina, del 15 de Julio de 2020, de DAEWOONG PHARMACEUTICAL CO., LTD.: Una sal de adición de ácido de 1-(5-(2,4-difluorofenil)-1-((3-fluorofenil)sulfonil)-4-metoxi-1H-pirrol-3-il)-Nmetilmetanamina en la que el ácido es ácido […]
Conjugados de ligadores (ADCs) con inhibidores de KSP, del 24 de Junio de 2020, de Bayer Pharma Aktiengesellschaft: Conjugado de un ligador o un derivado del mismo con una o varias moléculas de principio activo, en donde la molécula de principio activo es un inhibidor de la proteína del huso […]
Formulaciones farmacéuticas de estatinas y ácidos grasos omega-3 para encapsulación, del 27 de Mayo de 2020, de Catalent Ontario Limited: Una cápsula de gelatina blanda multifase para administración oral, comprendiendo la cápsula de gelatina blanda: una forma de dosificación […]
Procedimiento de estabilización de tamaño de partícula, del 27 de Mayo de 2020, de INKE, S.A.: Un procedimiento para obtener una sal de glicopirronio estable que comprende las siguientes etapas: a) micronizar la sal de bromuro de glicopirronio, opcionalmente […]
Utilización de estatinas para la enfermedad periodontal y regeneración ósea, del 20 de Mayo de 2020, de Rosenberg Messina, David Rafael: Atorvastatina o una sal farmacéuticamente aceptable de la misma para usar en la prevención o tratamiento de la enfermedad periodontal humana […]
Proteínas de unión a antígeno para proproteína convertasa subtilisina kexina tipo 9 (PCSK9), del 6 de Mayo de 2020, de AMGEN INC.: Una proteína de unión a antígeno, donde dicha proteína de unión a antígeno (i) comprende (a) un dominio variable de cadena ligera que comprende una secuencia […]