PROCEDIMIENTO DE PREPARACION DE UNA COMPOSICION DE LIBERACION PROGRAMADA CON VENLAFAXINA Y EL PRODUCTO RESULTANTE.SP.
Procedimiento de preparación de composiciones de liberación programada con Venlafaxina,
que comprende principalmente una formación de cápsulas de liberación prolongada con el principio activo Venlafaxina HCl, en el que se observa una mejora de la Biodisponibilidad y que comprende el procedimiento de elaboración siguiente:
- Una primera fase de elaboración de núcleos no activos, en los que los cristales de azúcar son colocados dentro de una caldera de revestimiento para ser humedecidos y espolvoreados después con almidón de maíz; los microgránulos esféricos obtenidos son secados en una estufa y un depurador, y a continuación se clasifican según su granulometría,
- Una segunda fase, en la que a los núcleos no activos de granulometría adecuada, preparados en la fase anterior, son agregados, como aglutinante, una solución alcohólica de povidona y, a continuación, el fármaco activo, Venlafaxina HCl, en forma de polvo impalpable, y los microgránulos obtenidos de esta manera son revestidos con talco, son depurados y secados.
- Una tercera fase, en la que se completa la aplicación del revestimiento sobre los microgránulos que contienen el fármaco activo, utilizando soluciones de etil celulosa;
- Una cuarta y última fase, en la que se realiza la encapsulación de los micro granulados revestidos
Tipo: Resumen de patente/invención. Número de Solicitud: W0200001BR.
Solicitante: DIFFUCAP CHEMOBRAS QUIMICA E FARMACEUTICA LTDA.
Nacionalidad solicitante: Brasil.
Dirección: RUA GOIAS, 1232,QUINTINO BOCAIUVA, CEP-021380-.
Inventor/es: MOLENDA FERREIRA AMADO,ELIZABETH, RAFAEL DE SOUZA,FERNANDO.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- A61K9/50K2
Clasificación PCT:
- A61K31/137 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Arilalquilaminas, p. ej. Anfetamina, epinefrina, salbutamol, efedrina.
- A61K9/50 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Microcápsulas (A61K 9/52 tiene prioridad).
Clasificación antigua:
- A61K6/00 A61K […] › Preparaciones para técnica dental.
Fragmento de la descripción:
Procedimiento de preparación de una composición de liberación programada con Venlafaxina y el producto resultante.
La presente invención se refiere a una nueva formulación de cápsulas de liberación programada con el principio activo Venlafaxina HCl (*), así como al producto resultante, que presenta una mayor absorción del principio activo y una drástica reducción de los efectos adversos.
(*) 1 -[2-(Dimetilamina)-(4-metoxifenil)etil]-ciclohexanol
Para la preparación de productos farmacéuticos de liberación programada se utilizan diversos procedimientos. Entre éstos, los comprimidos de matriz lentamente soluble pueden presentar la desventaja de experimentar retención pilórica, lo que impide prever, en un momento determinado, el lugar en el que se encuentran en el segmento digestivo, causando de esta manera la indeterminación del perfil de disolución.
El procedimiento de la presente invención incluye la elaboración de microgránulos de acción prolongada (MAP) que contienen el principio activo. Estos gránulos se introducen, en grandes cantidades, en cápsulas que, al separarse en el lumen gástrico, permiten la dispersión de los microgránulos por todo el volumen disponible, liberando el principio activo en una forma independiente entre sí, consiguiendo la conservación de un perfil de disolución definida.
El procedimiento de elaboración permite evitar además una dificultad añadida que presenta la Venlafaxina en preparaciones de liberación programada, tal como su elevada solubilidad. Una vez obtenida la disolución programada mediante el depósito de un tejido alrededor de los microgránulos, éste debe tener un grosor suficiente para regular de manera adecuada su velocidad de disolución.
El objetivo de la presente invención es el desarrollo de una metodología de elaboración que incluye microgránulos de acción prolongada que contienen Venlafaxina, y de tal manera que permita regular el grosor del tejido implicado, para obtener el perfil de disolución adecuado del principio activo y, en consecuencia, una mejor absorción del principio activo y disminución de sus efectos adversos.
En cuanto a los antecedentes de la presente invención, se conoce algunas patentes anteriores en las que se desarrollaron procedimientos de preparación de MAP que contienen Venlafaxina HCl:
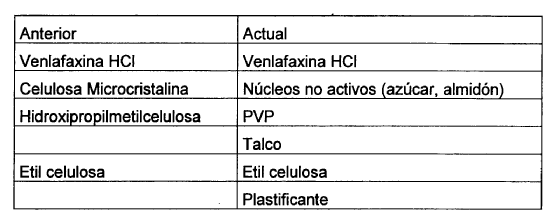
En dichas patentes, los núcleos se elaboran a partir de la mezcla del fármaco activo con celulosa microcristalina, que se prensa y se granula utilizando hidroxipropilmetilcelulosa dispersada en agua como aglutinante, una dispersión de este tipo puede prepararse en el sitio de forma previa. Esta masa húmeda se extruye, moldea en forma de esferas, se seca y purifica (para seleccionar granulometrías), obteniéndose los microgránulos con el fármaco activo incorporado y sin revestimiento, con la propiedad de "liberación inmediata".
En estas mismas patentes, también se reivindica la elaboración de núcleos sin la presencia de hidroxipropilmetilcelulosa, aunque ésta se utiliza inmediatamente después, debidamente mezclada con etil celulosa, en la fase posterior de aplicación del revestimiento.
Para conseguir las propiedades de "liberación programada", los microgránulos se cubren con un tejido, por la deposición de una mezcla de etil celulosa e hidroxipropilmetilcelulosa. Este procedimiento se realiza en un lecho licuado por aspersión de una solución de etil celulosa e hidroxipropilmetilcelulosa en un disolvente constituido por una mezcla de cloruro de metileno y metanol.
El objeto principal de la presente invención es una nueva formulación de cápsulas de liberación prolongada que contienen el principio activo Venlafaxina HCl, caracterizada por presentar una Biodisponibilidad en seres humanos de 2.279 mg.h/mes, y por comprender el siguiente procedimiento de elaboración:
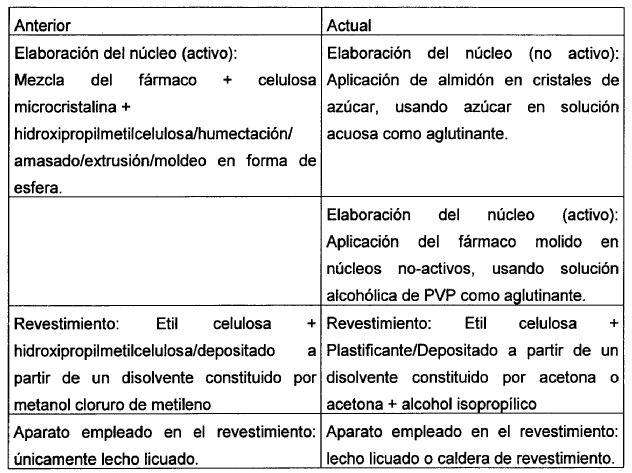
- I- Elaboración del núcleo no-activo. Estos núcleos se elaboran humedeciendo cristales de azúcar en una caldera de revestimiento con una solución diluida de azúcar en agua. Estos cristales húmedos se espolvorean con almidón de maíz, para favorecer la formación de esferas mediante el movimiento turbulento de los cristales en el interior de la caldera y para eliminar el exceso de humedad. Estos núcleos húmedos esféricos se secan en una estufa de secado con circulación forzada de aire caliente y después de purificarse se clasifican según su granulometría.
- II- Elaboración del núcleo activo. Los núcleos inertes elaborados en la fase anterior, secados, purificados y con la granulometría adecuada, se introducen en una caldera de revestimiento de capacidad adecuada, donde se humedecen con una solución alcohólica de Povidona (generalmente un alcohol isopropílico). Cuando se alcanza el estado de humedad deseado, se comienza a espolvorear el producto dentro de la caldera con Venlafaxina HCl previamente molido hasta un polvo impalpable. Cuando la incorporación del principio activo termina, se hacen pasar los microgránulos por un tamiz de acero inoxidable con la malla apropiada después de secarse en la misma caldera en movimiento, con una corriente de aire caliente o en una estufa de secado de aire caliente forzado.
- III- Aplicación del revestimiento. En la presente invención a las soluciones de acetona, o Etil celulosa acetona-alcohólica, se incorporan un plastificante adecuado para disminuir la temperatura de transición vítrea, evitando de esta manera la formación de membranas rompibles.
A continuación se presentan dos posibilidades tecnológicas para la obtención de la membrana que cubre los microgránulos de la calidad y grosor suficiente para alcanzar el perfil deseado de disolución programada.
- - Con caldera de revestimiento. En la misma caldera en la que se elaboraron los microgránulos activos, se espolvorean los mismos con la misma solución de Etil celulosa. La evaporación del disolvente deja a los microgránulos revestidos con un fino revestimiento de etil celulosa plastificada. El grosor del revestimiento se regula mediante la cantidad de solución aplicada. Este producto se deja secar por rotación en una caldera con corriente de aire caliente o después en una estufa con aire caliente forzado. Se realiza el depósito de cantidades crecientes del tejido de revestimiento, hasta que se obtiene la disolución deseada in vitro.
- - Lecho licuado con Wurster. En este caso, se requiere una elaboración previa de microgránulos "sin protección", con los obtenidos en la primera fase. Debido al movimiento enérgico en el interior del Wurster, los microgránulos se endurecen aplicándoles, en la caldera de revestimiento, en primer lugar un pre-revestimiento de PVP y después etil celulosa. Como mínimo, se termina el revestimiento en polvo, sobre los microgránulos colocados en el lecho licuado, con la misma solución que se aplica en la caldera de revestimiento.
Las diferencias entre ambas etapas son las siguientes:
- a) En el Wurster, la aplicación del revestimiento es más eficaz, obteniendo idéntico grosor de tejido, con menos cantidad de solución aplicada.
- b) Los procedimientos son más reproductivos en el Wurster que en las calderas de revestimiento tradicionales. Sin embargo en éstas últimas, el producto es más accesible, ya que puede detectarse y corregirse más rápidamente una dificultad ocasional en el procedimiento.
- c) En las calderas de revestimiento convencionales, el producto no se somete a la tensión mecánica que se produce en el lecho licuado, obteniendo una menor producción de polvo, no deseada.
Comparando el procedimiento actual con los anteriores, a continuación se describen los componentes de los distintos procedimientos:
En cuanto a la diferencia del procedimiento de elaboración:
Ya que se trata de un fármaco extremadamente soluble, el perfil de disolución del mismo se regula exclusivamente por la calidad y grosor del tejido de revestimiento. De esta manera, ambas tecnologías, la anterior y la actual, pueden conducir a productos similares desde el punto de vista de su biodisponibilidad. Sin embargo,...
Reivindicaciones:
1. Procedimiento de preparación de composiciones de liberación programada con Venlafaxina, que comprende principalmente una formación de cápsulas de liberación prolongada con el principio activo Venlafaxina HCl, en el que se observa una mejora de la Biodisponibilidad y que comprende el procedimiento de elaboración siguiente:
- - Una primera fase de elaboración de núcleos no activos, en los que los cristales de azúcar son colocados dentro de una caldera de revestimiento para ser humedecidos y espolvoreados después con almidón de maíz; los microgránulos esféricos obtenidos son secados en una estufa y un depurador, y a continuación se clasifican según su granulometría,
- - Una segunda fase, en la que a los núcleos no activos de granulometría adecuada, preparados en la fase anterior, son agregados, como aglutinante, una solución alcohólica de povidona y, a continuación, el fármaco activo, Venlafaxina HCl, en forma de polvo impalpable, y los microgránulos obtenidos de esta manera son revestidos con talco, son depurados y secados.
- - Una tercera fase, en la que se completa la aplicación del revestimiento sobre los microgránulos que contienen el fármaco activo, utilizando soluciones de etil celulosa;
- - Una cuarta y última fase, en la que se realiza la encapsulación de los micro granulados revestidos.
2. Procedimiento de preparación de composiciones de liberación programada con Venlafaxina de acuerdo con la reivindicación 1, en el que el principio activo Venlafaxina HCl puede encontrarse en el producto final en una proporción entre aproximadamente el 10% y el 80% en peso.
3. Procedimiento de preparación de composiciones de liberación programada con Venlafaxina de acuerdo con la reivindicación 1, en el que la Povidona utilizada como aglutinante en la segunda fase del procedimiento puede encontrarse en el producto final en una proporción entre el 1% y el 40% en peso.
4. Procedimiento de preparación de composiciones de liberación programada con Venlafaxina de acuerdo con la reivindicación 1, en el que el revestimiento de los microgránulos con el fármaco activo puede realizarse en una caldera de revestimiento.
5. Procedimiento de preparación de composiciones de liberación programada con Venlafaxina de acuerdo con la reivindicación 1, en el que el revestimiento de los microgránulos con el fármaco activo puede realizarse en lecho licuado con Wurster, tratamiento previo para mejorar las propiedades mecánicas.
6. Procedimiento de preparación de composiciones de liberación programada con Venlafaxina de acuerdo con la reivindicación 1, en el que para el revestimiento de los gránulos que contienen el fármaco activo pueden usarse soluciones de acetona, de acetona alcohólica u otras soluciones alcohólicas de etil celulosa en una proporción entre el 0,1% y el 50% en peso.
7. Procedimiento de preparación de composiciones de liberación programada con Venlafaxina de acuerdo con la reivindicación 1, en el que a las soluciones de etil celulosa utilizadas para el revestimiento de los gránulos pueden añadirse plastificantes en una proporción entre el 0,01% y el 5% en peso en el producto final, con objeto de evitar la formación de membranas rompibles.
8. Procedimiento de preparación de composiciones de liberación programada con Venlafaxina de acuerdo con la reivindicación 1, en el que los plastificantes que pueden añadirse a las soluciones de etil celulosa en la etapa de revestimiento son: Mygliol, Aceite de Ricino, Ceras de Abeja, Ésteres de ftalato.
9. Procedimiento de preparación de composiciones de liberación programada con Venlafaxina de acuerdo con la reivindicación 1, en el que el revestimiento de los gránulos que contienen el fármaco activo se aplica en la proporción necesaria para conseguir el perfil de disolución programada deseada.
Patentes similares o relacionadas:
PREPARACIÓN FARMACÉUTICA PARA LA ADMINISTRACIÓN ORAL CON LIBERACIÓN CONTROLADA DE PRINCIPIO ACTIVO EN EL INTESTINO DELGADO Y PROCEDIMIENTO PARA SU PREPARACIÓN, del 14 de Febrero de 2012, de DR. R. PFLEGER CHEMISCHE FABRIK GMBH: Preparación farmacéutica para la administración oral con liberación controlada de principio activo en el intestino delgado, basada en vehículos […]
COMPOSICIÓN FARMACÉUTICA DE LIBERACIÓN CONTROLADA DE CLORHIDRATO DE VENLAFAXINA, Y PROCEDIMIENTO PARA LA PREPARACIÓN DE LA MISMA, del 1 de Febrero de 2012, de VALPHARMA S.A.: Composición farmacéutica de liberación controlada de clorhidrato de venlafaxina, que comprende: - un núcleo inerte sobre el que se aplica una capa […]
MÉTODOS DE PRODUCCIÓN DE CRISTALES, del 3 de Noviembre de 2011, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Un método para producir un cristal de (R)-2-[[[3-metil-4-(2,2,2-trifluoroetoxi)-2-piridinil]metil]sulfinil]-1Hbencimidazol o (S)-2-[[[3-metil-4-(2,2,2-trifluoroetoxi)-2-piridinil]metil]sulfinil]-1H-bencimidazol, […]
COMPOSICIÓN FARMACÉUTICA EN FORMA DE MICROESFERAS RECUBIERTAS PARA LA LIBERACIÓN MODIFICADA DE UN RELAJANTE MUSCULAR Y UN AINE, del 24 de Junio de 2011, de LABORATORIOS SENOSIAIN, S.A. DE C.V: La presente invención se refiere a una composición farmacéutica de liberación modificada en cápsulas con microesferas recubiertasque comprende la combinación […]
COMPOSICIONES FARMACÉUTICAS QUE COMPRENDEN UN ANALGÉSICO OPIOIDE, del 16 de Mayo de 2011, de EURO-CELTIQUE S.A.: Formulación farmacéutica que comprende: un sustrato que comprende un analgésico opioide seleccionado del grupo consistente en buprenorfina, codeína, hidrocodona, hidromorfona, […]
COMPOSICIONES FARMACÉUTICAS QUE COMPRENDEN UN ANTAGONISTA OPIOIDE, del 6 de Mayo de 2011, de EURO-CELTIQUE S.A.: Formulación farmacéutica que comprende: un sustrato que comprende a un antagonista opioide, en donde el antagonista opioide está protonado; un recubrimiento que constituye […]
 FORMULACIÓN TERAPEÚTICA PARA ADMINISTRAR TOLTERODINA CON LIBERACIÓN CONTROLADA, del 4 de Marzo de 2011, de PFIZER HEALTH AB: Uso de tolterodina, su metabolito 5-hidroximetilo o el racemato correspondiente a tolterodina o una sal farmacéuticamente aceptable de los mismos, en la fabricación de un medicamento […]
FORMULACIÓN TERAPEÚTICA PARA ADMINISTRAR TOLTERODINA CON LIBERACIÓN CONTROLADA, del 4 de Marzo de 2011, de PFIZER HEALTH AB: Uso de tolterodina, su metabolito 5-hidroximetilo o el racemato correspondiente a tolterodina o una sal farmacéuticamente aceptable de los mismos, en la fabricación de un medicamento […]
FORMULACIONES QUE CONTIENEN SALICILATOS Y SU USO PARA TRATAR LA ENFERMEDAD INFLAMATORIA INTESTINAL, del 4 de Marzo de 2011, de AGI THERAPEUTICS RESEARCH LIMITED: Una composición farmacéutica de liberación modificada que comprende: un salicilato y/o ácido salicílico elegidos entre ácido 4-aminosalicílico, ácido 5- profármacos de […]