PROCEDIMIENTO PARA LA AMPLIFICACIÓN DE ÁCIDOS NUCLEICOS.
Procedimiento homogéneo de detección y amplificación mediante LATE-PCR no simétrica que reduce la dispersión entre ensayos repetidos que comprende:
(i) realizar una reacción de amplificación mediante LATE-PCR que incluye una temperatura de apareamiento de cebadores para generar por lo menos un producto de amplificación monocatenario en presencia de: (a) un molde, (b) un par de cebadores de LATE-PCR que comprende un cebador limitante y un cebador en exceso que se hibridan con sus secuencias diana a la temperatura de apareamiento de cebadores, (c) un tinte de ADN fluorescente que resulta excitable de manera fluorescente cuando se asocia con ADN bicatenario a temperaturas que incluyen, y superiores a, la temperatura de apareamiento de cebadores, (d) por lo menos una sonda de hibridación de baja temperatura marcada de manera fluorescente que se hibrida a dicho por lo menos un producto de amplificación monocatenario a una temperatura inferior a la temperatura de apareamiento de cebadores pero no a la temperatura de apareamiento de cebadores; (ii) detectar los amplicones bicatenarios mediante la señal fluorescente a partir del tinte de ADN a una temperatura a la que dicha por lo menos una sonda no se hibrida con dicho por lo menos un producto de amplificación; (iii) detectar los productos de amplificación monocatenarios mediante la señal o señales fluorescente(s) específica(s) de secuencia a partir de dicha por lo menos una sonda hibridada con dicho por lo menos un amplicón monocatenario a una temperatura o temperaturas inferior(es) a la temperatura de apareamiento de cebadores, y (iv) normalizar las señales calculando una razón entre la fluorescencia del producto o los productos de amplificación monocatenario(s) y la fluorescencia de amplicones bicatenarios, reduciéndose así la dispersión entre repeticiones
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/037667.
Solicitante: BRANDEIS UNIVERSITY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 415 SOUTH STREET WALTHAM, MA MASSACHUSETTS 02454-9110 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WANGH, LAWRENCE J., PIERCE,KENNETH, HARTSHORN,CRISTINA, RICE,JOHN, SANCHEZ,Aquiles,J, SALK,Jesse, REIS,Arthur.
Fecha de Publicación: .
Fecha Solicitud PCT: 17 de Octubre de 2005.
Clasificación Internacional de Patentes:
- C12Q1/68D
Clasificación PCT:
- C07H21/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C12P19/34 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 19/00 Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58). › Polinucleótidos, p. ej. ácidos nucleicos, oligorribonucleótidos.
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2359322_T3.pdf
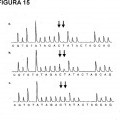



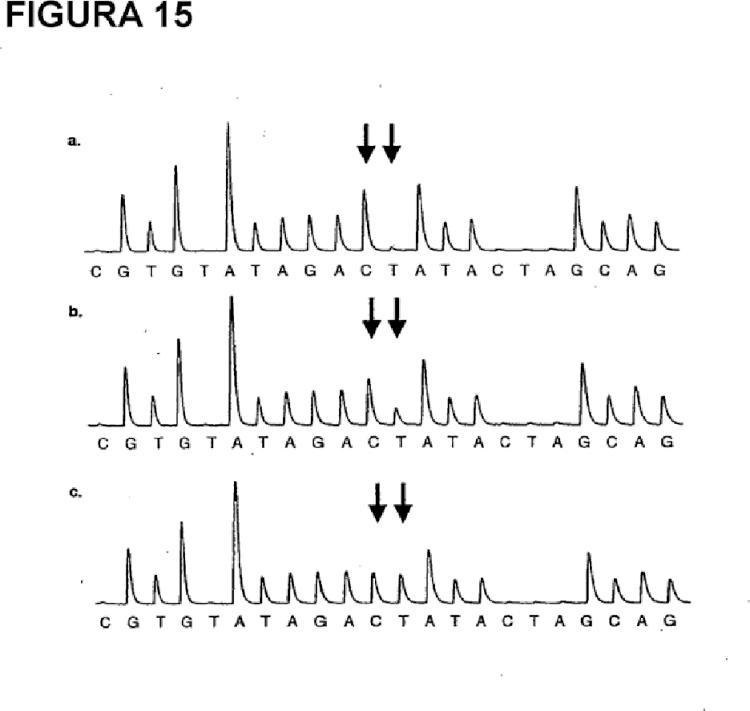
Fragmento de la descripción:
Campo técnico
La presente invención se refiere a reacciones de amplificación de ácidos nucleicos, que incluyen amplificaciones que utilizan la reacción en cadena de la polimerasa, y ensayos que utilizan dichas reacciones en combinación con procedimientos de secuenciación y detección de sondas de hibridación.
Antecedentes
Se bien conocidos los ensayos y técnicas de amplificación de ácidos nucleicos. Algunas reacciones de amplificación son isotérmicas, tales como la amplificación basada en secuencias de ácido nucleico (NASBA). Otras utilizan el ciclado térmico, tales como la reacción en cadena de la polimerasa (PCR). Los ensayos de amplificación preferidos que utilizan detección de fluorescencia de producto amplificado son homogéneos, es decir, no requieren la separación física de reactivos para permitir la detección (por ejemplo, separación de sondas unidas de sondas no unidas) y pueden realizarse en un único recipiente cerrado. Tales ensayos pueden ser de punto final, en el que el producto se detecta tras la amplificación, o pueden ser en tiempo real, en el que el producto se detecta a medida que avanza la amplificación.
La amplificación de ácidos nucleicos y ensayos que utilizan PCR se describen, por ejemplo, en las patentes US nº 4.683.202, nº 4.683.195 y nº 4.965.188, y, de manera general, en PCR PROTOCOLS, a guide to Methods and Applications, Innis et al. eds., Academic Press (San Diego, CA (EE.UU.) 1990). Los ensayos de PCR homogéneos, incluyendo los ensayos en tiempo real, en los que el producto amplificado se detecta durante algunos o todos los ciclos de PCR a medida que avanza la reacción se describen, por ejemplo, en las patentes US nº 5.994.056, nº 5.487.972, nº 5.925.517 y nº 6.150.097.
Generalmente las reacciones de amplificación mediante PCR están destinadas a ser simétricas, es decir, para preparar amplicones bicatenarios exponencialmente utilizando cebador directo y cebador inverso en concentraciones equimolares y a iguales temperaturas de fusión (Tf). Una técnica que ha descubierto una utilización limitada para preparar ADN monocatenario directamente en una reacción de PCR es la “PCR asimétrica”, Gyllensten y Erlich, “Generation of Single-Stranded DNA by the Polymerase Chain Reaction and Its Application to Direct Sequencing of the HLA-DQA Locus”, Proc. Natl. Acad. Sci. (USA) 85: 7652-7656 (1988); y la patente US nº
5.066.584. La PCR asimétrica es un procedimiento de amplificación mediante PCR no simétrica que se diferencia de la PCR simétrica porque uno de los cebadores se diluye de cinco veces a cien veces para estar presente en una cantidad limitante del 1-20 por ciento de la concentración del otro cebador. Como consecuencia, la amplificación consiste en una fase exponencial en la que ambos cebadores se extienden, generando producto, o amplicón, bicatenario seguida por una amplificación lineal en la que sólo queda un cebador, generando amplicón monocatenario.
Más recientemente, se ha desarrollado un procedimiento de amplificación mediante PCR no simétrica conocido como PCR “lineal después de exponencial” o, para abreviar, “LATE-PCR”. LATE-PCR es una amplificación mediante PCR no simétrica que consiste en una fase exponencial en la que ambos cebadores se aparean y se extienden seguida por una fase lineal tras agotarse el cebador limitante, en la que sólo se aparea y se extiende el cebador en exceso. Véase Sanchez et al. (2004) Proc. Natl. Acad. Sci. (USA) 101: 1933-1938, la solicitud de patente internacional publicada WO 03/054233 (3 de julio de 2003), y Pierce et al. (2005) Proc. Natl. Acad. Sci (USA) 102: 8609-8614.
Un procedimiento conveniente y económico para monitorizar la producción de amplicón bicatenario en una amplificación mediante PCR es utilizar un tinte que fluoresce tras intercalarse en, o interaccionar de otro modo con, ADN bicatenario, tal como SYBR Green I o SYBR Gold. Véase, por ejemplo, la patente US nº 5.994.056. Los análisis de la temperatura de fusión de amplicones realizados o bien en tiempo real durante una amplificación mediante PCR
o bien realizados tras la amplificación se utilizan para la identificación del producto. Un problema con la utilización de tales análisis de la temperatura de fusión es que la fluorescencia del tinte depende del tamaño del amplicón. Otro problema es que los tintes se redistribuyen desde los productos de amplificación, o amplicones, que presentan bajas temperaturas de fusión hacia amplicones que presentan temperaturas de fusión superiores durante el análisis, alterando de ese modo los resultados. Se han planteado dos enfoques para solucionar estos problemas. Un enfoque, la extinción de G, impone restricciones estrictas sobre el diseño de cebadores y provoca una gran fluorescencia de fondo (Crockett AO, Wittwer CT. “Fluorescein-Labeled Oligonucleotides for Real-Time PCR: Using the Inherent Quenching of Deoxyguanosine Nucleotides” Anal. Biochem. 290:89-97 (2001)). El otro, la sustitución de tintes SYBR por tinte LC Green, proporciona un porcentaje muy pequeño de señal para secuencias no presentes en abundancia y requiere software y hardware sumamente especializados (Wittwer et al. High-Resolution Genotyping by Amplicon Melting Analysis Using LCGreen”, Clin. Chem. 49:853-860(2003).
Se utilizan sondas marcadas con fluorescente en ensayos de amplificación de ácidos nucleicos homogéneos, incluyendo los ensayos de PCR, para medir la acumulación del amplicón deseado, mediante análisis o bien en tiempo real o bien de punto final. Varios tipos de sondas disponibles discriminan alelos significativamente en comparación con sondas monocatenarias lineales. Las sondas en tiempo real incluyen sondas lineales marcadas de manera doble que se escinden mediante actividad exonucleasa de 5' a 3' de ADN polimerasa durante la etapa de extensión de un ciclo de PCR (véanse las patentes US nº 5.210.015, nº 5.487.972 y nº 5.538.848); sondas de baliza molecular (véanse las patentes US nº 5.925.517, nº 6.103.476 y nº 6.365.729); sondas de unión al surco menor (véase Afonina et al. “Minor Groove Binder-Conjugated DNA Probes for Quantitative DNA Detection by Hybridization-Triggered Fluorescence”, Biotechniques 32: 946-949 (2002)); pares de sondas lineales experimentan FRET cuando se hibridan de manera adyacente en una cadena diana; sondas lineales bicatenarias extinguidas para las que una diana compite para hibridarse con la cadena de sonda marcada (véase Li, Q. et al. (2002), Nucl. Acid. Res. 30: e5); y las denominadas sondas “de iluminación”, que son oligómeros de ácido nucleico peptídico (ANP) unidos a un tinte de cianina asimétrica que fluoresce cuando la sonda se une a una diana para formar una región bicatenaria. Para la LATE-PCR se han utilizado sondas de discriminación de alelos de baja temperatura, tales como sondas de baliza molecular de baja temperatura (véase el documento WO 03/045233). Pueden unirse sondas oligonucleotídicas marcadas a cebadores mediante ligadores de tal manera que durante la amplificación las sondas no se copian sino que están libres para hibridarse con una secuencia diana resultante de la extensión del cebador. Los ejemplos son Scorpions®, cebadores a los que están unidas sondas de baliza molecular, y Anglers®, cebadores a los que están unidas sondas lineales marcadas con fluoróforo. Lee, M.A. et al. (2002), Analytica Clinica Acta 457: 61:70; Whitcombe, D. et al. (1999), Nature Biotechnology 17: 804-807. La parte de sonda de tales estructuras compuestas, que lleva el marcador fluorescente, se hibrida por separado de la parte de cebador. Por tanto, son sondas marcadas y cebadores no marcados, tal como se utilizan esas expresiones en la presente memoria. Sin embargo, las sondas específicas de diana carecen de la capacidad para monitorizar la producción total de productos bicatenarios.
Determinadas sondas toleran el apareamiento erróneo. Las sondas que toleran apareamiento erróneo se hibridan con, y generan una señal detectable para, más de una secuencia diana a una temperatura de detección en un ensayo, y diversos híbridos así formados presentarán diferentes puntos de fusión. Generalmente, las sondas monocatenarias lineales, o espirales al azar, toleran apareamiento erróneo. Los ejemplos de tales sondas son sondas lineales con un resto fluorescente interno cuyo nivel de fluorescencia aumenta tras la hibridación con una u otra cadena diana; sondas lineales marcadas de manera fluorescente utilizadas en combinación con tintes SYBR Gold y SYBR Green I, de tal manera que la fluorescencia del marcador se produce mediante FRET a partir... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento homogéneo de detección y amplificación mediante LATE-PCR no simétrica que reduce la dispersión entre ensayos repetidos que comprende:
(i) realizar una reacción de amplificación mediante LATE-PCR que incluye una temperatura de apareamiento de cebadores para generar por lo menos un producto de amplificación monocatenario en presencia de: (a) un molde, (b) un par de cebadores de LATE-PCR que comprende un cebador limitante y un cebador en exceso que se hibridan con sus secuencias diana a la temperatura de apareamiento de cebadores, (c) un tinte de ADN fluorescente que resulta excitable de manera fluorescente cuando se asocia con ADN bicatenario a temperaturas que incluyen, y superiores a, la temperatura de apareamiento de cebadores, (d) por lo menos una sonda de hibridación de baja temperatura marcada de manera fluorescente que se hibrida a dicho por lo menos un producto de amplificación monocatenario a una temperatura inferior a la temperatura de apareamiento de cebadores pero no a la temperatura de apareamiento de cebadores;
(ii) detectar los amplicones bicatenarios mediante la señal fluorescente a partir del tinte de ADN a una temperatura a la que dicha por lo menos una sonda no se hibrida con dicho por lo menos un producto de amplificación;
(iii) detectar los productos de amplificación monocatenarios mediante la señal o señales fluorescente(s) específica(s) de secuencia a partir de dicha por lo menos una sonda hibridada con dicho por lo menos un amplicón monocatenario a una temperatura o temperaturas inferior(es) a la temperatura de apareamiento de cebadores, y
(iv) normalizar las señales calculando una razón entre la fluorescencia del producto o los productos de amplificación monocatenario(s) y la fluorescencia de amplicones bicatenarios, reduciéndose así la dispersión entre repeticiones.
2. Procedimiento según la reivindicación 1, en el que la sonda de hibridación para dicho por lo menos un producto de amplificación monocatenario es una sonda bicatenaria extinguida de discriminación de alelos, en el que opcionalmente el procedimiento comprende por lo menos dos sondas para diferentes productos de amplificación monocatenarios que están marcadas con el mismo fluoróforo pero presentan diferentes temperaturas de fusión con respecto a sus dianas, en el que dicha etapa de detección a baja temperatura incluye detectar la emisión de dicho fluoróforo a una temperatura a la que sólo una sonda se une a su diana y a una temperatura a la que por lo menos dos sondas se unen a sus respectivas dianas.
3. Procedimiento según la reivindicación 1, en el que (i) la sonda que se hibrida con dicho por lo menos un producto de amplificación monocatenario está marcada con un fluoróforo que se estimula indirectamente mediante emisión de fluorescencia de dicho tinte de ADN fluorescente, y en el que la detección de dicho por lo menos un producto de amplificación monocatenario incluye la estimulación del tinte de ADN fluorescente y la detección de la fluorescencia emitida por dicha sonda; o (ii) el procedimiento comprende por lo menos una sonda de hibridación que tolera apareamiento erróneo que se une a por lo menos dos productos de amplificación monocatenarios posibles para formar híbridos que presentan temperaturas de fusión diferentes inferiores a la temperatura utilizada para aparear cebadores en dicha amplificación y que está marcada con un fluoróforo que se estimula indirectamente mediante emisión de fluorescencia a partir de dicho tinte de ADN fluorescente, en el que la detección del producto monocatenario incluye la detección a baja temperatura a múltiples temperaturas determinadas mediante dichas temperaturas de fusión diferentes.
4. Procedimiento según la reivindicación 3(ii), en el que dicha sonda de hibridación que tolera el apareamiento erróneo es una sonda de hibridación lineal que forma una estructura secundaria que comprende una región bicatenaria de 1-4 nucleótidos de longitud durante dicha detección a baja temperatura, en el que la fluorescencia resultante de dicha estructura secundaria se extingue internamente; y/o en el que dicha sonda de hibridación que tolera el apareamiento erróneo es una sonda de baliza molecular.
5. Procedimiento según la reivindicación 3(ii), que comprende una pluralidad de sondas de hibridación de baja temperatura marcadas de manera fluorescente de manera diferente, cada una de las cuales presenta una temperatura de fusión con respecto a cualquier diana que es inferior a la temperatura de apareamiento de cebadores y que en combinación se hibridan con múltiples posibles secuencias diana, siendo por lo menos dos sondas que toleran el apareamiento erróneo que se hibridan con una pluralidad de posibles dianas a temperaturas diferentes y que presentan fluoróforos que se excitan mediante emisión de fluorescencia de dicho tinte, en el que la detección de los productos de amplificación monocatenarios incluye estimular dicha mezcla de reacción de amplificación a por lo menos tres temperaturas inferiores a dicha temperatura de apareamiento de cebadores con luz que excita el tinte pero no los fluoróforos de dichas sondas que toleran el apareamiento erróneo y detectar las emisiones de las sondas que toleran el apareamiento erróneo.
Patentes similares o relacionadas:
PROCEDIMIENTO DE SÍNTESIS DE ÁCIDO NUCLEICO, del 7 de Diciembre de 2011, de EIKEN KAGAKU KABUSHIKI KAISHA: Un procedimiento para sintetizar ácido nucleico que está provisto en sus extremos 3' y 5' con una región que consta de una región nucleotídica […]
METODO PARA LA REPLICACIÓN, AMPLIFICACIÓN, O SECUENCIACIÓN DE UN ADN MOLDE, del 24 de Noviembre de 2011, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Método para la replicación, amplificación o secuenciación de un ADN molde.La presente invención se encuadra dentro del campo de la biotecnología. Específicamente, […]
 COMPOSICIÓN PARA AMPLIFICAR ÁCIDOS NUCLEICOS, del 23 de Marzo de 2011, de BIORAD PASTEUR: Una composición líquida concentrada y tamponada para amplificar ácidos nucleicos, que comprende al menos un dNTP, al menos una enzima requerida para la amplificación, […]
COMPOSICIÓN PARA AMPLIFICAR ÁCIDOS NUCLEICOS, del 23 de Marzo de 2011, de BIORAD PASTEUR: Una composición líquida concentrada y tamponada para amplificar ácidos nucleicos, que comprende al menos un dNTP, al menos una enzima requerida para la amplificación, […]
 ENSAYOS DE ÁCIDOS NUCLEICOS, del 17 de Enero de 2011, de BIOMERIEUX VITEK, INC.: LA PRESENTE INVENCION TRATA DE LA DETECCION DE SECUENCIAS DE ACIDOS NUCLEICOS ESPECIFICAS, UTILIZANDO O NO UN PROCEDIMIENTO DE AMPLIFICACION DE SECUENCIAS […]
ENSAYOS DE ÁCIDOS NUCLEICOS, del 17 de Enero de 2011, de BIOMERIEUX VITEK, INC.: LA PRESENTE INVENCION TRATA DE LA DETECCION DE SECUENCIAS DE ACIDOS NUCLEICOS ESPECIFICAS, UTILIZANDO O NO UN PROCEDIMIENTO DE AMPLIFICACION DE SECUENCIAS […]
 MOLDES MODIFICADOS MEDIANTE INGENIERIA GENETICA Y SU USO EN AMPLIFICACION DE CEBADOR UNICO, del 13 de Abril de 2010, de ALEXION PHARMACEUTICALS, INC.: Método para amplificar ácido nucleico, que comprende:
a) hibridar un cebador a un molde, presentando el cebador una primera porción que se hibrida al molde […]
MOLDES MODIFICADOS MEDIANTE INGENIERIA GENETICA Y SU USO EN AMPLIFICACION DE CEBADOR UNICO, del 13 de Abril de 2010, de ALEXION PHARMACEUTICALS, INC.: Método para amplificar ácido nucleico, que comprende:
a) hibridar un cebador a un molde, presentando el cebador una primera porción que se hibrida al molde […]
 PROCEDIMIENTO PARA LA AMPLIFICACION DE INFORMACION GENETICA POR MEDIO DE CEBADORES QUE SE UNEN EN VARIOS SITIOS EN EL GENOMA, del 26 de Febrero de 2010, de OLYMPUS LIFE SCIENCE RESEARCH EUROPA GMBH: Procedimiento para la determinación de la frecuencia relativa de unos conjuntos parciales delimitables de un material genético, siendo amplificado el material […]
PROCEDIMIENTO PARA LA AMPLIFICACION DE INFORMACION GENETICA POR MEDIO DE CEBADORES QUE SE UNEN EN VARIOS SITIOS EN EL GENOMA, del 26 de Febrero de 2010, de OLYMPUS LIFE SCIENCE RESEARCH EUROPA GMBH: Procedimiento para la determinación de la frecuencia relativa de unos conjuntos parciales delimitables de un material genético, siendo amplificado el material […]
SONDAS DE DOBLE HEBRA PARA LA DETECCION DE ACIDOS NUCLEICOS, MEDIANTE FLUORESCENCIA, del 5 de Noviembre de 2009, de BIO-RAD PASTEUR: Una sonda de doble hebra, pretendida para la detección de un ácido nucleico diana, de hebra individual, o de hebra doble, mediante fluorescencia, el cual […]
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]