PREPARACIONES DE CLONIDINA.
Gel acuoso tópico adecuado para el alivio del síndrome de dolor neuropático periférico mantenido por vía simpática y que está constituido por clonidina,
agua, una cantidad gelificante en agua de un agente gelificante farmacéuticamente aceptable, y opcionalmente un adyuvante humectante de la piel, un agente que ajusta el pH, conservante(s) y/o anestésico tópico, presentando el agente acuoso tópico un valor de pH fisiológicamente tolerable en el que la clonidina está presente en una cantidad en el intervalo de 0,01 a 0,25 por ciento en peso, basado en el peso del gel
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2000/028776.
Solicitante: ARCION THERAPEUTICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 2400 Boston Street, Suite 330 Baltimore, Maryland 21224 ESTADOS UNIDOS DE AMERICA.
Inventor/es: BORGMAN, ROBERT J.
Fecha de Publicación: .
Fecha Solicitud PCT: 18 de Octubre de 2000.
Clasificación Internacional de Patentes:
- A61K31/165 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo ciclos aromáticos, p. ej. colchicina, atenolol, progabide.
- A61K31/415 A61K 31/00 […] › 1,2-Diazoles.
- A61K31/4168 A61K 31/00 […] › teniendo un átomo de nitrógeno unido en posición 2, p. ej. clonidina.
- A61K47/32 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Compuestos macromoleculares obtenidos por reacciones en las que intervienen solamente enlaces insaturados carbono-carbono, p. ej. carbómeros (resinas de carbopol).
- A61K9/00M3
Clasificación PCT:
- A61K31/415 A61K 31/00 […] › 1,2-Diazoles.
Clasificación antigua:
- A61K31/415 A61K 31/00 […] › 1,2-Diazoles.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2359787_T3.pdf
Fragmento de la descripción:
Campo técnico de la invención
La presente invención se refiere al alivio de los síndromes de dolor neuropático periférico mantenido por vía simpática, y en particular, a unas composiciones en gel que contienen clonidina.
Antecedentes de la invención
Los síndromes de dolor neuropático periférico mantenido por vía simpática de origen agudo o crónico pueden comprender la neuropatía diabética dolorosa (NDD), la neuralgia posherpética (NPH), los síndromes de dolor regional complejo (SDRC) y los síndromes de dolor neuropático crónico no maligno. Los pacientes que presentan síndromes de dolor neuropático periférico mantenido por vía simpática presentan generalmente un dolor independiente de estímulos (en curso) y un dolor dependiente de estímulo (hiperalgesia).
Los tratamientos convencionales para estos síndromes dolorosos incluyen la administración por vía oral de antidepresivos tricíclicos, antiepilépticos y otros agentes neurológicos diferentes. Se ha intentado anteriormente tratar los síndromes de dolor neuropático periférico mantenido por vía simpática con compuestos adrenérgicos como clonidina o fentolamina.
La clonidina, en particular, es un agonista parcial α2-adrenérgico potente utilizado principalmente para el tratamiento de la hipertensión (Jarrott et al., “Clonidine: Understanding its disposition, sites, and mechanism of action”, Clin. Exp. Pharm. Physiol., 14, 471-479 (1987)). Este fármaco estimula los receptores α2-adrenérgicos en los centros vasomotores, que causan una reducción del flujo simpático del sistema nervioso central. Tanto la carga cardíaca como la resistencia periférica se reducen dando como resultado una disminución de la presión sanguínea. Unas concentraciones superiores causan una vasoconstricción mediante la activación de receptores posinápticos en el músculo cardíaco. Sin embargo, las ventajas significativas del fármaco resultan contrarrestadas por unos efectos secundarios molestos que incluyen sequedad de boca y un malestar desalentador. Por lo tanto, la concentración sanguínea de clonidina se puede controlar dentro de un estrecho margen terapéutico.
La clonidina y los agonistas α2-adrenérgicos relacionados han demostrado que modifican la nocicepción en los modelos animales. Ver Yaksh, T.L., “Pharmacology of spinal adrenergic sytems which modulate spinal nociceptive processing”, Pharmacol. Biochem. Behav., 22, 845-858 (1985); y Nakamura et al., “Peripheral analgesic action of clonidine: mediation by release of endogenous enkephalin-like substances”, Eur. J. Pharmacol., 146, 223-228 (1988). En estudios clínicos, las dosis unitarias de clonidina epidural han demostrado que alivian el dolor postoperatorio (Mendez et al., “Epidural clonidine analgesia alter cesarean sectios”, Anesthesiology, 73, 848-852 (1990)), cancer pain (Eisenach et al., “Epidural clonidine analgesia for intractable cancer pain: phase I”, Anesthesiology, 71, 647-552 (1989)), y el dolor debido a la aracnoiditis (Glynn et al., “A double-blind comparison between epidural morphine and epidural clonidine in patients with chronic non-cancer pain”, Pain, 34, 123-128 (1988)).
En un ensayo controlado con dosis únicas orales de 0,2 miligramos (mg) de clonidina en 40 pacientes con neuralgia posherpética, el alivio del dolor observado fue superior al producido por dosis de placebo o por 120 mg de codeína, pero la analgesia moderada presentó unos niveles algo problemáticos de sedación y mareos en el momento de los niveles pico de la clonidina. (Max et al., “Association of pain relief with drug side effects in posherpetic neuralgia: a single-dose study of clonidine, codeíne, ibuprofen and placebo”, Clin. Pharamacol. Ther., 43, 363-371 (1988)).
Se ha intentado aliviar el dolor, la alodinia y la hiperalgesia utilizando unos parches transdérmicos que contienen clonidina, pero los efectos conseguidos se limitaron a la piel que se encuentra por debajo del parche. La hiperalgesia se define como un cambio hacia a la izquierda de la función estímulo respuesta, se observan fenómenos como la disminución del umbral del dolor o un incremento del estímulo del dolor o ambos efectos. La disminución del umbral del dolor a los estímulos mecánicos o térmicos puede ser de modo que golpeando ligeramente la piel manifiesta dolor, un fenómeno al que algunas veces se hace referencia como alodinia.
Por ejemplo, Davis et al., en “Topical application of clonidine relieves hyperalgesia in patients with sympathetically maintained pain”, Pain, 47, 309-318 (1991) describen que la liberación de clonidina mediante unos parches transdérmicos alivia la hiperalgesia mantenida por vía simpática en la piel adyacente al parche.
De forma similar, Campbell en la patente US nº 5.447.947 describe el alivio de la hiperalgesia con unos parches transdérmicos que liberan una dosis sistémica de 0,2 mg y 0,3 mg de clonidina/día (es decir, 30 microgramos/centímetro cuadrado/día), pero la zona de alivio se limitó generalmente al área de la piel del parche o de la zona adyacente al mismo produciendo una irritación de la piel que circunda el parche y se manifestaron unos efectos adversos.
En un ensayo cruzado controlado con placebo del dolor en pacientes con neuropatía diabética dolorosa que utiliza parches transdérmicos de clonidina no se observaron diferencias estadísticamente significativas entre los tratamientos en Zeigler et al., “Transdermal clonidine versus placebo in painful diabetic neuropathy”, Pain, 48, 403408 (1992). En un estudio de control con placebo controlado del dolor en pacientes similares con neuropatía diabética dolorosa, los parches transdérmicos de clonidina se evaluaron utilizando un diseño de inclusión enriquecido de dos etapas por Byas-Smith et al., “Transdermal clonidine compared to placebo in painful diabetic neuropathy using two-stage enriched enrollment' design”, Pain, 60, 267-274 (1995). Sólo doce de los cuarenta y un pacientes (29%) que completaron el curso inicial del tratamiento fueron considerados como respondedores a clonidina. Estos doce respondedores a clonidina se reintrudujeron en un segundo estudio controlado con placebo que utiliza la dosificación más elevada disponible con el sistema de parche transdérmico. La reducción del dolor relativa al placebo tendió a ser modesta a pesar de que fue estadísticamente significativa (p < 0,015).
Sobre la base de los intentos realizados puede parecer que resulten necesarias unas concentraciones relativamente superiores de clonidina en el punto dolorido. Desafortunadamente, con las formas farmacéuticas utilizadas, no se pueden proporcionar unas dosis superiores sin unos efectos adversos sistémicos no deseados. Aunque la clonidina es un fármaco analgésico potente deseable, presenta un margen terapéutico estrecho.
Un tratamiento deseable para los síndromes de dolor neuropático periférico mantenido por vía simpática, puede ser una composición tópica de clonidina que se puede extender por toda la zona dolorida para liberar unas concentraciones altas dirigidas al punto dolorido aunque sea obteniendo unas concentraciones sistémicas mínimas.
La composición en gel presente cubre la necesidad de liberar unas cantidades terapéuticamente eficaces de clonidina directamente a la zona afectada de los pacientes que sufren unos síndromes de dolor neuropático periférico por vía simpática al mismo tiempo que se evitan los efectos sistémicos indeseables.
Sumario de la invención
En un aspecto, la presente invención proporciona un gel acuoso tópico adecuado para aliviar el síndrome de dolor neuropético periférico mantenido por vía simpática y está constituido por clonidina, agua, y una cantidad gelificante en agua de un agente gelificante farmacéuticamente aceptable y opcionalmente un adyuvante humectante de la piel, un agente para ajustar el pH, conservante(s), y/o un anestésico tópico; presentando el gel acuoso tópico un valor de pH tolerable fisiológicamente en el que la clonidina está presente en una cantidad en el intervalo de aproximadamente 0,01 a aproximadamente 0,25 por ciento en peso, basado en el peso del gel.
En otro aspecto, la presente invención proporciona la utilización de la clonidina, una cantidad gelificante en agua de un agente gelificante farmacéuticamente aceptable para la preparación de un gel acuoso que presenta un valor de pH fisiológicamente tolerable para el alivio de los síndromes de dolor neuropético periférico... [Seguir leyendo]
Reivindicaciones:
1. Gel acuoso tópico adecuado para el alivio del síndrome de dolor neuropático periférico mantenido por vía simpática y que está constituido por clonidina, agua, una cantidad gelificante en agua de un agente gelificante farmacéuticamente aceptable, y opcionalmente un adyuvante humectante de la piel, un agente que ajusta el pH, conservante(s) y/o anestésico tópico, presentando el agente acuoso tópico un valor de pH fisiológicamente tolerable en el que la clonidina está presente en una cantidad en el intervalo de 0,01 a 0,25 por ciento en peso, basado en el peso del gel.
2. Gel acuoso tópico según la reivindicación 1, en el que la clonidina está presente en una cantidad en el intervalo de 0,01 a 0,075 por ciento en peso, basado en el peso del gel.
3. Gel acuoso tópico según la reivindicación 1, en el que el valor de pH del gel se encuentra en el intervalo de 4 a 9.
4. Gel acuoso tópico según la reivindicación 1, en el que el valor de pH del gel se encuentra en el intervalo de 6 a 8,5.
5. Gel acuoso tópico según la reivindicación 1, en el que el valor de pH del gel es de aproximadamente 8.
6. Gel acuoso tópico según la reivindicación 1 que incluye además un conservante.
7. Gel acuoso tópico según la reivindicación 6, en el que el conservante es el alcohol bencílico.
8. Gel acuoso tópico según la reivindicación 6, en el que el conservante es un compuesto parabeno.
9. Gel acuoso tópico según la reivindicación 6, en el que el conservante es el fenoxietanol.
10. Gel acuoso tópico según la reivindicación 1 que incluye además un anestésico tópico.
11. Gel acuoso tópico según la reivindicación 10, en el que el anestésico tópico es la lidocaína.
12. Gel acuoso tópico según la reivindicación 1, en el que el agente gelificante es un carbómero.
13. Gel acuoso tópico según la reivindicación 12 que incluye además poliacrilato de glicerina como una porción menor del agente gelificante.
14. Gel acuoso tópico según la reivindicación 1, en el que el agente gelificante es el poliacrilato de glicerina.
15. Gel acuoso tópico según la reivindicación 1 que incluye además un adyuvante humectante de la piel seleccionado de entre el grupo constituido por alcoholes polihídricos y poligliceroles.
16. Gel acuoso tópico según la reivindicación 1, en el que por lo menos parte de la clonidina está presente como clorhidrato de clonidina.
17. Gel acuoso tópico según la reivindicación 1, en el que la clonidina está presente tanto como clorhidrato de clonidina como clonidina base libre.
18. Utilización de la clonidina y de una cantidad gelificante en agua de un agente gelificante farmacéuticamente aceptable para la preparación de un gel acuoso que presenta un valor de pH fisiológicamente tolerable para el alivio de los síndromes de dolor neuropático periférico mantenido por la vía simpática, en la que la clonidina está presente en el gel acuoso en una cantidad en el intervalo de 0,01 a 0,25 por ciento en peso, basado en el peso del gel, y el gel acuoso se aplica tópicamente en una cantidad que alivia el dolor en la zona afectada de un paciente que padece este dolor, y el gel acuoso está constituido por clonidina, agua, una cantidad gelificante en agua de un agente gelificante farmacéuticamente aceptable y opcionalmente un adyuvante humectante de la piel , un agente que ajusta el pH, conservante(s) y/o un anestésico tópico.
19. Utilización según la reivindicación 18, en la que el gel acuoso se aplica por lo menos una vez al día.
20. Utilización según la reivindicación 18, en la que el gel acuoso se aplica de dos a cuatro veces al día.
21. Utilización según la reivindicación 18, en la que la cantidad aplicada de clonidina se encuentra en el intervalo de 0,1 miligramos al día a 6 miligramos al día.
22. Utilización según la reivindicación 18, en la que después de la aplicación sobre la zona afectada el gel acuoso es friccionado.
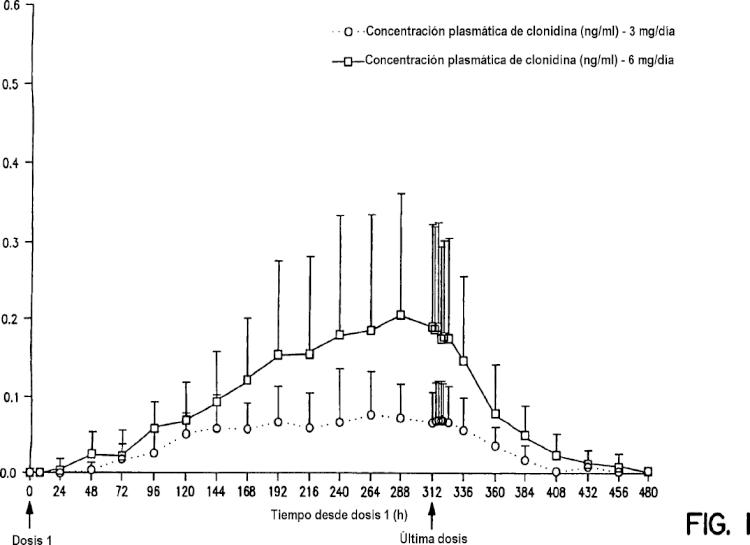
23. Utilización según la reivindicación 18, en la que la cantidad de gel acuoso aplicada es suficiente para producir una concentración en plasma sanguíneo de clonidina no superior a aproximadamente 0,2 nanogramos por mililitro.
Patentes similares o relacionadas:
Uso de principios activos refrescantes fisiológicos y agentes que contienen tales principios activos, del 17 de Junio de 2020, de Symrise AG: Procedimiento no terapéutico para la modulación in-vitro del receptor de mentol frío TRPM8, en el que se lleva a contacto el receptor con al menos un modulador, que se selecciona […]
Moléculas químicas que inhiben el mecanismo de corte para tratar enfermedades causadas por anomalías de empalme, del 17 de Junio de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (C.N.R.S.): Un compuesto elegido entre el grupo que comprende: • N-(3-Dimetilamino-propil)-3-(4-trifluorometoxi-fenilamino)-benzamida; • 4-(4-Metoxi-fenilamino)-3-metil-N-(3-metil-butil)-benzamida; […]
Sales cristalinas de un profármaco de dextroanfetamina, del 6 de Mayo de 2020, de SANDOZ AG: Una sal cristalina de L-lisina-d-anfetamina representada por la estructura química como se representa en la fórmula (II) **(Ver fórmula)** […]
Composición farmacéutica inyectable estable de antagonista del receptor de neuroquinina-1 y procedimiento para su preparación, del 29 de Abril de 2020, de PHARMATHEN S.A.: Una composición farmacéutica de liberación controlada para administración intramuscular o subcutánea que comprende Aprepitant o Fosaprepitant […]
Combinaciones de moduladores duales de IRS/STAT3 y agentes anticancerígenos para el tratamiento del cáncer, del 29 de Abril de 2020, de TyrNovo Ltd: Una composición farmacéutica que comprende un inhibidor de EGFR y/o un anticuerpo EGFR en combinación con un compuesto representado por la estructura […]
Implantes intraoculares que contienen prostamida y métodos de uso de éstos, del 1 de Abril de 2020, de ALLERGAN, INC.: Implante intraocular biodegradable, comprendiendo el implante una matriz de polímero biodegradable, polietilen glicol 3350, y una prostamida como el […]
Formulaciones de 15-hidroxiestearato de macrogol, del 25 de Diciembre de 2019, de ALLERGAN, INC.: Composición oftálmica que comprende un principio activo farmacéutico en una cantidad suficiente para contribuir al tratamiento, la prevención o reducción […]
Inhibidores de benzimidazol del canal de sodio, del 18 de Diciembre de 2019, de Zalicus Pharmaceuticals Ltd: Un compuesto seleccionado del grupo que consiste en **(Ver fórmula)** o una sal o solvato farmacéuticamente aceptable del mismo.