Mutantes de la citidina desaminasa inducida por activación (AID) y procedimientos de uso.
Una molécula de ácido nucleico aislada o purificada que comprende una secuencia de nucleótidos que codifica una citidina desaminasa inducida por activación (AID) mutante funcional cuya secuencia de aminoácidos difiere de la secuencia de aminoácidos de una proteína AID humana (SEC ID Nº 1 o SEC ID Nº 2) en al menos una sustitución de aminoácido seleccionada de:
(a) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 34, 82 y 156,
(b) en al menos una sustitución de aminoácidos en el residuo y al menos una sustitución de aminoácidos en el residuo 156,
(c) en al menos una sustitución de aminoácidos en el residuo 35 y al menos una sustitución de aminoácidos en el residuo 145,
(d) en al menos una sustitución de aminoácidos en el residuo 34 y al menos una sustitución de aminoácidos en el residuo 160,
(e) en al menos una sustitución de aminoácidos en el residuo 43 y al menos una sustitución de aminoácidos en el residuo 120,
(f) al menos dos sustituciones de aminoácidos en las que al menos una sustitución está en el residuo 57 y al menos una sustitución está en el residuo 81 o 145,
(g) en al menos una sustitución de aminoácidos en el residuo 156 y al menos una sustitución de aminoácidos en el residuo 82,
(h) en al menos una sustitución de aminoácidos en el residuo 156 y al menos una sustitución de aminoácidos en el residuo 34,
(i) en al menos una sustitución de aminoácidos en el residuo 156 y al menos una sustitución de aminoácidos en el residuo 157,
(j) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 10, 82 y 156,
(k) en al menos una sustitución de aminoácidos en el residuo 115, y (l) en al menos una sustitución de aminoácidos en el residuo 120, en la que la proteína AID mutante funcional tiene al menos una mejora de 10 veces la actividad en comparación con la proteína AID humana en un ensayo de papilación bacteriana.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2010/000958.
Solicitante: MEDICAL RESEARCH COUNCIL.
Nacionalidad solicitante: Reino Unido.
Dirección: 20 PARK CRESCENT LONDON W1B 1AL REINO UNIDO.
Inventor/es: NEUBERGER,MICHAEL, WANG,MENG, YANG,ZIZHEN, RADA,CRISTINA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- C12N15/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K).
- C12N5/00 C12N […] › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12N9/78 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre los enlaces carbono-nitrógeno distintos a los enlaces peptídicos (3.5).
PDF original: ES-2498765_T3.pdf

Fragmento de la descripción:
Mutantes de la citidina desaminasa inducida por activación (AID) y procedimientos de uso Antecedentes de la invención Los mecanismos naturales de generación de diversificación de anticuerpos explotan el proceso de la hipermutación somática (HMS) para desencadenar la evolución de las regiones variables de inmunoglobulina, de modo que se generan rápidamente el repertorio de anticuerpos secundarios asociados con la respuesta humoral. La HMS in vivo representa un proceso altamente eficiente que es capaz de explorar rápidamente estructuras plegadas productivas y desarrollar anticuerpos de alta afinidad de un modo que representa el proceso natural para la optimización de anticuerpos. Por tanto, ha existido un interés significativo en intentar replicar la HMS in vitro para crear un simple proceso sólido que podría imitar los procesos naturales de la maduración de la afinidad directamente en un contexto de células de mamífero para seleccionar y desarrollar anticuerpos inmunogénicamente tolerados y altamente expresados en células de mamífero (Cumbers et al., Nat Biotechnol., 20 (11) : 1129 -1134 (2002) ; Wang et al., Prot. Eng. Des. Sel., 17 (9) : 569 -664 (2004) ; Wang et al., Proc. Natl. Acad. Sci. USA., 101 (48) : 16745 -16749 (2004) ; Ruckerl et al., Mol. Immunol., 43 (10) : 1645 -1652 (2006) ; Todo et al., J. Biosci. Bioeng., 102 (5) : 478 -81 (2006) ; Arakawa et al., Nucleic Acids Res., 36 (1) : e1 (2008) ) .
No obstante, los anticuerpos nativos que se han aislado de un ser humano o animal individual a menudo fracasan a la hora de demostrar propiedades de afinidad óptimas porque un techo de afinidad intrínseca inherente al sistema inmunológico previene la discriminación in vivo, y por tanto la selección, de anticuerpos con afinidades más potentes que aproximadamente 100 pM (Batista and Neuberger, Immunity, 8 (6) : 751 -91998, (1998) and EMBO J., 19 (4) : 513 -20 (2000) .
El uso de bibliotecas de expresión en fagos puede abordar algunos de estos problemas y se ha demostrado que los abordajes basados en la expresión en fagos son capaces de producir de forma rutinaria anticuerpos de alta afinidad. No obstante, desde una perspectiva teórica, dichas bibliotecas estáticas están limitadas de forma inherente en su tamaño y alcance porque las bibliotecas más grandes (1012) únicamente pueden explorar una pequeña fracción del potencial repertorio inmunológico innato. Adicionalmente, no es posible codesarrollar de forma simultánea anticuerpos a través de abordajes de expresión en fagos en base a una buena expresión en mamíferos y a una afinidad elevada, lo que conduce a potenciales problemas de fabricación cadena abajo que sean el resultado de la por otro lado mala expresión en células huésped de mamífero. Adicionalmente, el uso de mutagénesis aleatoria en combinación con expresión en fagos carece de un perfil de selectividad inherente hallado en los procesos naturales de la maduración de la afinidad de los anticuerpos, lo que a menudo da lugar a problemas de inmunidad humana antihumana o perfiles de reactividad cruzada indeseables.
El uso de una línea celular cultivada para desarrollar un anticuerpo frente a un antígeno diana específico usando hipermutación somática in Vitro se demostró primero usando la línea celular de linfoma de Burkitt humano Cumbers et al., Nat. Biotechnol., 20 (11) : 1129 -1134 (2002) ) . Ramos, y otras líneas de linfocitos B, también se han usado con éxito para desarrollar genes que no son de anticuerpos que se han integrado aleatoriamente en el ADN cromosómica de la célula huésped (Wang et al., Prot. Eng. Des. Sel., 17 (9) : 569 -664 (2004) y Proc. Natl. Acad. Sci. USA., 101 (48) : 16745 -16749 (2004) ) . Adicionalmente, se ha demostrado una hipermutación somática eficiente en genes que no son de anticuerpos en líneas de linfocitos B usando vectores episomales, con o sin elementos reguladores en cis específicos de Ig (Ruckerl et al., Mol. Immunol., 43 (10) : 1645 -1652 (2006) ) . Aunque algunas líneas celulares de Ramos muestran tasas relativamente altas de hipermutación constitutiva, las líneas de linfocitos B en general muestran tasas relativamente lentas de división celular y son difíciles de transfectar con una eficiencia elevada, lo que limita su utilidad práctica para una evolución dirigida.
La línea celular de linfocitos B de la bolsa de Fabricio de pollo, DT40, diversifica su gen ligero de Ig reordenado mediante conversión génica del molde del seudogen V. No obstante, si la conversión génica se bloquea mediante la deleción del parálogo Rad51, XRCC2 (Sale et al., Nature, 412: 921 -6 (2001) o la deleción de los donantes de conversión del seudogen (Arakawa et al., Nucleic Acids Res., 36 (1) : e1 (2008) ) , la línea celular expresa hipermutación constitutiva en cultivo. Por comparación con las células de Ramos, las células DT40 tienen un tiempo de generación significativamente más corto (12 horas) , son susceptibles a ser dianas génicas dirigidas y se han usado con éxito para la evolución dirigida tanto de anticuerpos endógenos (Seo et al., Nat. Biotechnol., 23 (6) : 731 -5 (2005) ; Nat. Protoc., 1 (3) : 1502 -6 (2006) ; Biotechnol. Genet. Eng. Rev., 24: 179 -93 (2007) ; Todo et al., J. Biosci. Bioeng., 102 (5) : 478 -81 (2006) ) como de proteínas que no son anticuerpos (Arakawa et al., Nucleic Acids Res., 36 (1) : e1 (2008) ) .
Aunque los derivados de linfocitos B, tales como RAMOS y DT40, se han usado con éxito para la evolución dirigida, el uso fiable de estas células es un proceso sólido para la evolución dirigida se complica con una serie de factores, incluidos: (i) la necesidad de insertar el gen de interés en un sitio definido en el locus Ig de la célula huésped con el fin de alcanzar un nivel elevado de mutagénesis (Parsa et al., Mol Immunol., 44 (4) : 567 -75 (2007) , y (ii) la biología natural compleja de la hipermutación somática que actúa en los loci de inmunoglobulinas endógenos en estas células. Adicionalmente, dichas líneas celulares modificadas genéticamente exhiben una inestabilidad clonal significativa en los índices de HMS (Zhang et al., Int. Immunol., 13: 1175 -1184 (2001) , Martin et al., Proc. Natl. Acad. Sci. USA., 99 (19) : 12304 -12308 (2002) and Nature, 415 (6873) : 802 -806 (2002) ; Ruckerl et al., Mol.
Immunol., 41: 1135 -1143 (2004) ) , y no proporcionan ningún medio simple para regular o controlar la hipermutación, es decir pasar a mutagénesis después de la selección de un fenotipo deseado.
El uso de linfocitos no B para iniciar la hipermutación somática dirigida en un gen de interés se ha descrito con éxito en una serie de grupos (Martin et al., Proc. Natl. Acad. Sci. USA., 99 (19) : 12304 -12308 (2002) and Nature, 415 (6873) : 802 -806 (2002) ; McBride et al., Proc. Natl. Acad. Sci. USA, 103 (23) : 8798 -803 (2006) ; Jovanic et al., PLoS ONE, 23;3 (1) : e1480 (2008) ; publicación de la solicitud de patente de EE.UU. 09/0075378; publicaciones solicitud de patente internacional WO 08/103474A1 y WO 08/103475A1) , y estas líneas celulares también proporcionan una transferencia génica eficiente, nivel elevado de expresión proteica, características de crecimiento óptimas y son fácilmente sensibles al cultivo en suspensión y citometría de flujo.
La citidina desaminasa inducida por activación (AID) pertenece a la familia APOBEC de las enzimas citidina desaminasas. La AID se expresa en los linfocitos B activados y es necesaria para iniciar la hipermutación somática (Muramatsu et al., Cell, 102 (5) : 553 -63 (2000) ; Revy et al., Cell, 102 (5) : 565 -75 (2000) ; Yoshikawa et al., Science, 296 (5575) : 2033 -6 (2002) ) creando mutaciones puntuales en el ADN subyacente que codifica los genes de anticuerpos (Martin et al., Proc. Natl. Acad. Sci. USA., 99 (19) : 12304 -12308 (2002) y Nature, 415 (6873) : 802 -806 (2002) ; Petersen-Mart et al., Nature, 418 (6893) : 99 -103 (2002) ) . La AID también es un factor proteico esencial para la recombinación por cambio de clase y la conversión génica (Muramatsu et al., Cell, 102 (5) : 553 -63 (2000) ; Revy et al., Cell, 102 (5) : 565 -75 (2000) ) .
El descubrimiento de que la AID es responsable de iniciar la hipermutación somática ha abierto la posibilidad de usar líneas celulares no linfocitos B para crear sistemas más definidos, estables y controlables para usar la hipermutación somática.
A pesar de estos avances, todavía existen los principales retos en lo que respecta al desarrollo de un sistema práctico para la hipermutación somática, incluyendo (1) la capacidad para dirigir la hipermutación somática a un gen de interés y lejos de los genes estructurales, (2) las tasas relativamente bajas y la naturaleza de las mutaciones alcanzadas usando AID exógena en comparación con la hipermutación somática in vivo... [Seguir leyendo]
Reivindicaciones:
1. Una molécula de ácido nucleico aislada o purificada que comprende una secuencia de nucleótidos que codifica una citidina desaminasa inducida por activación (AID) mutante funcional cuya secuencia de aminoácidos difiere de la secuencia de aminoácidos de una proteína AID humana (SEC ID Nº 1 o SEC ID Nº 2) en al menos una sustitución de aminoácido seleccionada de:
(a) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 34, 82 y 156,
(b) en al menos una sustitución de aminoácidos en el residuo 10 y al menos una sustitución de aminoácidos en el residuo 156,
(c) en al menos una sustitución de aminoácidos en el residuo 35 y al menos una sustitución de aminoácidos en el residuo 145,
(d) en al menos una sustitución de aminoácidos en el residuo 34 y al menos una sustitución de aminoácidos en el residuo 160,
(e) en al menos una sustitución de aminoácidos en el residuo 43 y al menos una sustitución de aminoácidos en el residuo 120,
(f) al menos dos sustituciones de aminoácidos en las que al menos una sustitución está en el residuo 57 y al menos una sustitución está en el residuo 81 o 145,
(g) en al menos una sustitución de aminoácidos en el residuo 156 y al menos una sustitución de aminoácidos en el residuo 82,
(h) en al menos una sustitución de aminoácidos en el residuo 156 y al menos una sustitución de aminoácidos en el residuo 34,
(i) en al menos una sustitución de aminoácidos en el residuo 156 y al menos una sustitución de aminoácidos en el residuo 157,
(j) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 10, 82 y 156,
(k) en al menos una sustitución de aminoácidos en el residuo 115, y
(l) en al menos una sustitución de aminoácidos en el residuo 120,
en la que la proteína AID mutante funcional tiene al menos una mejora de 10 veces la actividad en comparación con la proteína AID humana en un ensayo de papilación bacteriana.
2. La molécula de ácido nucleico aislada o purificada de la reivindicación 1, en la que la proteína AID mutante funcional comprende una sustitución de aminoácidos en el residuo 34.
3. La molécula de ácido nucleico aislada o purificada de la reivindicación 2, en la que la sustitución de aminoácidos en el residuo 34 es K34E o K34D.
4. La molécula de ácido nucleico aislada o purificada de una cualquiera de las reivindicaciones 1-3, en la que la proteína AID mutante funcional comprende una sustitución de aminoácidos en el residuo 82.
5. La molécula de ácido nucleico aislada o purificada de la reivindicación 4, en la que la sustitución de aminoácidos en el residuo 82 es T82I o T82L.
6. La molécula de ácido nucleico aislada o purificada de una cualquiera de las reivindicaciones 1-5, en la que la proteína AID mutante funcional comprende una sustitución de aminoácidos en el residuo 156.
7. La molécula de ácido nucleico aislada o purificada de la reivindicación 6, en el que la sustitución de aminoácidos en el residuo 156 es E156G o E156A.
8. La molécula de ácido nucleico aislada o purificada de una cualquiera de las reivindicaciones 2-7, en la que la proteína citidina desaminasa inductiva por activación (AID) mutante funcional comprende además al menos una sustitución de aminoácidos en el residuo 157.
9. La molécula de ácido nucleico aislada o purificada de la reivindicación 8, en la que la sustitución de aminoácidos en el residuo 157 es treonina (T) o lisina (K) .
10. La molécula de ácido nucleico aislada o purificada de la reivindicación 8 o la reivindicación 9,
en la que la proteína AID mutante funcional comprende además uno o más de los siguientes:
(a) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 9, 38 y 180,
(b) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 42, 115, 132, 183, y 198,
(c) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 9, 96 y 181, y
(d) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en el residuo
y el residuo 197,
11. La molécula de ácido nucleico aislada o purificada de la reivindicación 10, en la que
(a) la sustitución del aminoácido en el residuo 9 es metionina (M) o lisina (K) ,
(b) la sustitución del aminoácido en el residuo 13 es fenilalanina (F) o triptófano (W) ,
(c) la sustitución de aminoácido en el residuo 38 es glicina (G) o alanina (A) .
(d) la sustitución de aminoácido en el residuo 42 es isoleucina (I) o leucina (L) .
(e) la sustitución de aminoácido en el residuo 96 es glicina (G) o alanina (A) .
(f) la sustitución del aminoácido en el residuo 115 es tirosina (Y) o triptófano (W) ,
(g) la sustitución de aminoácido en el residuo 132 es ácido glutámico (E) o ácido aspártico (D) ,
(h) la sustitución de aminoácido en el residuo 180 es isoleucina (I) o alanina (A) .
(i) la sustitución del aminoácido en el residuo 181 es metionina (M) o valina (V) ,
(j) la sustitución de aminoácido en el residuo 183 es isoleucina (I) o prolina (P) .
(k) la sustitución del aminoácido en el residuo 197 es arginina (R) o lisina (K) , y
(l) la sustitución de aminoácido en el residuo 198 es valina (V) o leucina (L) .
12. La molécula de ácido nucleico aislada o purificada de la reivindicación 1, en el que la proteína AID mutante funcional comprende una sustitución de aminoácidos en el residuo 10 y una sustitución de aminoácido en el residuo 156.
13. La molécula de ácido nucleico aislada o purificada de la reivindicación 12, en la que el aminoácido en el residuo 10 está sustituido con ácido glutámico (E) o ácido aspártico (D) y el aminoácido en el residuo 156 está sustituido con glicina (G) o alanina (A) .
14. La molécula de ácido nucleico aislada o purificada de la reivindicación 12 o la reivindicación 13, en la que la proteína AID mutante funcional comprende al menos una sustitución adicional de aminoácidos en un residuo seleccionado del grupo que consiste en los residuos 13, 34, 82, 95, 115, 120, 134 y 145.
15. La molécula de ácido nucleico aislada o purificada de la reivindicación 14, en la que
(a) la sustitución del aminoácido en el residuo 13 es fenilalanina (F) o triptófano (W) ,
(b) la sustitución de aminoácido en el residuo 34 es ácido glutámico (E) o ácido aspártico (D) ,
(c) la sustitución de aminoácido en el residuo 82 es isoleucina (I) o leucina (L) .
(d) la sustitución de aminoácido en el residuo 95 es serina (S) o leucina (L) .
(e) la sustitución del aminoácido en el residuo 115 es tirosina (Y) o triptófano (W) ,
(f) la sustitución del aminoácido en el residuo 120 es arginina (R) o asparagina (N) , y
(g) la sustitución de aminoácido en el residuo 145 es leucina (I) o isoleucina (I) .
16. Una molécula de ácido nucleico aislada o purificada que comprende una secuencia de nucleótidos que codifica una citidina desaminasa inducida por activación (AID) mutante funcional cuya secuencia de aminoácidos difiere de la secuencia de aminoácidos de una proteína AID humana (SEC ID Nº 1 o SEC ID Nº 2) en al menos una sustitución de aminoácido seleccionada de:
(a) una sustitución de aminoácidos en el residuo 35 y una sustitución de aminoácidos en el residuo 145,
(b) una sustitución de aminoácidos en el residuo 34 y una sustitución de aminoácidos en el residuo 160,
(c) una sustitución de aminoácidos en el residuo 43 y una sustitución de aminoácidos en el residuo 120,
(d) al menos dos sustituciones de aminoácidos en las que una sustitución está en el residuo 57 y una sustitución está en el residuo 81 o 145,
(e) una sustitución de aminoácidos en el residuo 156 y una sustitución de aminoácidos en el residuo 82,
(f) una sustitución de aminoácidos en el residuo 156 y una sustitución de aminoácidos en el residuo 34, y
(g) una sustitución de aminoácidos en el residuo 156 y una sustitución de aminoácidos en el residuo 157.
17. La molécula de ácido nucleico aislada o purificada de la reivindicación 16, en la que
(a) el aminoácido en el residuo 35 está sustituido con glicina (G) o alanina (A) y el aminoácido en el residuo 145 está sustituido con leucina (L) o isoleucina (I) .
(b) el aminoácido en el residuo 34 está sustituido con ácido glutámico (E) o ácido aspártico (D) y el aminoácido en el residuo 160 está sustituido con ácido glutámico (E) o ácido aspártico (D) .
(c) el aminoácido en el residuo 43 está sustituido con prolina (P) y el aminoácido en el residuo 120 está sustituido con arginina (R) ,
(d) el aminoácido en el residuo 156 está sustituido con glicina (G) o alanina (A) y el aminoácido en el residuo 82 está sustituido con leucina (L) o isoleucina (I) ,
(e) el aminoácido en el residuo 156 está sustituido con glicina (G) o alanina (A) y el aminoácido en el residuo 34 está sustituido con ácido glutámico (E) o ácido aspártico (D) , y
(f) el aminoácido en el residuo 156 está sustituido con glicina (G) o alanina (A) y el aminoácido en el residuo 157 está sustituido con lisina (K) o asparagina (N) ,
18. La molécula de ácido nucleico aislada o purificada de la reivindicación 16, en la que al menos dos sustituciones
de aminoácidos están en los residuos 57 y 145.
19. La molécula de ácido nucleico aislada o purificada de la reivindicación 18, en la que el aminoácido en el residuo 57 está sustituido con glicina (G) o alanina (A) y el aminoácido en el residuo 145 está sustituido con leucina (L) o isoleucina (I) .
20. La molécula de ácido nucleico aislada o purificada de la reivindicación 16, en la que al menos dos sustituciones de aminoácidos están en los residuos 57 y 81.
21. La molécula de ácido nucleico aislada o purificada de la reivindicación 20, en la que el aminoácido en el residuo 57 está sustituido con glicina (G) o alanina (A) y el aminoácido en el residuo 81 está sustituido con tirosina (T) o triptófano (W) .
22. Una molécula de ácido nucleico aislada o purificada que comprende una secuencia de nucleótidos que codifica una citidina desaminasa inducida por activación (AID) mutante funcional cuya secuencia de aminoácidos difiere de la secuencia de aminoácidos de una proteína AID humana (SEC ID Nº 1 o SEC ID Nº 2) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 10, 82 y 156.
23. La molécula de ácido nucleico aislada o purificada de la reivindicación 22, en el que la proteína AID mutante funcional comprende adicionalmente uno o más de los siguientes:
(a) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 9, 36, 44, 88, 93, y 142,
(b) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 66, 104 y 160,
(c) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 15, 115 y 185,
(d) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 9, 30, 34, 100, y 184,
(e) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 34, 35, 59, 120, y 157,
(f) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 9, 74, 77, 118, 157, y 188,
(g) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en el residuo 53 y el residuo 145, y
(h) en al menos una sustitución de aminoácidos en un residuo seleccionado del grupo que consiste en los residuo 18, 93, 100, 160, y 192.
24. La molécula de ácido nucleico aislada o purificada de la reivindicación 22 o la reivindicación 23,
en las que
(a) la sustitución del aminoácido en el residuo 9 es serina (S) , metionina (M) o triptófano (W) ,
(b) la sustitución de aminoácido en el residuo 10 es ácido glutámico (E) o ácido aspártico (D) ,
(c) la sustitución de aminoácido en el residuo 15 es tirosina (Y) o leucina (L) .
(d) la sustitución de aminoácido en el residuo 18 es alanina (A) o leucina (L) .
(e) la sustitución del aminoácido en el residuo 30 es tirosina (Y) o serina (S) ,
(f) la sustitución de aminoácido en el residuo 34 es ácido glutámico (E) o ácido aspártico (D) , (g la sustitución del aminoácido en el residuo 35 es serina (S) o lisina (K) ,
(h) la sustitución de aminoácido en el residuo 36 es cisteína (C) ,
(i) la sustitución del aminoácido en el residuo 44 es arginina (R) o lisina (K) ,
(j) la sustitución del aminoácido en el residuo 53 es tirosina (Y) o glutamina (Q) ,
(k) la sustitución del aminoácido en el residuo 59 es metionina (M) o alanina (A) ,
(l) la sustitución de aminoácido en el residuo 66 es treonina (T) o alanina (A) ,
(m) la sustitución del aminoácido en el residuo 74 es histidina (H) o lisina (K) ,
(n) la sustitución del aminoácido en el residuo 77 es serina (S) o lisina (K) ,
(o) la sustitución de aminoácido en el residuo 82 es isoleucina (I) o leucina (L) .
(p) la sustitución del aminoácido en el residuo 88 es serina (S) o treonina (T) ,
(q) la sustitución del aminoácido en el residuo 93 es leucina (L) , arginina (R) o lisina (K) ,
(r) la sustitución de aminoácido en el residuo 100 es ácido glutámico (E) , triptófano (W) o fenilalanina (F) ,
(s) la sustitución de aminoácido en el residuo 104 es isoleucina (I) o alanina (A) .
(t) la sustitución de aminoácido en el residuo 115 es tirosina (Y) o leucina (L) .
(u) la sustitución del aminoácido en el residuo 118 es ácido glutámico (E) o valina (V) ,
(v) la sustitución de aminoácido en el residuo 120 es arginina (R) o leucina (L) .
(w) la sustitución de aminoácido en el residuo 142 es ácido glutámico (E) o ácido aspártico (D) ,
(x) la sustitución de aminoácido en el residuo 145 es leucina (L) o tirosina (Y) .
(y) la sustitución de aminoácido en el residuo 156 es glicina (G) o alanina (A) ,
(z) la sustitución del aminoácido en el residuo 157 es glicina (G) o lisina (K) ,
(aa) la sustitución de aminoácido en el residuo 160 es ácido glutámico (E) o ácido aspártico (D) , (bb) la sustitución del aminoácido en el residuo 184 es asparagina (N) o glutamina (Q) ,
(cc) la sustitución de aminoácido en el residuo 185 es glicina (G) o ácido aspártico (D) . (dd la sustitución de aminoácido en el residuo 188 es glicina (G) o ácido glutámico (E) , y (ee la sustitución del aminoácido en el residuo 192 es treonina (T) o serina (S) .
25. La molécula de ácido nucleico aislada o purificada de la reivindicación 1, en el que la proteína AID mutante funcional comprende uno o más de los siguientes:
(a) una sustitución de aminoácidos en el residuo 115, y
(b) una sustitución de aminoácidos en el residuo 120.
26. La molécula de ácido nucleico aislada o purificada de la reivindicación 25, en la que el aminoácido en el residuo 115 está sustituido por tirosina (Y) , triptófano (W) o leucina (L) .
27. La molécula de ácido nucleico aislada o purificada de la reivindicación 25 o la reivindicación 26, en la que el aminoácido en el residuo 120 está sustituido por arginina (R) , asparagina (N) o leucina (L) .
28. La molécula de ácido nucleico aislada o purificada de una cualquiera de las reivindicaciones 1-27, en la que la proteína AID mutante funcional comprende un truncamiento en C-terminal, una proteína de fusión o un codón de iniciación en o distal al residuo 181.
29. La molécula de ácido nucleico aislada o purificada de una cualquiera de las reivindicaciones 1-28, en la que la proteína AID mutante funcional comprende adicionalmente una sustitución de aminoácidos seleccionada del grupo que consiste en M6K, N7K, R8Q, R9K, K10Q, K10L, Q14H, Q14N, R25H, A39P, F42C, Y48H, N52S, N52A, N52M, D67A, G100A, G100W, E118D, V135A, A138G, Y145F, H156R, R171H, S173T, Q175K, R158K, R194K T195I, L198A , L198F, inserción de K después de 118, y D119E.
30. La molécula de ácido nucleico aislada o purificada de una cualquiera de las reivindicaciones 1-29, en la que la secuencia de ácido nucleico aislada o purificada se ha optimizado por codones para reducir el número de motivos de hipermutación somática (HMS) .
31. Una molécula de ácido nucleico aislada o purificada que comprende una secuencia de nucleótidos que codifica una citidina desaminasa inducida por activación (AID) mutante funcional cuya secuencia de aminoácidos difiere de la secuencia de aminoácidos de (a) una proteína AID canina (SEC ID Nº 3) , (b) una proteína AID murina (SEC ID Nº 4) ,
(c) una proteína AID de rata (SEC ID Nº 5) , (d) proteína AID bovina (SEC ID Nº 6) , o (e) una proteína AID de pollo (SEC ID Nº 7) en al menos una sustitución de aminoácidos, en la que un residuo seleccionado del grupo que consiste en el residuo 34, el residuo 82 y el residuo 156, en la que la proteína AID mutante funcional tiene al menos una mejora de 10 veces la actividad en comparación con la proteína AID humana en un ensayo de papilación bacteriana.
32. Un vector de expresión que comprende una molécula de ácido nucleico de cualquiera de las reivindicaciones 1
31.
33. Una célula eucariota o una célula procariota aislada que comprende la molécula de ácido nucleico de cualquiera de las reivindicaciones 1-31 o el vector de la reivindicación 32.
34. Un animal transgénico no humano que comprende la molécula de ácido nucleico de una cualquiera de las reivindicaciones 1-33.
35. El animal transgénico de la reivindicación 34, en el que el animal se selecciona del grupo que consiste en un ratón, un conejo, un camélido, una cabra y una rata.
36. Un procedimiento de preparación de un producto génico que tiene una propiedad deseada, en el que el procedimiento comprende expresar un ácido nucleico que codifica el producto génico en una población de células, en la que la población de células expresa, o puede ser inducida a que exprese, una proteína citidina desaminasa inducida por activación (AID) mutante funcional codificada por la molécula de ácido nucleico de cualquiera de las reivindicaciones 1-31, con lo cual la expresión de la proteína AID mutante funcional induce una mutación en el ácido nucleico que codifica el producto génico.
37. El procedimiento de la reivindicación 36, en el que el procedimiento comprende la etapa de seleccionar una célula o células dentro de la población que expresa la secuencia de ácido nucleico mutada que codifica el producto génico que tiene la propiedad deseada.
38. El procedimiento de la reivindicación 36 o la reivindicación 37, en el que la célula es una célula de mamífero.
39. El procedimiento de una cualquiera de las reivindicaciones 36 a 38, en el que la célula es un linfocito B o un derivado de linfocito B.
40. El procedimiento de una cualquiera de las reivindicaciones 36 a 39, en el que la célula comprende al menos una
secuencia de ácido nucleico que se ha optimizado por codones para la HMS para aumentar el número de motivos de HMS.
41. Un procedimiento para mutar un organismo no humano que tiene un fenotipo deseado que comprende expresar
o inducir la expresión de una proteína citidina desaminasa inducida por activación (AID) mutante funcional codificada por la molécula de ácido nucleico de una cualquiera de las reivindicaciones 1-31 en el organismo, con lo cual la expresión de la proteína AID mutante funcional induce una mutación dentro del ADN cromosómico del organismo.
42. El procedimiento de la reivindicación 41, en el que el procedimiento comprende la etapa de seleccionar una célula o células dentro del organismo que expresa el fenotipo deseado.
43. El procedimiento de la reivindicación 41 o la reivindicación 42, en el que el organismo comprende al menos una
secuencia de ácido nucleico que se ha optimizado por codones para la HMS para aumentar el número de motivos de HMS.
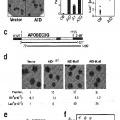
FIG. 10a (continuación) FIG.10b
Patentes similares o relacionadas:
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Ratones con un sistema inmunitario humanizado con células dendríticas reforzadas, del 22 de Julio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un ratón Rag-/-, γc-/-, Flk2-/- deficiente para el gen activador de recombinación 2 (Rag2) y/o el gen activador de recombinación 1 (Rag1), cadena gamma […]
Procedimientos de tratamiento del cáncer usando antagonistas de unión al eje de PD-1 e inhibidores de TIGIT, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo antagonista anti-PD-L1 o fragmento de unión a antígeno del mismo y un anticuerpo antagonista anti-TIGIT o fragmento de unión a antígeno del mismo para su uso […]
Sistemas de conservación y procesamiento de espermatozoides, del 17 de Junio de 2020, de XY, LLC: Un procedimiento para producir una muestra de esperma de mamífero no humano adecuada para la fertilización in vitro, que incluye la etapa de: […]
Roedores con alelos mutantes de Acvr1 condicionales, del 10 de Junio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una construcción de ácido nucleico que comprende: (i) un exón 5 de Acvr1 que codifica una secuencia de tipo silvestre a nivel de proteína, […]
Ratón nuligénico para Pint que muestra un fenotipo asociado a envejecimiento prematuro, del 10 de Junio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un ratón cuyo genoma comprende una inactivación de un locus del ARN no codificante largo (ARNlnc) Pint endógeno, en donde la inactivación (i) da como resultado que el […]
Polinucleótidos que codifican anticuerpos de roedores con idiotipos humanos y animales que los contienen, del 29 de Abril de 2020, de Open Monoclonal Technology, Inc: Un polinucleótido quimérico que comprende, en orden 5' a 3', un gen de región variable (V) de inmunoglobulina (Ig) humana, un gen de región de diversidad (D) de […]
Ratones ADAM6, del 22 de Abril de 2020, de REGENERON PHARMACEUTICALS, INC.: Un ratón que ha experimentado reordenación de secuencia génica de inmunoglobulina de modo que exprese un linfocito B que comprende una secuencia de inmunoglobulina reordenada […]