Moléculas del Factor VII quimérico.
Un polipéptido del Factor VIIa quimérico, en donde el polipéptido del Factor VIIa quimérico comprende los dominios EGF-2 y catalíticos del Factor VII;
un dominio GLA seleccionado del grupo que consiste en el dominio GLA del Factor IX y el dominio GLA de la proteína S; y un dominio EGF-1 seleccionado del grupo que consiste en el dominio EGF-1 del Factor IX y el dominio EGF-1 de la proteína S, para usar en el tratamiento de un trastorno de sangrado en un sujeto que tiene un trastorno de sangrado.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2010/039934.
Solicitante: THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 308 BYNUM HALL CAMPUS BOX 4105 CHAPEL HILL, NC 27599-4105 ESTADOS UNIDOS DE AMERICA.
Inventor/es: STAFFORD,DARREL W, FENG,DENGMIN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/36 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de coagulación sanguínea o de fibrinolisis.
- C12N9/50 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Proteinasas.
PDF original: ES-2524974_T3.pdf

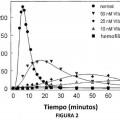
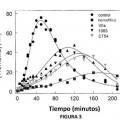

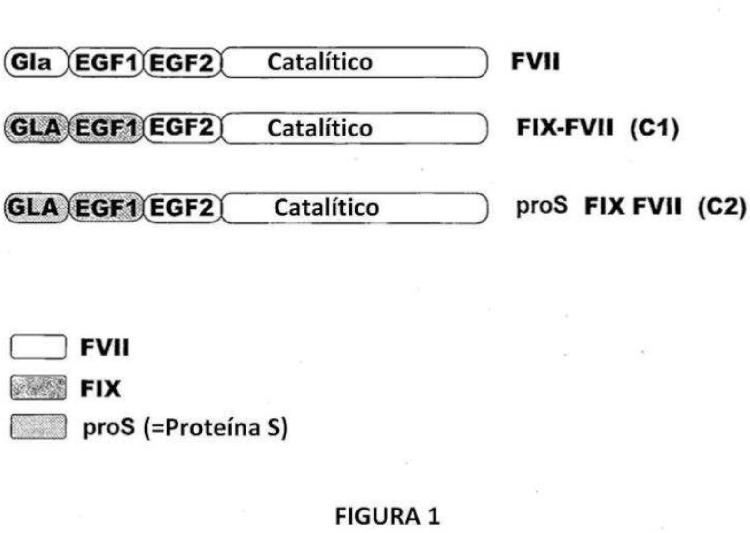
Fragmento de la descripción:
Moléculas del Factor VII quimérico Campo de la invención La presente invención se relaciona con polipéptidos del Factor VII de coagulación humano quimérico (FVII) que tienen mayor actividad coagulante y menos complicaciones trombóticas que los actualmente disponibles polipéptidos del Factor VII, así como constructos de polinucleótidos que codifican tales polipéptidos, vectores y células huésped que comprenden y que expresan los polinucleótidos, composiciones farmacéuticas, usos y métodos de tratamiento.
Antecedentes de la invención La coagulación de la sangre es un proceso que consiste en una interacción compleja de varios componentes de la sangre (o factores) que eventualmente dan lugar a un coágulo de fibrina. Generalmente, los componentes de la sangre, que participan en lo que se ha referido como la "cascada, " de coagulación, son proteínas enzimáticamente inactivas (proenzimas o zimógenos) que se convierten en enzimas proteolíticas por la acción de un activador (que en sí es un factor de coagulación activado) . Los factores de coagulación que han experimentado una conversión de ese tipo se denominan generalmente como "factores activos ", y se designan por la adición de la letra "a" al nombre del factor de la coagulación (por ejemplo., el Factor VII activada se designa como Factor VIIa o FVIIa) .
Normalmente, la iniciación del proceso hemostático se media por la formación de un complejo entre el factor tisular y el Factor VIIa. Este complejo convierte después los Factores IX (FIX) y X (FX) a sus formas activas. El Factor Xa (FXa) convierte cantidades limitadas de protrombina a trombina en la célula que contiene el factor tisular. La trombina activa las plaquetas y los Factores V (FV) y VIII (FVIII) en Factores Va (FVa) y VIIIa (FVIIIa) , ambos cofactores en el proceso adicional conduciendo al torrente completo de trombina. Este proceso incluye la generación del Factor Xa por el Factor IXa (FIXa) (en complejo con el Factor VIIIa) y ocurre en la superficie de las plaquetas activadas. La trombina finalmente convierte el fibrinógeno en fibrina resultando en la formación de un coágulo de fibrina. En los últimos años se ha encontrado que el Factor VII y el factor tisular son los principales iniciadores de coagulación de la sangre.
El Factor VII es una glicoproteína de plasma que circula en la sangre como un zimógeno de cadena sencilla. El zimógeno tiene actividad catalítica marginal. El Factor VII de cadena sencilla se puede convertir en Factor VIIa de dos cadenas por el Factor Xa, Factor XIIa, Factor IXa, Factor VIIa o trombina in vitro. El Factor Xa se cree que es el principal activador fisiológico del Factor VII. Similar a otras muchas proteínas plasmáticas implicadas en la hemostasia, el Factor VII depende de la Vitamina K para su actividad, que se requiere para la gamma-carboxilación de residuos múltiples de ácido glutámico que se agrupan cerca del terminal amino de la proteína. Estos ácidos glutámicos carboxilados en gamma se requieren para la interacción inducida por iones metálicos del Factor VII con fosfolípidos. La conversión del zimógeno Factor VII en la molécula de cadena doble activada ocurre por escisión de un enlace peptídico interno Arg152-Ile153. Además, se conoce bien que altas concentraciones de Factor VII conducen a la autoactivación in vitro. En presencia de factor tisular, fosfolípidos e iones de calcio, el Factor VIIa de doble cadena activa rápidamente el Factor X o Factor IX por proteolisis limitada.
El gen que codifica al FVII humano (hFVII) se ha mapeado con el cromosoma 13 en q34-qter 9 (de Grouchy y otros, Hum Genet 1984; 66:230-233) . Contiene nueve exones y se extiende por 12.8 Kb (O'Hara y otros, Proc Natl Acad Sci USA 1987; 84:5158-5162) . La organización génica y la estructura de la proteína de FVII son similares a las de otras proteínas procoagulantes dependientes de vitamina K, con exones 1a y 1b que codifican para la secuencia señal; exón 2 el propéptido y el dominio GLA; exón 3 una región hidrofóbica corta; exones 4 y 5 dominios tipo factor de crecimiento epidérmico; y exón 6 hasta el 8 el dominio catalítico de la serina proteasa. (Yoshitake y otros, Biochemistr y 1985; 24: 3736-3750) .
El Factor IX (factor Christmas) es el zimógeno de una serina proteasa activa en la hemostasia normal y la actividad enzimática requiere la carboxilación de residuos específicos de ácido glutámico. Los Factores IX, X, VII y la proteína C son parálogos estrechamente relacionados de la misma familia de serina proteasas, con un alto grado de identidad de secuencia de aminoácidos y arreglo intrón-exón de los genes que codifican estas proteínas. Estas proteínas estrechamente relacionadas tienen una estructura similar de dominios funcionales a partir del terminal amino al carboxilo para incluir un dominio ácido γ-carboxiglutámico (GLA) , dos dominios tipo factor de crecimiento epidérmico (EGF) , un péptido de activación y el dominio catalítico. La proteína S es una proteína de 666 aminoácidos, dependiente de vitamina K con un dominio GLA, 4 dominios tipo EGF, una región sensible a trombina y 2 dominios de laminina.
Las proteínas plasmáticas de la coagulación dependientes de vitamina K contienen un dominio GLA que funciona como el
sitio de unión de proteínas a las membranas y el dominio GLA está muy conservado entre las diversas proteínas de la coagulación. A pesar de su similitud, los dominios GLA exhiben una amplia variedad de afinidades por el fosfolípido, con el dominio GLA de la Proteína S que tiene la mayor afinidad por los fosfolípidos. (Ellison y otros, Biochemistr y , 1998; 37:79978003) , (McDonald y otros, Biochemistr y 1997; 36:5120-27) .
Es frecuentemente deseable estimular o mejorar la cascada de coagulación en un sujeto. El Factor VIIa se ha usado para controlar los trastornos de sangrados que tienen varias causas tales como deficiencias de factores de coagulación (por ejemplo, hemofilia A y B o deficiencia de Factores de coagulación XI o VII) o inhibidores de factores de coagulación. El Factor VIIa se ha usado además para controlar el sangrado excesivo que ocurre en sujetos con una cascada de coagulación de la sangre que funciona normalmente (sin deficiencias de factores o inhibidores de coagulación contra cualquiera de los factores de coagulación) . Tal sangrado puede, por ejemplo, ser causado por una función plaquetaria defectuosa, trombocitopenia o enfermedad de von Willebrand.
El sangrado es además un problema importante con respecto a la cirugía y otras formas de trauma. Por ejemplo, el Factor VII se ha usado ampliamente para tratar soldados heridos en Irak y Afganistán. (Perkins JG, y otros The Journal of Trauma. 2007; 62: 1095-9; discusión 9-101) . Su uso se ha acreditado con salvar muchas vidas, pero como con la mayoría de los tratamientos médicos, existen efectos secundarios, tales como accidente cerebrovascular u otros eventos trombóticos después del tratamiento. La impresión general de los médicos que usan FVIIa, sin embargo, es que su uso ha salvado muchas más vidas que las que se han perdido. Quizás la mejor indicación de esto es que en guerras anteriores aproximadamente el 30 por ciento de los heridos murieron de sus lesiones, mientras que en la actual guerra del Golfo el número se ha reducido a aproximadamente 10 por ciento. (Gawande A, y otros, N Engl J Med. 2004; 351: 2471-5) .
Estudios de ratones transgénicos con hemofilia B que expresan Factor VIIa han demostrado que la expresión continua de Factor VIIa en niveles bajos (por debajo de 1.5 μg/ml) restaura la actividad de coagulación en ratones con hemofilia B. Los niveles de factor VIIa en ratones silvestres o con hemofilia B anteriormente 2 μg/ml, sin embargo, condujeron a trombosis en el corazón y los pulmones; tanto el corazón como los pulmones son sitios de alta expresión de factor tisular. Esto sugiere que los altos niveles de factor VIIa en la circulación inducen trombosis cuando contactan con el factor tisular expuesto en la lesión de los vasos en el corazón y los pulmones. (Margaritas y otros, J. Clin. Invest. 2004; 113:1025-31) . Además, los estudios han demostrado que la transferencia génica mediada por vector del Factor VIIa canino en perros hemofílicos es tanto segura como eficaz a corto y mediano plazo. (Margaritas y otros, Gene Therapy 2009; 113:3682-3689) .
Advertencias relacionadas con el tratamiento con factor VII se proponen actualmente para los productos que buscan la aprobación regulatoria. Por ejemplo, la Agencia Europea de Medicamentos, Unidad de Evaluación de Medicamentos Humanos recomienda que las terapias actuales con Factor VII lleven una advertencia del riesgo de trombosis y coagulación intravascular diseminada, particularmente en situaciones... [Seguir leyendo]
Reivindicaciones:
1. Un polipéptido del Factor VIIa quimérico, en donde el polipéptido del Factor VIIa quimérico comprende los dominios EGF-2 y catalíticos del Factor VII; un dominio GLA seleccionado del grupo que consiste en el dominio GLA del Factor
IX y el dominio GLA de la proteína S; y un dominio EGF-1 seleccionado del grupo que consiste en el dominio EGF-1 del Factor IX y el dominio EGF-1 de la proteína S, para usar en el tratamiento de un trastorno de sangrado en un sujeto que tiene un trastorno de sangrado.
2. Un polipéptido del Factor VIIa quimérico para usar de acuerdo con la reivindicación 1, en donde el trastorno de sangrado es seleccionado del grupo que consiste en: deficiencias del factor de coagulación; función plaquetaria defectuosa; trombocitopenia; enfermedad de von Willebrand; inhibición de los factores de coagulación; sangrado inducido por cirugía; y, sangrado inducido por trauma.
3. Un polipéptido del Factor VIIa quimérico para usar de acuerdo con la reivindicación 1 o 2, en donde el trastorno de 15 sangrado es una deficiencia del factor de coagulación.
4. Un polipéptido del Factor VIIa quimérico para usar de acuerdo con la reivindicación 3, en donde la deficiencia del factor de coagulación es hemofilia.
5. Un polipéptido del Factor VIIa quimérico para usar de acuerdo con cualquier reivindicación precedente, en donde el tratamiento del trastorno de sangrado comprende administrar al sujeto una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica el polipéptido del Factor VIIa quimérico.
6. Un polipéptido del Factor VIIa quimérico para usar de acuerdo con cualquier reivindicación precedente, en donde el 25 dominio GLA es un dominio GLA del Factor IX y el dominio EGF-1 es un dominio EGF-1 del Factor IX.
7. Un polipéptido del Factor VIIa quimérico para usar de acuerdo con cualquier reivindicación precedente, en donde el dominio GLA del Factor IX incluye una sustitución en el residuo 5 de lisina por arginina.
8. Un polipéptido del Factor VIIa quimérico para usar de acuerdo con cualquiera de las reivindicaciones 1 a 5, en donde el dominio GLA es un dominio GLA de Proteína S y el dominio EGF-1 es un dominio EGF-1 del Factor IX.
9. Una proteína de coagulación quimérica que comprende:
un dominio GLA de la proteína S; un dominio EGF-1 seleccionado del dominio EGF-1 de la proteína S; y, el dominio EGF-1 del Factor IX; y el dominio EGF-2 y dominio catalítico del Factor VII.
10. Una molécula de ácido nucleico que codifica la proteína de coagulación quimérica de la reivindicación 9.
11. Un vector que comprende la molécula de ácido nucleico de la reivindicación 10.
12. Una célula que comprende la proteína de coagulación quimérica de la reivindicación 9.
13. Una célula que comprende el vector de la reivindicación 11.
Patentes similares o relacionadas:
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Trombina estabilizada, del 27 de Mayo de 2020, de OMRIX BIOPHARMACEUTICALS LTD.: Un método para estabilizar la actividad de la trombina en una solución, el método comprende: inhibir la actividad de la trombina poniendo en contacto la trombina con un oligonucleótido […]
Medicamento para tratamiento terapéutico y/o mejoría de la sepsis, del 8 de Abril de 2020, de ASAHI KASEI PHARMA CORPORATION: Un medicamento que comprende trombomodulina como un ingrediente activo para uso en el tratamiento terapéutico y/o mejoría de la sepsis, donde se ha de administrar […]
Uso terapéutico sinérgico de concentrados de complejo de protrombina con concentrados de FVIII, del 18 de Marzo de 2020, de CSL BEHRING GMBH: Composición que comprende factores de coagulación FII, FIX, FX y FVII aislados y una composición que comprende FVIII aislado y, opcionalmente, VWF aislado para […]
Métodos y composiciones para la condrogénesis in vitro e in vivo, del 18 de Diciembre de 2019, de Lineage Cell Therapeutics, Inc: Una composición que comprende una línea celular progenitora embrionaria clonal para su uso en un método in vivo de generación de cartílago, comprendiendo la composición: […]
Complejo del factor VIII con XTEN y proteína del factor de Von Willebrand y sus usos, del 27 de Noviembre de 2019, de Bioverativ Therapeutics Inc: Una proteína quimérica que comprende (i) un fragmento del factor de von Willebrand Factor (VWF) que comprende el dominio D' y el dominio D3 de VWF, (ii) […]
Direccionamiento de factores de coagulación al TLT-1 en plaquetas activadas, del 23 de Octubre de 2019, de NOVO NORDISK HEALTH CARE AG: Una proteína procoagulante que comprende (i) al menos un factor de coagulación, que es un polipéptido de FVII o un polipéptido de FIX, unido covalentemente […]