Inmunoterapéuticos polivalentes de alta especificidad basados en anticuerpos modificados y formulación liofilizada inyectable altamente segura y eficaz.
Inmunoterapéuticos polivalentes de alta especificidad basados en anticuerpos modificados y formulación liofilizada inyectable altamente segura y eficaz.
La invención se relaciona con la producción y desarrollo de una formulación inyectable liofilizada de anticuerpos modificados o variantes de ellos, altamente específicos neutralizantes de mezclas heterólogas de proteínas, péptidos y otros componentes orgánicos e inorgánicos que tienen diferentes actividades específicas y pueden incluir pero no se limitan a venenos de animales ponzoñosos. Por conveniencia haremos referencia a venenos, pero se incluyen todo tipo de venenos de animales terrestres y marinos. También está dirigida al método de producción que incluye la hiperinmunización de mamíferos para la producción de anticuerpos altamente específicos, el proceso de modificación (fragmentación) y purificación, y finalmente la formulación inyectable liofilizada, que le confiere propiedades de alta pureza y alta especificidad.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201300887.
Solicitante: INOSAN BIOPHARMA, S.A.
Nacionalidad solicitante: España.
Inventor/es: LÓPEZ DE SILANES PÉREZ,Juan.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de mamíferos; Composiciones que comprenden tejidos o células indeterminadas; Composiciones que comprenden células madre no embrionarias; Células modificadas genéticamente (vacunas o preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00).
PDF original: ES-2549690_A2.pdf


Fragmento de la descripción:
INMUNOTERAPÉUTICOS POLIVALENTES DE ALTA ESPECIFICIDAD BASADOS EN ANTICUERPOS MODIFICADOS Y FORMULACIÓN LIOFILIZADA INYECTABLE ALTAMENTE SEGURA Y EFICAZ
Campo de la invención
La presente invención se relaciona con inmunoterapéuticos Polivalentes de alta especificidad, modificación de anticuerpos y el proceso de producción involucrado.
Antecedentes de la invención
Los envenenamientos por animales ponzoñosos son reconocidos como un problema de salud pública en algunas regiones del planeta, donde la interacción del hombre con estos animales es frecuente. Podemos llamar animales ponzoñosos y/o venenosos a aquellos animales que producen sustancias con actividad farmacológica que puede interferir con nuestra supervivencia. Los venenos más estudiados son los venenos que provienen de serpientes, escorpiones, arañas, moluscos y microorganismos, sin embargo existen otros animales venenosos que incluyen a peces, ranas, insectos, anemonas, corales entre otros.
Para contrarrestar los efectos del veneno se han empleado antídotos basados en la manipulación del sistema inmune de mamíferos donde las inmunoglobulinas o anticuerpos juegan el papel central. En 1888 Emilie Roux y Alesandre Yersin demostraron que la sangre de animales inmunizados contra toxinas diftéricas, proporcionaban protección a los animales cuando se retaban contra toxinas. Para 1890 Emil von Behring y Shibasaburo Kitasato confirmaron la transferencia de la inmunidad pasiva contra toxinas de difteria y tétanos, este año es considerado como el inicio de la seroterapia, y también es considerado la primera generación de antivenenos, la segunda generación corresponde a inmunoglobulinas purificadas del suero, y la siguiente generación la constituyen los fragmentos de inmunoglobulinas.
La producción de fragmentos F(ab')2 y Fab, ha sido descrita en la literatura desde principios del siglo pasado, en 1936 I. A. Parfentjev (Pat. Nos. US 2,065,196, US 2,123,198 y US 2,175,090). La mayoría de los métodos se basan en el aprovechamiento de las propiedades fisicoquímicas y termodinámicas de las proteínas, como son la solubilidad, la forma, la afinidad. Por lo que a lo largo de los últimos años han existido algunas aproximaciones para la producción de fragmentos de anticuerpos F(ab')2 y Fab como es el caso de Landon Pat. No. US 5,733,742, Sullivan et al., y la US 4,849,352.
Sin embargo, el desarrollo actual de las tecnologías de análisis de proteínas se ha convertido en una herramienta para el desarrollo y mejoramiento de anticuerpos modificados por digestión enzimática, debido a que han permitido una mayor caracterización de los inmunógenos empleados en la producción de plasmas hiperinmunes de mamíferos, así como el proceso de cuantificación de la actividad neutralizante de los anticuerpos específicos, y el control del proceso de purificación.
La producción de anticuerpos modificados (fragmentos) se lleva acabo cuando las inmunoglobulinas (IgG) son digeridas enzimáticamente con diferentes enzimas proteolíticas como la pepsina o papaína, en ambos casos se elimina la fracción Fe, pero en el caso de la pepsina se obtiene un fragmento F(ab')2 y en el caso de la papaína dos fragmentos Fab. Estos fragmentos F(ab')2 mantienen las características de los anticuerpos completos, con respecto a su especificidad, afinidad y estabilidad. Además de que la ausencia de la región Fe de los anticuerpos, elimina la aparición de efectos adversos (como pueden ser las reacciones anafilácticas), debido a que la región Fe se une a varios receptores celulares como el receptor del Fe y otras moléculas del sistema inmunitario como las proteínas del complemento, además de otras funciones efectoras como la opzonización, lisis celular y desgranulación de las células cebadas, basófilos y eosinofilos.
La patente mexicana MX230257 de J. López de Silanes et al, de Instituto Bioclon y sus equivalentes las patentes Nos. US 6,709,655, US 7,485,303 y la US 8,075,893, se refieren al método para preparar una composición farmacéutica que comprende fragmentos F(ab)2 presentando características únicas adquiridas por el método de preparación que se encuentran libres de:
Moléculas de anticuerpo completas Moléculas proteicas de otra naturaleza - Albúmina Fibrinógeno Partículas virales y Pirógenos
Sin embargo no cualquier producto faboterápico se encuentra comprendido en el alcance de la patente MX230257 y sus equivalentes estadounidenses.
Objetivos de la invención
Un objetivo de la invención está relacionado con la producción y desarrollo de una formulación de anticuerpos modificados altamente específicos provenientes de mamíferos.
Otro objetivo de la presente invención se refiere a la producción y desarrollo de una formulación liofilizada de anticuerpos modificados, altamente específicos o variantes de ellos, provenientes de mamíferos
Otro objetivo de la invención está relacionado con la producción y desarrollo de una formulación de anticuerpos modificados altamente específicos neutralizantes de mezclas heterólogas de proteínas, péptldos y otros componentes orgánicos e inorgánicos que tienen diferentes actividades específicas y pueden incluir pero no se limitan a venenos de animales ponzoñosos.
Otro objetivo de la presente invención incluye un método de producción útil para la hiperinmunizaclón de equinos para la producción de anticuerpos altamente específicos, el proceso de modificación (fragmentación) de los anticuerpos y la purificación de los mismos.
Otro objetivo de la invención es el de proporcionar una formulación Inyectable liofilizada, propiedades de alta pureza y alta especificidad.
Otros objetivos y aspectos de la presente invención serán obvios para las personas de habilidades ordinarias al considerar la presente divulgación.
Breve descripción de las figuras
Figura 1. Muestra dos tablas comparativas de antiveneno de la presente Invención para las especies de serpiente B. apser y C. durissus identificadas respectivamente como especie 1 y especie 2 en la segunda tabla de esta figura, contra antivenenos del estado de la técnica. Se expresa el porcentaje de anticuerpos específicos contra venenos utilizados en la inmunización de los caballos productores de anticuerpos, con el objeto de dejar en claro qué porcentaje de las inmunoglobulinas presentes en un vial de los lotes utilizados se unen a los venenos.
Figura 2. Muestra dos tablas comparativas de antiveneno de la presente invención para las especies de serpiente B. apser y C. durissus identificadas respectivamente como especie 1 y especie 2 en la segunda tabla de esta figura, contra antivenenos del estado de la técnica. Se expresa la cantidad en miligramos de antiveneno necesarios para neutralizar un miligramo de venenos utilizados en la inmunización de los caballos productores de anticuerpos.
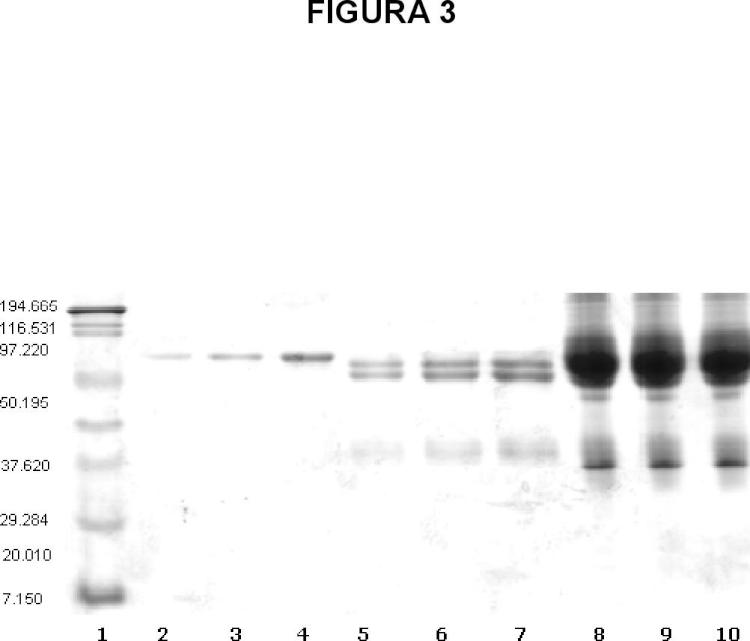
Figura 3. Electroforesis en la etapa de acondicionamiento del plasma hiperinmune previo a la hidrólisis enzimática. Carril 1: marcador de peso molecular. Carril 2: estándar de la albúmina 0.5%. Carril 3: estándar de albúmina 1.0%. Carril 4: estándar de albúmina 3.0%, 4.IgG + lgG(T) al 3%. Carril 5: NgG + IgG(T) al 5%. Carril 6: IgG + IgG(T) al 7%. Carril 7: IgG + IgG(T) al 10%. Carril 8: Lote 1 de plasma acondicionado antes de la hidrólisis enzimática. Carril 9: Lote 2 de plasma acondicionado antes de la hidrólisis enzimática. Carril 10: Lote 3 de plasma acondicionado antes de la hidrólisis enzimática.
Figura 4. Gráfica que muestra la formación de fragmentos F(ab')2 durante la digestión enzimática con pepsina.
Figura 5. Etapa de digestión enzimática del plasma acondicionado. Electroforesis (SDS-PAGE) para tres lotes de prueba después de la digestión enzimática con pepsina. Carril 1: Marcador de peso molecular. Carril 2: Estándar de albúmina 0.5%. Carril 3: Estándar de albúmina 1.0%. Carril 4 Estándar de albúmina 3.0%, Carril 5 IgG + IgG(T) al 5%. Carril 6: IgG + IgG(T) al 7%. Carril 7: IgG + IgG(T) al 10%. Carril 8: Lote 1 de plasma digerido con pepsina para la producción de fragmentos F(ab')2. Carril 9: Lote 2 de plasma digerido con pepsina para la producción de fragmentos F(ab')2. Carril 10: Lote 3 de plasma digerido con pepsina para la producción de fragmentos F(ab')2.
Figura 6. Etapa de precipitación con Sulfato de Amonio. Electroforesis SDS-PAGE para tres lotes de desarrollo después de la precipitación con sulfato de amonio. Se muestra por la técnica de Salting-out la separación de proteínas no-F(ab)2 (tales como pepsina, fibrinógenos no digeridos, IgG completos y un gran número de péptidos producidos durante la digestión), en una solución de sulfato de amonio de 35% (p/v). Carril 1: Marcador de peso molecular.... [Seguir leyendo]
Reivindicaciones:
1.- Un método para preparar una composición de anticuerpos en forma de fragmentos bivalentes del tipo F(ab)2 obtenidos a partir de ¡nmunoglobulinas del tipo G modificadas mediante la eliminación de la fracción cristalizable (Fe), susceptibles de unirse a antígenos complejos correspondientes a mezclas heterólogas de proteínas, péptidos y otros componentes orgánicos e inorgánicos que tienen diferentes actividades específicas, provenientes de plasmas hiperinmunes de mamíferos, y que son específicos contra los antígenos complejos que generaron las ¡nmunoglobulinas del tipo del que se han obtenido, en mamíferos específicos contravenenos animales, neutralizantes de antígenos completos, mezclas heterólogas de proteínas, péptidos y otros componentes orgánicos e inorgánicos de una alta calidad, caracterizado porque comprende:
etapa 1) diluir el plasma hiperinmune en tres volúmenes de solución salina ¡sotónica (0.85%) pretratada con timerosal, seguido de un ajuste de las condiciones de pH de 3.5 a 4.0, a una temperatura de 18°C a20°C, para obtener un plasma acondicionado;
etapa 2) adicionar una solución acida de pepsina al plasma acondicionado obtenido en la etapa 1), hasta alcanzar una concentración final de 0.9% a 1.1% de pepsina manteniendo las condiciones de pH y temperatura durante 180 minutos;
etapa 3) adicionar una solución acuosa de sulfato de amonio al 50% al plasma digerido de la etapa 2), hasta alcanzar una concentración final de saturación de 35% v/v a una temperatura de 2°C a 8°C y recuperar el sobrenadante;
etapa 4) filtrar el sobrenadante de la etapa 3) a través de un módulo de filtración profunda y recuperar el sobrenadante;
etapa 5) almacenar el filtrado de la etapa 4) a una temperatura de 2 a 8°C y pH de 6.8 a 7.0 y someter el filtrado a diafiltración en un equipo de filtración de flujo tangencial y recuperar el sobrenadante; etapa 6) someter a nanofiltración al sobrenadante de la etapa 5) y recuperar el sobrenadante; etapa 7) adicionar al sobrenadante de la etapa 6) agentes criopreservadores y reguladores de la
¡sotonicidad; y
etapa 8) realizar una filtración aséptica terminal del producto de la etapa 7); y etapa 9) eliminar el agua de la composición mediante liofilización del producto filtrado de la etapa 8) y secar posteriormente.
2. Un método de conformidad con la reivindicación 1, caracterizado porque en la etapa 2) la concentración final de IgG es no mayor a 2 % y la concentración de albúmina es no mayor a 0.5 %.
3. Un método de conformidad con la reivindicación 1 ó 2, caracterizado porque en la etapa 4) el módulo de filtración profunda comprende fibras de celulosa modificada, y tiene un gradiente de filtración nominal final de 100 a 0.8 mieras.
4. Un método de conformidad con la reivindicación 1,2 ó 3, caracterizado porque en la etapa 5) la diafiltración se realiza a través de una membrana de polietersulfona de 50 KDa, utilizando buffer de boratos como buffer de diafiltración, de manera continua y manteniendo un cizallamiento de diafiltración por debajo de 1000 sec-1 entre la membrana de filtración tangencial y las proteínas para garantizar un mínimo grado de desnaturalización.
5. Un método de conformidad con una cualquiera de las reivindicaciones 1 a 4, caracterizado porque en la etapa 5) además se realiza un equilibrio de la ¡sotonicidad de los fragmentos F(ab)2 con solución salina isotónica al 0.85%.
6.- Un método de conformidad con una cualquiera de las reivindicaciones 1 a 5, caracterizado porque en la etapa 6) la nanofiltración se realiza a través de un filtro de 20 nanómetros de tamaño de poro.
7. Un método de conformidad con una cualquiera de las reivindicaciones 1 a 6, caracterizado porque en el paso 7) los criopreservadores y reguladores de ¡sotonicidad se seleccionan entre manitol, alanina y polisorbato 80.
8. Un método de conformidad con una cualquiera de las reivindicaciones 1 a 7, caracterizado porque, en el paso 7) los criopreservadores y reguladores de ¡sotonlcidad se seleccionan entre manitol 9mg/mL, alanina 18mg/mL y polisorbato 80 0.1 mg/mL.
9. Un método de conformidad con una cualquiera de las reivindicaciones 1 a 8, caracterizado porque en la etapa 8) se realiza una Filtración Aséptica Terminal a través de un filtro PVDF de 0.1 mieras.
10. Un método de conformidad con una cualquiera de las reivindicaciones 1 a 9, caracterizado porque en la etapa 9) la liofilización se lleva a cabo a una temperatura de hasta -40°C durante 8 horas.
11. Un método de conformidad con una cualquiera de las reivindicaciones 1 a 10, caracterizado porque, en la etapa 9) el secado primario se realiza a -5°C con un gradiente de velocidad de +5.2 °C/hora y secado secundario se realiza a 45°C durante 10 horas a una velocidad de 9 °C/hora.
12. Una composición de inmunoterapéuticos polivalentes, caracterizada porque se ha obtenido según el método conforme a una cualquiera de las reivindicaciones 1 a 11.
13 - Una composición de conformidad con la reivindicación 12, caracterizada porque comprende oligómeros solubles y/o insolubles, dímeros, F(ab')2, Fab y componentes de bajo peso molecular que presentan una pureza mayor al 85% de fragmentos F(ab')2.
14 - Una formulación inyectable liofilizada caracterizada porque comprende una composición conforme a las reivindicaciones 12 o 13, en donde los anticuerpos modificados o variantes de ellos, altamente específicos neutralizantes de mezclas heterólogas de proteínas, péptidos y otros componentes orgánicos e inorgánicos que tienen diferentes actividades específicas y pueden incluir pero no se limitan a venenos de serpientes, alacranes, escorpiones, arañas, moluscos, microorganismos, peces, ranas, insectos, anemonas, corales, combinaciones de los mismos, derivados o producidos por ellos.
15 - Uso de la composición de inmunoterapéuticos polivalentes de especificidad contra venenos animales que comprende anticuerpos modificados específicos provenientes de mamíferos de conformidad con las reivindicaciones 12 o 13, para preparar un medicamento para tratar patologías provocadas por el efecto biológico de un veneno, toxina o sus componentes de un animal ponzoñoso seleccionado de serpientes, alacranes, escorpiones, arañas, moluscos, microorganismos, peces, ranas, insectos, anemonas, corales y combinación de los mismos.
Patentes similares o relacionadas:
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Agente profiláctico y/o agente terapéutico para el linfoma difuso de células B grandes, del 17 de Junio de 2020, de ONO PHARMACEUTICAL CO., LTD.: 6-amino-9-[(3R)-1-(2-butinoil)-3-pirrolidinil]-7-(4-fenoxifenil)-7,9-dihidro-8H-purin-8-ona, una sal de la misma, un solvato de la misma o un N-óxido de la misma, […]
Métodos y dispositivos para trasplante celular, del 10 de Junio de 2020, de Sernova Corporation: Un dispositivo para implantar células en un cuerpo huésped, que comprende: un andamio poroso que comprende al menos una cámara que tiene un extremo proximal y un extremo […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]
Método para preparar una célula dendrítica, célula dendrítica preparada mediante el mismo y uso del mismo, del 13 de Mayo de 2020, de JW Creagene Inc: Un método para preparar una célula dendrítica que comprende: cultivar una célula dendrítica inmadura hasta una célula dendrítica madura en presencia de […]
Transfección mediada por células apoptóticas de células de mamífero con ARN de interferencia, del 22 de Abril de 2020, de LOMA LINDA UNIVERSITY: Una célula de mamífero apoptótica o preapoptótica para su uso en la prevención del rechazo de trasplantes, en la que la célula de mamífero […]
Métodos mejorados para producir terapias celulares adoptivas, del 22 de Abril de 2020, de Bluebird Bio, Inc: Un método in vitro para producir un producto terapéutico de células T que comprende: a) proporcionar una población de células mononucleares […]
Solución de preservación del trasplante basada en polímeros, del 25 de Marzo de 2020, de Kizhakkedathu, Jayachandran: Una solución de preservación del trasplante que comprende un poliglicerol hiperramificado o dendrítico en el que el poliglicerol hiperramificado […]