FORMAS DE DOSIFICACIÓN DE DOSIS ÚNICA DIARIA DE TROSPIO.
Una composición farmacéutica oral que contiene trospio, que a una dosificación de dosis única diaria dará niveles en sangre en equilibrio dinámico de trospio de un mínimo (Cmin) de 0,
5 ng/ml y un máximo (Cmax) de 6,0 ng/ml, dicha composición es una combinación de un componente de cloruro de trospio XR y un componente de cloruro de trospio DR, en la que el componente de cloruro de trospio XR proporciona entre 10 mg y 40 mg de cloruro de trospio y en la que el componente de cloruro de trospio DR proporciona entre 10 mg y 40 mg de cloruro de trospio
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/036394.
Solicitante: SUPERNUS PHARMACEUTICALS, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1550 EAST GUDE DRIVE ROCKVILLE, MD 20850 ESTADOS UNIDOS DE AMERICA.
Inventor/es: BHATT, PADMANABH, FLANNER, HENRY, H., KIDANE, ARGAW, RAOUFINIA,Arash.
Fecha de Publicación: .
Fecha Solicitud PCT: 4 de Noviembre de 2004.
Clasificación PCT:
- A61K31/44 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piridinas no condensadas; Sus derivados hidrogenados.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
- A61K9/28 A61K 9/00 […] › Grageas; Píldoras o comprimidos con revestimientos.
- A61K9/48 A61K 9/00 […] › Preparaciones en cápsulas, p. ej. de gelatina, de chocolate.
- A61P13/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento del aparato urinario (diuréticos A61P 7/10).
Clasificación antigua:
- A61K31/44 A61K 31/00 […] › Piridinas no condensadas; Sus derivados hidrogenados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre.
PDF original: ES-2359375_T3.pdf




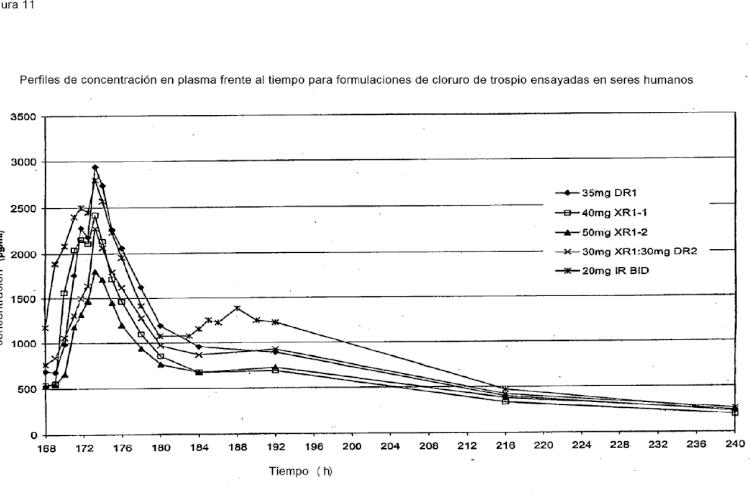
Fragmento de la descripción:
Campo de la invención
La presente invención se refiere a composiciones farmacéuticas que permiten formas de dosificación de dosis única diaria de trospio. El trospio está indicado en el tratamiento de frecuencia urinaria, tenesmo vesical, nocturia, e incontinencia con tenesmo asociada a inestabilidad del esfínter detrusor, síndrome de tenesmo vesical, e hiperreflexia del detrusor. Estas composiciones son útiles en el tratamiento de las afecciones mencionadas anteriormente con administración una vez al día.
Antecedentes de la invención
El trospio es un derivado de amonio cuaternario de tropina, y tiene propiedades anticolinérgicas. La hidrofilia de la molécula, debido a su carga positiva permanente, limita su solubilidad en lípidos. El cloruro de trospio ha demostrado antagonizar acetilcolina en tiras extirpadas de músculo de la vejiga humana. La actividad antiespasmódica se ha demostrado en la vejiga, el intestino delgado, y sobre la contractilidad de la vesícula biliar. El cloruro de trospio muestra acción parasimpaticolítica reduciendo el tono del músculo liso, tal como el que se encuentra en los tractos urogenital y gastrointestinal. Este mecanismo permite que el detrusor se relaje, inhibiendo de este modo la evacuación de la vejiga. La reducción de la presión máxima del detrusor da como resultado una mejor adaptación del detrusor al contenido de la vejiga, lo que a su vez conduce a una mayor distensibilidad de la vejiga con una mayor capacidad de la vejiga.
El cloruro de trospio se introdujo en el mercado como agente espasmolítico en 1967 (Patente Alemana 1 194 422). El cloruro de trospio ha estado disponible en una forma de administración sólida, administrable por vía oral (comprimidos y grageas), para inyección intravenosa o intramuscular como una solución, y para administración rectal como supositorios, y se usa principalmente para el tratamiento de disfunciones de la vejiga (incontinencia con tenesmo, hiperreflexia del detrusor). El producto ha sido comercializado en Alemania y varios países europeos más durante varios años para indicaciones terapéuticas específicas incluyendo frecuencia urinaria, tenesmo vesical, nocturia, e incontinencia con tenesmo asociada a inestabilidad del detrusor, síndrome de tenesmo vesical e hiperreflexia del detrusor.
Actualmente, en el mercado europeo existe un comprimido de cloruro de trospio de liberación inmediata (Spasmolyt), que está indicado para el tratamiento de incontinencia con tenesmo e hiperreflexia del detrusor y se usa como un comprimido de 20 mg tomado dos veces al día o bid (una dosis total de 40 mg al día). Al igual que otros compuestos de amonio cuaternario, el cloruro de trospio administrado por vía oral se absorbe lentamente, con el nivel máximo en sangre conseguido después de 5-6 horas. La biodisponibilidad oral es de aproximadamente el 10%, y se reduce significativamente con la ingesta de alimentos ricos en grasas. Existen efectos secundarios asociados al uso del régimen de cloruro de trospio dos veces al día, tales como sequedad bucal, dolor de cabeza, estreñimiento, dispepsia y dolor abdominal. Estos efectos secundarios se asocian con una alta concentración en sangre de cloruro de trospio. Además, estudios en los que se administró una dosis de liberación inmediata de 40 mg una vez al día dieron como resultado una mayor incidencia global de efectos adversos en comparación con 20 mg administrados dos veces al día.
Una administración una vez al día de trospio es ventajosa respecto a la administración dos veces al día en términos tanto de cumplimiento terapéutico por parte del paciente como de efectos secundarios reducidos, proporcionando de este modo un mejor tratamiento de las afecciones para las que está indicado el cloruro de trospio.
Para proporcionar una forma de dosis única diaria eficaz de trospio, existe una necesidad de enfoques de formulación única que proporcionen los efectos terapéuticos deseados al tiempo que minimizan, si no eliminan, los efectos secundarios no deseados mencionados anteriormente. Esto significa que la concentración de trospio en sangre mínima (Cmin) en equilibrio dinámico debe estar por encima de la concentración en sangre terapéuticamente eficaz mínima y la concentración de trospio en sangre máxima (Cmax) también en equilibrio dinámico debe estar por debajo de la concentración en sangre tóxica máxima durante el periodo de tratamiento. El cloruro de trospio y otros compuestos de amonio cuaternario muestran un marco de absorción limitado en el tracto gastrointestinal humano, presentando un desafío significativo para la formulación de una composición de administración una vez al día.
El documento WO 2004/000280 describe una composición farmacéutica que comprende núcleos no esféricos que contienen el ingrediente activo, el documento WO 2004/062577 describe una composición farmacéutica con dos o materiales de recubrimiento no entéricos. El documento WO 2004/096125 describe una forma de dosificación farmacéutica de liberación sostenida.
Sumario de la invención
Es un objeto de la presente invención proporcionar una composición farmacéutica de cualquier sal de trospio farmacéuticamente aceptable, típicamente cloruro de trospio, que pueda administrarse una vez al día pero alcance los niveles en sangre de equilibrio dinámico requeridos para el tratamiento o la prevención de enfermedades o afecciones que se beneficiarían de su actividad espasmolítica. Dicha enfermedad o afección incluye, y la presente invención se refiere principalmente a, disfunciones de vejiga tales como incontinencia con tenesmo o hiperreflexia del detrusor, nocturia y frecuencia urinaria.
El objeto se soluciona proporcionando una composición farmacéutica de acuerdo con la reivindicación 1. En las reivindicaciones dependientes se especifican realizaciones preferidas.
Dichas composiciones de dosis única diaria de una sal de trospio tienen como objetivo dar como resultado niveles de trospio en sangre en equilibrio dinámico promedio con niveles en sangre mínimo (Cmin) y máximo (Cmax) de aproximadamente 0,5-2,5 ng/ml y aproximadamente 2,0-6,0 ng/ml, respectivamente, niveles en sangre que han demostrado ser seguros y eficaces. Los niveles en sangre en equilibrio dinámico preferentemente promedian entre una Cmin de aproximadamente 0,75 ng/ml y una Cmax de aproximadamente 5,0 ng/ml, para formas de dosificación de la presente invención que corresponden a un régimen bid de 20 mg.
Una composición farmacéutica de liberación prolongada (XR), que contiene entre aproximadamente 25 mg y aproximadamente 60 mg de cloruro de trospio para administración una vez al día o qd, se caracteriza por tener el siguiente perfil de liberación in vitro en medio de disolución de tampón fosfato (pH 7,5): aproximadamente el 0-40% liberado en aproximadamente 1 hora, aproximadamente el 20-85% liberado en aproximadamente 4 horas y más del 70% liberado en aproximadamente 12 horas.
Una composición farmacéutica de liberación retardada (DR) contiene entre aproximadamente 25 mg y aproximadamente 80 mg de cloruro de trospio para administración una vez al día o qd, dependiendo de la duración de la fase de latencia. El retardo in vivo en la liberación puede ajustarse a medida a una aplicación particular, pero generalmente es de aproximadamente 0,5 horas a aproximadamente 6 horas, más preferentemente de aproximadamente 2,5 horas a aproximadamente 5 horas, tiempo durante el cual el trospio detectable en la sangre debe ser mínimo, si es que hay alguno. El perfil de liberación in vitro de dicha formulación se caracteriza generalmente por haber liberado menos de aproximadamente el 10% en medio ácido en 2 horas y más de aproximadamente el 80% liberado en medio tampón de pH 6,8 y superior en 1 hora.
La composición farmacéutica oral de la presente invención puede usarse en un método para tratar frecuencia urinaria, tenesmo vesical, nocturia e incontinencia con tenesmo asociada a inestabilidad del detrusor, síndrome de tenesmo vesical, e hiperreflexia del detrusor con administración una vez al día de cloruro de trospio.
Otro aspecto más de la invención proporciona una forma de dosificación única que permite una liberación adicional,
o pulso, de un fármaco con una corta semi-vida a aproximadamente la semi-vida (t1/2) del mismo. Dichas formas de dosificación son un desafío significativo de desarrollar cuando el fármaco es uno, tal como trospio, que tiene una región de absorción definida en el tracto GI superior, y... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica oral que contiene trospio, que a una dosificación de dosis única diaria dará niveles en sangre en equilibrio dinámico de trospio de un mínimo (Cmin) de 0,5 ng/ml y un máximo (Cmax) de 6,0 ng/ml, dicha composición es una combinación de un componente de cloruro de trospio XR y un componente de cloruro de trospio DR, en la que el componente de cloruro de trospio XR proporciona entre 10 mg y 40 mg de cloruro de trospio y en la que el componente de cloruro de trospio DR proporciona entre 10 mg y 40 mg de cloruro de trospio.
2. La composición de la reivindicación 1, en la que los niveles en sangre en equilibrio dinámico están entre 1,0 ng/ml y 5,0 ng/ml.
3. La composición de la reivindicación 1, en la que dicho componente XR comprende al menos un polímero de control de la liberación seleccionado entre Eudragit RL, Eudragit RS, dispersiones acuosas de etilcelulosa, hidroxietilcelulosa, hidroxipropilcelulosa, hidroxipropilmetilcelulosa, polivinilpirrolidona, copolímero de polivinilpirrolidona/acetato de vinilo y combinaciones de los mismos.
4. La composición de la reivindicación 1, en la que dicho componente DR comprende al menos un polímero entérico seleccionado entre acetato ftalato de celulosa, ftalato de hidroxipropilmetilcelulosa, acetato ftalato de polivinilo, acetato succinato de hidroxipropilmetilcelulosa, acetato trimelitato de celulosa, succinato de hidroxipropilmetilcelulosa, acetato succinato de celulosa, acetato hexahidroftalato de celulosa, propionato ftalato de celulosa, copolímero de ácido metilmetacrílico y metacrilato de metilo, copolímero de acrilato de metilo, metacrilato de metilo y ácido metacrílico, copolímero de éter metilvinílico y anhídrido maleico, copolímero de metacrilato de etilometacrilato de metilo-etilacrilato de clorotrimetilamonio, zeína, shellac y coloforia copal, carboximetiletilcelulosa, ácido metacrílico/ésteres metílicos de ácido metacrílico copolimerizados.
5. La composición de la reivindicación 1, en la que el componente XR contiene entre 20 y 40 mg de cloruro de trospio, y el componente DR contiene entre 20 mg y 40 mg de cloruro de trospio.
6. La composición de la reivindicación 5, en la que el componente XR contiene 30 mg de cloruro de trospio y el componente DR contiene 30 mg de cloruro de trospio.
7. La composición de la reivindicación 1, en una forma de dosificación seleccionada entre un gránulo, comprimido, pildorita, polvo, sobrecito, cápsula, gel, dispersión, solución o suspensión.
8. La composición de la reivindicación 7, en la que la forma de dosificación comprende pildoritas contenidas dentro de una cápsula.
9. La composición de la reivindicación 7, en la que la forma de dosificación comprende pildoritas que están comprimidas en un comprimido.
10. La composición de la reivindicación 5-6, que es un comprimido en capas, en el que cada capa contiene uno de los componentes.
11. La composición de la reivindicación 1, en la que el componente DR son pildoritas recubiertas con Eudragit L30D-55, que se disuelve a pH 5,5-6,0.
12. La composición de la reivindicación 1, en la que al menos una parte de dicho cloruro de trospio está contenido en una formulación de liberación retardada, que libera cloruro de trospio en el intestino grueso, el colon o en ambos.
13. Una composición farmacéutica de acuerdo con la reivindicación 12, para su uso en un método de administración enteral.
14. La composición de la reivindicación 1, en la que el componente DR son pildoritas recubiertas con Eudragit FS 30D, que se disuelve a pH 7,0.
Patentes similares o relacionadas:
Procedimiento de compuestos antifúngicos, del 22 de Julio de 2020, de NQP 1598, Ltd: Procedimiento para preparar un compuesto de fórmula 5 ó 5*, o una mezcla de los mismos: **(Ver fórmula)** comprendiendo el método: (a) hacer reaccionar un compuesto […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Productos terapéuticos basados en la lantionina sintetasa 2 tipo C, del 15 de Julio de 2020, de LANDOS BIOPHARMA, INC: Un compuesto de la fórmula: **(Ver fórmula)** o una sal o éster farmacéuticamente aceptable de este, en donde: Q es piperazina-1,4-diilo; […]
Derivados de piperidina en calidad de inhibidores de HDAC1/2, del 8 de Julio de 2020, de Regenacy Pharmaceuticals, Inc: Un compuesto de Fórmula IIIa: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde R1 se selecciona del grupo que consiste […]
Compuestos orgánicos, del 17 de Junio de 2020, de INTRA-CELLULAR THERAPIES, INC: Un compuesto de Fórmula I: **(Ver fórmula)** en forma libre o de sal, donde: R1 y R2 son independientemente H o alquilo C1-4 (por ejemplo, metilo o […]
Compuestos ahorradores de PPAR para el tratamiento de enfermedades metabólicas, del 3 de Junio de 2020, de Metabolic Solutions Development Company LLC (100.0%): Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: cada uno de R1 y R2 se selecciona independientemente entre […]
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]
Nuevos usos terapéuticos de derivados de la bencilidenguanidina para el tratamiento de proteopatías, del 20 de Mayo de 2020, de InFlectis BioScience: Compuesto de la fórmula (I), o una sal farmacéuticamente aceptable del mismo, **(Ver fórmula)** o un tautómero de los mismos donde: […]