Esferoides farmacéuticos.
Una preparación farmacéutica que comprende esferoides, estando los esferoides en forma de una matriz que comprende,
como adyuvante de esferonización, entre el 20 y el 95 % (p/p) de monoestearato de glicerilo, estando el porcentaje en peso basado en el peso de todo el núcleo del esferoide, y un aglutinante polimérico en ausencia de celulosa microcristalina.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2007/050129.
Solicitante: EURO-CELTIQUE S.A..
Nacionalidad solicitante: Luxemburgo.
Dirección: 2, AVENUE CHARLES DE GAULLE 1653 LUXEMBOURG LUXEMBURGO.
Inventor/es: MOHAMMAD, HASSAN, WALDEN,MALCOLM, DANAGHER,Helen Kathleen, HAYES,Geoffrey Gerard, WHITEHOUSE,Jonathon Oliver.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/485 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Derivados del morfinano, p. ej. morfina, codeína.
- A61K9/16 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Aglomerados; Granulados; Microbolitas.
- A61K9/50 A61K 9/00 […] › Microcápsulas (A61K 9/52 tiene prioridad).
PDF original: ES-2516693_T3.pdf




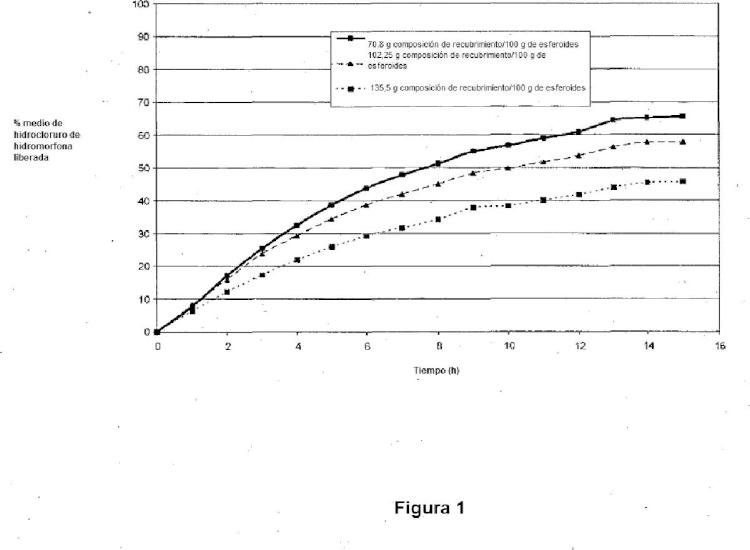
Fragmento de la descripción:
Esferoides farmacéuticos La presente invención se refiere a una composición farmacéutica para administración oral y a un procedimiento a escala comercial para su preparación. En particular, la invención se refiere a una composición farmacéutica que comprende esferoides que comprenden monoestearato de glicerilo, un aglutinante polimérico y un agente terapéuticamente activo, y a un procedimiento a escala comercial para su fabricación.
Antecedentes de la invención
La formación de esferoides farmacéuticos usando técnicas e extrusión y esferonización es bien conocida en la industria farmacéutica y normalmente requiere la inclusión de un auxiliar de esferonización para proporcionar formulaciones con la integridad estructural, plasticidad y capacidad de absorción de agua necesarias requeridas para el éxito en la formación de esferoides.
Normalmente, los esferoides farmacéuticos se fabrican a escala industrial mediante, en primer lugar, la mezcla del o los principios activos, un auxiliar de esferonización y cualquier otro excipiente en un mezclador o granulador adecuadamente dimensionado, por ejemplo un Vactron 300 o un Collette Gral 300, la extrusión de la mezcla/granulado en un extrusor tal como un extrusor Nica E140, antes de la esferonización del extrudido usando un esferonizador, por ejemplo un esferonizador Caleva o Nica S450 y, por último, secar los esferoides resultantes en un secador adecuado, tal como un secador de lecho fluido del tipo fabricado por Glatt y Aeromatic Fielder.
El auxiliar de esferonización usado de forma rutinaria en la industria farmacéutica es celulosa microcristalina.
Un problema que se ha observado con el uso de celulosa microcristalina es la degradación de ciertos fármacos durante un almacenamiento prolongado.
Por ejemplo, los inventores han descubierto que en los esferoides que contienen celulosa microcristalina, el clorhidrato de hidromorfona sufre cierta degradación cuando se almacena a 25 º C/HR de 60 %. Los inventores han descubierto que esta degradación del producto se debe a una incompatibilidad entre el clorhidrato de hidromorfona y la celulosa microcristalina catalizada por la presencia de humedad. Los esferoides hechos principalmente de celulosa microcristalina generalmente retienen aproximadamente el 5 % de humedad.
Basit et al. (1999) han informado de la aparición de la inestabilidad del fármaco altamente soluble en agua, ranitidina, cuando se formulan como una forma de dosificación de gránulos que contiene más de 60 % de celulosa microcristalina, implicando la inestabilidad degradación química del fármaco por medio de una compleja interacción de tres vías entre la ranitidina, la celulosa microcristalina y el agua. Los autores describen la preparación de esferoides farmacéuticos de clorhidrato de ranitidina, que utilizan monoestearato de glicerilo y sulfato de bario en lugar de celulosa microcristalina, utilizando equipos de laboratorio pequeña escala.
Newton et al. (2004) describen la preparación a escala de laboratorio de esferoides farmacéuticos que contienen sulfato de bario o diclofenaco sódico como modelo de fármaco y monoestearato de glicerilo como reemplazo total de celulosa microcristalina.
Chatchawalsaisin et al. (2005) describen la preparación a escala de laboratorio de esferoides farmacéuticos que contienen diclofenaco sódico como modelo de fármaco y monoestearato de glicerilo como reemplazo total de celulosa microcristalina.
Un problema con el trabajo descrito por Basit et al., Newton et al. y Chatchawalsaisin et al. es que la operación de los procedimientos descritos utilizando los resultados de un equipo a escala industrial en esferoides fragmentados que no pueden usarse comercialmente.
En el documento WO 00/09639 (Fuisz Technologies Limited) se describe la preparación de microesferas que 55 contienen combinaciones de ésteres grasos y tensioactivos o emulsionantes opcionales como adyuvantes del procesamiento y agente (s) activo (s) en condiciones Liquiflash utilizando los dispositivos y procesos de centrifugación como se describe en las Patentes de EE.UU. 5.458.823 opcionales; 5.638.720; y 5.851.454.
En la técnica existe la necesidad de composiciones farmacéuticas alternativas en forma de esferoides que comprenden un adyuvante de la esferonización compatible químicamente y un principio activo, que están libres o sustancialmente libres de celulosa microcristalina y que, preferentemente, pueden fabricarse con éxito a escala industrial para su comercialización. En particular, el principio activo puede ser uno que sea sensible a la degradación química en presencia de celulosa microcristalina.
Milojevic et al. (1996) describen la preparación de gránulos que contienen glucosa, celulosa microcristalina y monoestearato de glicerilo por extrusión y esferonización, y el recubrimiento de estos gránulos con una formulación
de amilosa, Ethocel®, utilizando un recubridor de lecho fluidizado a escala de laboratorio.
Chopra et al. (2002) describen gránulos que contienen paracetamol, celulosa microcristalina, monoestearato de glicerilo y sulfato de bario, que se produjeron usando un aparato de extrusión y esferonización a escala de 5 laboratorio, antes de ser recubierto con una solución al 3 % de etilcelulosa en etanol que contiene 17, 5 % de povidona.
Bashaiwoldu et al. (2004) describen la producción de gránulos esféricos que contienen paracetamol, celulosa microcristalina y monoestearato de glicerilo mediante los procedimientos de extrusión y esferonización, y el recubrimiento de estos gránulos con una dispersión acuosa de una solución de dibutilsebacato que contiene celulosa de etilo, ácido oleico e hidróxido de amonio usando un recubridor de lecho fluido.
En la técnica sigue existiendo la necesidad adicional de una composición farmacéutica en forma de esferoides recubiertos que comprenden un adyuvante de la esferonización compatible químicamente y un principio activo, que están libres o sustancialmente libres de celulosa microcristalina y que, preferentemente, pueden fabricarse con éxito a escala industrial para su comercialización. En particular, el principio activo puede ser uno que sea sensible a la degradación química en presencia de celulosa microcristalina.
Sumario de la invención
De acuerdo con la presente invención, los inventores proporcionan esferoides farmacéuticos que comprenden una matriz que contiene monoestearato de glicerilo y un aglutinante polimérico y nada o sustancialmente nada de celulosa microcristalina.
En un segundo aspecto, la invención se refiere a esferoides farmacéuticos según la invención que se proporcionan con un recubrimiento.
En un tercer aspecto de la invención, los inventores proporcionan esferoides farmacéuticos de acuerdo con la invención para su uso como un medicamento.
En un cuarto aspecto, la invención se refiere a un proceso a escala industrial para la producción de los esferoides farmacéuticos de acuerdo con la invención.
En otro aspecto, la invención proporciona un procedimiento de impartir estabilidad durante el almacenamiento a esferoides farmacéuticas que contienen un ingrediente terapéuticamente activo que es sensible a la degradación química en presencia de celulosa microcristalina.
Es un aspecto adicional de la invención proporcionar un procedimiento para aumentar la vida útil de una composición farmacéutica que comprende esferoides que contienen un ingrediente terapéuticamente activo que es sensible a la degradación química en presencia de celulosa microcristalina.
Descripción detallada de la invención
En la industria farmacéutica, el adyuvante de esferonización utilizado es casi exclusivamente celulosa 45 microcristalina. Durante la granulación en húmedo de una mezcla farmacéutica, la celulosa microcristalina puede contener una cantidad significativa de agua que es necesaria para producir una masa húmeda que tiene la consistencia deseada y la reología para la extrusión y esferonización.
Los esferoides hechos con un gran contenido de celulosa microcristalina pueden retener aproximadamente un 5 % de humedad después del secado. Es este nivel relativamente alto de humedad residual el que se cree que contribuye a la inestabilidad de ciertos fármacos en presencia de celulosa microcristalina. Por tanto, es deseable sustituir la celulosa microcristalina por un adyuvante de esferonización alternativa que es químicamente compatible con el o los fármaco (s) , pero que permita la fabricación a escala industrial por extrusión/esferonización.
Los inventores han descubierto que el uso de monoestearato de glicerilo y un aglutinante polimérico como adyuvante... [Seguir leyendo]
Reivindicaciones:
1. Una preparación farmacéutica que comprende esferoides, estando los esferoides en forma de una matriz que comprende, como adyuvante de esferonización, entre el 20 y el 95 % (p/p) de monoestearato de glicerilo, estando el porcentaje en peso basado en el peso de todo el núcleo del esferoide, y un aglutinante polimérico en ausencia de celulosa microcristalina.
2. Una preparación farmacéutica de acuerdo con la reivindicación 1, en la que la matriz comprende además un agente humectante.
3. Una preparación farmacéutica de acuerdo con la reivindicación 2, en la que el agente humectante es polisorbato
80.
4. Una preparación farmacéutica de acuerdo con una cualquiera de las reivindicaciones anteriores, en la al menos 15 un ingrediente terapéuticamente activo está contenido en la matriz.
5. Una preparación farmacéutica de acuerdo con la reivindicación 4, en la que el o los agente (s) terapéuticamente activo (s) se pueden seleccionar de analgésicos, agentes antianginosos, agentes antiarrítmicos, agentes antibacterianos, agentes antihipertrofia prostática benigna, anticoagulantes, antidepresivos, antidiabéticos, antiepilépticos, agentes antifúngicos, agentes antigota, agentes antihipertensores, agentes antiinflamatorios, antipalúdicos, agentes antimigrañosos, agentes antimuscarínicos, agentes antineoplásicos, agentes antiobesidad, agentes antiosteoporosis, agentes antiparkinsonianos, agentes antiprotozoarios, agentes antitiroideos, agentes antiincontinencia urinaria, agentes antivíricos, agentes antihelmínticos, agentes ansiolíticos, betabloqueantes, agentes inotrópicos cardiacos, potenciadores de la cognición, corticosteroides, inhibidores de la COX2, diuréticos, agentes de mejora de la disfunción eréctil, ácidos grasos esenciales y no esenciales, agentes gastrointestinales, antagonistas de los receptores de histamina, hipnóticos, inmunosupresores, queratolíticos, inhibidores de los leucotrienos, agentes reguladores de los lípidos, macrólidos, relajantes musculares, neurolépticos, agentes nutricionales, opioides, inhibidores de la proteasa, sedantes, hormonas sexuales y estimulantes.
6. Una preparación farmacéutica de acuerdo con la reivindicación 5, que comprende como principio activo un opioide elegido de alfentanilo, alilprodina, alfaprodina, anileridina, bencilmorfina, bezitramida, buprenorfina, butoríanol, clonitaceno, codeína, ciclazocina, desomorfina, dextromoramida, dezocina, diamorfina, diampromida, dihidrocodeína, dihidromorfina, dimenoxadol, dimefeptanol, dimetiltiambuteno, butirato de dioxiaphetilo, , dipipanona, eptazocina, etoheptazina , etilmetiltiambuteno, etilmorfina, etonitaceno, fentanilo, hidrocodona, hidromorfona, hidroxipetidina, isometadona, cetobemidona, levaloríano, levoríanol, levofenacilmoríano, lofentanilo, meperidina, meptazinol, metazocina, metadona, metopón, morfina, nalbufina, naloxona, naltrexona, narceína, nicomorfina, norlevoríanol, normetadona, nalorfina, normorfina, norpipanona, opio, oxicodona, oximorfona, papaveretum, pentazocina, fenadoxona, fenomoríano, fenazocina, fenoperidina, piminodina, piritramida, proheptacina, promedol, properidina, propiram, propoxifeno, sufentanilo, tramadol y tilidina, y sales y complejos farmacéuticamente aceptables de los mismos.
7. Una preparación farmacéutica de acuerdo con la reivindicación 6, en la que el opioide es clorhidrato de hidromorfona y la matriz contiene nada o sustancialmente nada de celulosa microcristalina.
8. Una preparación farmacéutica de acuerdo con cualquiera de las reivindicaciones anteriores, que comprende una cápsula que contiene una pluralidad de dichos esferoides y siendo adecuada para administración oral.
9. Una preparación farmacéutica en forma de un comprimido que comprende esferoides de acuerdo con una cualquiera de las reivindicaciones 1 a 7 y excipientes de formación de comprimidos.
10. Un procedimiento para preparar esferoides, estando los esferoides en forma de una matriz que comprende, como adyuvante de esferonización, entre el 20 y el 95 % (p/p) de monoestearato de glicerilo, estando el porcentaje en peso basado en el peso de todo el núcleo del esferoide, y un aglutinante polimérico en ausencia de celulosa microcristalina, comprendiendo el procedimiento las etapas de:
a) formar una masa húmeda extruible que comprende monoestearato de glicerilo, agua y aglutinante polimérico; b) extruir la masa húmeda; c) esferonizar el extrudido; d) secar y tamizar los esferoides resultantes; y e) recubrir opcionalmente los esferoides secos, en donde el procedimiento se lleva a cabo a escala comercial.
11. Esferoides recubiertos adecuados para su uso en una preparación farmacéutica que comprenden un núcleo de 65 matriz que comprende, como adyuvante de la esferonización, entre el 30 y el 95 % (p/p) de monoestearato de glicerilo, estando el % (p/p) basado en el peso de los esferoides no recubiertos, y una aglutinante polimérico, y un
recubrimiento que rodea el núcleo de matriz, en donde el núcleo de la matriz comprende nada o sustancialmente nada de celulosa microcristalina.
12. Esferoides de la reivindicación 11, en los que la matriz comprende además un agente humectante. 5
13. Esferoides de acuerdo con la reivindicación 12, en los que el agente humectante es polisorbato 80.
14. Esferoides de acuerdo con una cualquiera de las reivindicaciones 11 a 13, en los que el recubrimiento es un recubrimiento de película que tiene ninguna o sustancialmente ninguna propiedad de control de la liberación.
15. Esferoides de acuerdo con una cualquiera de las reivindicaciones 11 a 13, en los que el recubrimiento es un recubrimiento de liberación controlada.
16. Esferoides de acuerdo con la reivindicación 15, en los que el recubrimiento comprende uno o más materiales
seleccionados de ceras insolubles en agua, polímeros insolubles en agua, polímeros solubles en agua, celulosas insolubles en agua y celulosas solubles en agua.
17. Esferoides de acuerdo con la reivindicación 16, en los que los polímeros insolubles en agua comprenden polimetacrilatos.
18. Esferoides de acuerdo con las reivindicaciones 16 o 17, en los que las celulosas insolubles en agua comprenden etilcelulosa.
19. Esferoides de acuerdo con las reivindicaciones 16, 17 o 18, en los que los polímeros solubles en agua 25 comprenden polivinilpirrolidona.
20. Esferoides de acuerdo con una cualquiera de las reivindicaciones 16 a 19, en los que las celulosas solubles en agua comprenden hidroxipropilmetilcelulosa e hidroxipropilcelulosa.
21. Esferoides de acuerdo con una cualquiera de las reivindicaciones 11 a 20, en los que la matriz contiene del 50 al 95 % en p/p de monoestearato de glicerilo.
22. Esferoides de acuerdo con la reivindicación 21, en los que la matriz contiene del 75 al 95 % en p/p de
monoestearato de glicerilo. 35
23. Esferoides de acuerdo con la reivindicación 22, en los que la matriz contiene del 90 al 95 % en p/p de monoestearato de glicerilo.
24. Esferoides de acuerdo con una cualquiera de las reivindicaciones 11 a 23, en los que el aglutinante polimérico se elige a partir de polímeros de polivinilpirrolidona, carboxipolimetileno y ácido acrílico.
25. Esferoides de acuerdo con una cualquiera de las reivindicaciones 11 a 24, en los que la matriz contiene del 2 al 9 % en p/p de polivinilpirrolidona.
26. Esferoides de acuerdo con la reivindicación 25, en los que la matriz contiene del 2, 5 % al 7, 5 % en p/p de polivinilpirrolidona.
27. Esferoides de acuerdo con la reivindicación 26, en los que la matriz contiene del 4 % al 5 % en p/p de polivinilpirrolidona.
28. Esferoides de acuerdo con una cualquiera de las reivindicaciones 11 a 27, en los que al menos un ingrediente terapéuticamente activo está presente en la matriz.
29. Esferoides de acuerdo con la reivindicación 28, en la que el o los agente (s) terapéuticamente activo (s) se
pueden seleccionar de analgésicos, agentes antianginosos, agentes antiarrítmicos, agentes antibacterianos, agentes antihipertrofia prostática benigna, anticoagulantes, antidepresivos, antidiabéticos, antiepilépticos, agentes antifúngicos, agentes antigota, agentes antihipertensores, agentes antiinflamatorios, antipalúdicos, agentes antimigrañosos, agentes antimuscarínicos, agentes antineoplásicos, agentes antiobesidad, agentes antiosteoporosis, agentes antiparkinsonianos, agentes antiprotozoarios, agentes antitiroideos, agentes antiincontinencia urinaria, agentes antivíricos, agentes antihelmínticos, agentes ansiolíticos, betabloqueantes, agentes inotrópicos cardiacos, potenciadores de la cognición, corticosteroides, inhibidores de la COX2, diuréticos, agentes de mejora de la disfunción eréctil, ácidos grasos esenciales y no esenciales, agentes gastrointestinales, antagonistas de los receptores de histamina, hipnóticos, inmunosupresores, queratolíticos, inhibidores de los leucotrienos, agentes reguladores de los lípidos, macrólidos; relajantes musculares, neurolépticos, agentes 65 nutricionales, opioides, inhibidores de la proteasa, sedantes, hormonas sexuales y estimulantes.
30. Esferoides de acuerdo con la reivindicación 29, que comprende como principio activo un opioide elegido de alfentanilo, alilprodina, alfaprodina, anileridina, bencilmorfina, bezitramida, buprenorfina, butoríanol, clonitaceno, codeína, ciclazocina, desomorfina, dextromoramida, dezocina, diamorfina, diampromida, dihidrocodeína, dihidromorfina, dimenoxadol, dimefeptanol, dimetiltiambuteno, butirato de dioxiaphetilo, , dipipanona, eptazocina, 5 etoheptazina , etilmetiltiambuteno, etilmorfina, etonitaceno, fentanilo, hidrocodona, hidromorfona, hidroxipetidina, isometadona, cetobemidona, levaloríano, levoríanol, levofenacilmoríano, lofentanilo, meperidina, meptazinol, metazocina, metadona, metopón, morfina, nalbufina, naloxona, naltrexona, narceína, nicomorfina, norlevoríanol, normetadona, nalorfina, normorfina, norpipanona, opio, oxicodona, oximorfona, papaveretum, pentazocina, fenadoxona, fenomoríano, fenazocina, fenoperidina, piminodina, piritramida, proheptacina, promedol, properidina, propiram, propoxifeno, sufentanilo, tramadol y tilidina, y sales y complejos farmacéuticamente aceptables de los mismos.
31. Esferoides de acuerdo con la reivindicación 30, en donde el opioide es clorhidrato de hidromorfona y la matriz
contiene nada o sustancialmente nada de celulosa microcristalina. 15
32. Un procedimiento para la preparación de esferoides como se define en la reivindicación 11, que comprende las etapas de:
a) formar una masa húmeda extruible que comprende monoestearato de glicerilo, agua y aglutinante polimérico;
b) extruir la masa húmeda; c) esferonizar el extrudido; d) secar y tamizar los esferoides resultantes; e) recubrir los esferoides secos.
33. Un procedimiento de acuerdo con la reivindicación 32, en el que el material de recubrimiento comprende uno o más materiales seleccionados de ceras insolubles en agua, polímeros insolubles en agua, polímeros solubles en agua, celulosas insolubles en agua y celulosas solubles en agua.
34. Un esferoide que contiene, como adyuvante de la esferonización, monoestearato de glicerilo y un aglutinante polimérico, y que comprende además clorhidrato de hidromorfona y, opcionalmente, un agente humectante, en donde el esferoide no contiene nada o sustancialmente nada de celulosa microcristalina, y está rodeado por un recubrimiento de liberación controlada que comprende uno o más materiales elegidos de ceras insolubles en agua, polímeros insolubles en agua y polímeros solubles en agua.
35. Una forma farmacéutica de dosificación unitaria que comprende esferoides como se define en cualquiera de las reivindicaciones anteriores, conteniendo la forma de dosificación unitaria 2 mg, 4 mg, 8 mg, 16 mg o 24 mg de clorhidrato de hidromorfona.
36. Una forma farmacéutica de dosificación unitaria de acuerdo con la reivindicación 35, que contiene 4 mg de clorhidrato de hidromorfona y que, cuando se administra a sujetos sanos en un estudio de dosis única, proporciona una Cmáx media y una media AUC0-inf, cuyos intervalos de confianza del 90 % están dentro del ± 20 % de 1, 16 ng/ml y 10, 35 ng.h/ml, respectivamente.
Patentes similares o relacionadas:
Regímenes de dosificación de buprenorfina, del 1 de Julio de 2020, de Indivior UK Limited: Buprenorfina para su uso en un método para tratar el trastorno por uso de opioides en un ser humano que lo necesite, que comprende las etapas […]
 Forma de dosificación llena de líquido, disuasoria del abuso y de liberación inmediata, del 24 de Junio de 2020, de Pharmaceutical Manufacturing Research Services, Inc: Una cápsula disuasoria del abuso de liberación inmediata, que comprende:
(a) un principio activo susceptible de abuso;
(b) un primer polietilenglicol (PEG) […]
Forma de dosificación llena de líquido, disuasoria del abuso y de liberación inmediata, del 24 de Junio de 2020, de Pharmaceutical Manufacturing Research Services, Inc: Una cápsula disuasoria del abuso de liberación inmediata, que comprende:
(a) un principio activo susceptible de abuso;
(b) un primer polietilenglicol (PEG) […]
Gránulos de dispersión rápida, comprimidos de desintegración oral y métodos, del 3 de Junio de 2020, de Adare Pharmaceuticals, Inc: Microgránulos de dispersión rápida, farmacéuticamente aceptables, que tienen una mediana del tamaño de partícula en el rango de 100 μm a 300 […]
Pulverizador de buprenorfina sublingual, del 22 de Abril de 2020, de Fresh Cut Development, LLC: Una formulación de pulverización sublingual que comprende una cantidad efectiva de buprenorfina, o una sal farmacéuticamente aceptable de la misma, […]
Dispositivos de administración transdérmica resistentes al abuso y composiciones que comprenden un agonista de opioides y un derivado N-óxido no administrado por vía transdérmica de un antagonista de opioide para el tratamiento del dolor, del 22 de Abril de 2020, de EURO-CELTIQUE S.A.: Un dispositivo de administración transdérmica que comprende una composición farmacéutica, en el que dicha composición comprende un derivado […]
Formulación farmacéutica a base de ibuprofeno y codeína que tiene estabilidad mejorada, del 15 de Abril de 2020, de FARMASIERRA MANUFACTURING S.L: Formulación farmacéutica a base de ibuprofeno y codeínade estabilidad mejorada. La invención consiste en una nueva formulación farmacéuticaen forma […]
Parche transdérmico de oximorfona, del 8 de Abril de 2020, de Buzzz Pharmaceuticals Limited: Un parche transdérmico que tiene una capa que contiene el fármaco que comprende oximorfona o una sal farmacéuticamente aceptable de la misma, […]
Composiciones de buprenorfina y antagonistas del receptor de opioides mu, del 1 de Abril de 2020, de Alkermes Pharma Ireland Limited: Una composición que comprende buprenorfina y un antagonista del receptor opioide μ, en donde la composición está caracterizada por un Índice […]