ENSAYOS DE ÁCIDOS NUCLEICOS.
LA PRESENTE INVENCION TRATA DE LA DETECCION DE SECUENCIAS DE ACIDOS NUCLEICOS ESPECIFICAS,
UTILIZANDO O NO UN PROCEDIMIENTO DE AMPLIFICACION DE SECUENCIAS DE ACIDOS NUCLEICOS ESPECIFICAS. DE FORMA MAS CONCRETA, LA INVENCION DESCRIBE COMPOSICIONES Y PROCEDIMIENTOS MEJORADOS PARA REDUCIR EL RIESGO DE CONTAMINACION PROCEDENTE DE LA MANIPULACION DE LOS REACTIVOS, LOS CONTROLES INTERNOS PARA LA AMPLIFICACION, Y EL USO DE APARATOS AUTOMATICOS PARA LA DETECCION AUTOMATICA DE UNA O MAS DE LAS SECUENCIAS DE ACIDOS NUCLEICOS AMPLIFICADAS
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E98303458.
Solicitante: BIOMERIEUX VITEK, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 595 ANGLUM DRIVE HAZELWOOD, MISSOURI 63042-2905 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MCKINLEY, GEOFF, A., KLUTTZ,BRYAN W, BURG,J. LAWRENCE, CATANZARIT,LUIGI, VERA-GARCIA,MARCELA, MOE,JAMES G.
Fecha de Publicación: .
Fecha Solicitud PCT: 1 de Mayo de 1998.
Fecha Concesión Europea: 15 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- C12Q1/68B10
- C12Q1/68D
- G01N35/02E
Clasificación PCT:
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
Clasificación antigua:
- B01L1/00 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01L APARATOS DE LABORATORIO PARA LA QUIMICA O LA FISICA, DE USO GENERAL (aparatos de uso médico o farmacéutico A61; aparatos para aplicaciones industriales o aparatos de laboratorio cuya estructura y funciones son comparables a las de aparatos industriales similares, ver las clases relativas a los aparatos industriales, en particular las subclases B01 y C12; aparatos de separación o de destilación B01D; dispositivos de mezcla o de agitación B01F; atomizadores B05B; tamices, cribas B07B; tapones, capuchones B65D; manipulación de líquidos en general B67; bombas de vacío F04; sifones F04F 10/00; grifos, válvulas F16K; tubos, empalmes para tubos F16L; aparatos especialmente adaptados al estudio y análisis de materiales G01, particularmente G01N; aparatos eléctricos u ópticos, ver las subclases apropiadas en las secciones G y H). › Recintos; Cámaras (campanas de humo B08B; provistas de dispositivos de manipulación, cajas para guantes B25J; cámaras frías F25D).
- C12N15/11 C12 […] › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
- C12Q1/68 C12Q 1/00 […] › en los que intervienen ácidos nucleicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Irlanda, Finlandia, Chipre.
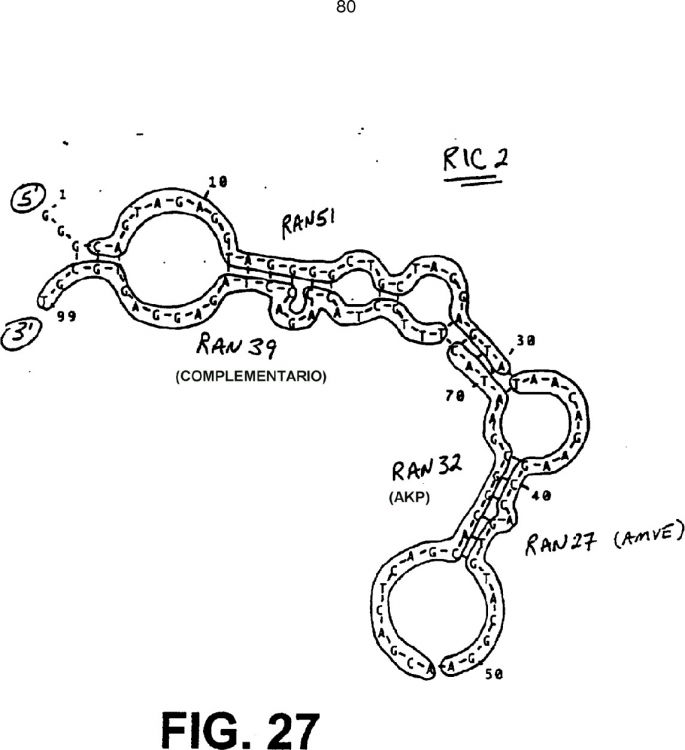
Fragmento de la descripción:
La presente invención se refiere a la detección de secuencias de ácidos nucleicos específicas en una muestra de ensayo diana.
En particular, la presente invención se refiere a la detección automática de secuencias de ácidos nucleicos específicas que son secuencias de ácidos nucleicos no amplificadas o amplificadas (amplicones).
Además, la presente invención se refiere al uso de amplificaciones automáticas, procedimientos y composiciones para controlar una amplificación exitosa, procedimientos mejorados para reducir las posibilidades de contaminación y al uso de tampones de reacción unificados y alícuotas de dosis unitaria de componentes de reacción para la amplificación.
El desarrollo de técnicas para la manipulación de ácidos nucleicos, la amplificación de dichos ácidos nucleicos cuando sea necesario y la posterior detección de secuencias específicas de ácidos nucleicos o amplicones ha generado ensayos específicos de secuencia de ácido nucleico y extremadamente sensibles para el diagnóstico de enfermedades y/o la identificación de organismos patógenos en una muestra de ensayo.
Cuando sea necesario, la amplificación enzimática de secuencias de ácidos nucleicos aumentará la capacidad de detectar dichas secuencias de ácidos nucleicos. Generalmente, los esquemas de amplificación conocidos actualmente se pueden agrupar ampliamente en dos clases basadas en si las reacciones de amplificación enzimática están dirigidas por ciclado continuo de la temperatura entre la temperatura de desnaturalización, la temperatura de hibridación de cebadores y la temperatura de síntesis del amplicón (producto de la amplificación enzimática de ácidos nucleicos), o si la temperatura se mantiene constante durante todo el procedimiento de amplificación enzimática (amplificación isotérmica). Son tecnologías de amplificación de ácidos nucleicos por ciclado típicas (termociclado) la reacción en cadena de la polimerasa (PCR) y la reacción en cadena de la ligasa (LCR). Se analizan protocolos específicos para dichas reacciones en, por ejemplo, Short Protocols in Molecular Biology, 2ª Edición, A Compendium of Methods from Current protocols in Molecular Biology, (Ed. Ausubel y col., John Wiley & Sons, Nueva York, 1992) capítulo 15. Las reacciones que son isotérmicas incluyen: la amplificación mediada por transcripción (TMA), la amplificación basada en la secuencia de ácido nucleico (NASBA) y la amplificación con desplazamiento de cadena (SDA).
Los documentos de Patente de Estados Unidos que analizan la amplificación de ácidos nucleicos incluyen 4.683.195; 4.683.202; 5.130.238; 4.876.187; 5.030.557; 5.399.491; 5.409.818; 5.485.184; 5.409.818; 5.554.517; 5.437.990 y 5.554.516. Se sabe bien que procedimientos como los descritos en estas patentes permiten la amplificación y la detección de ácidos nucleicos sin necesidad de clonación y son responsables de los ensayos más sensibles para secuencias de ácidos nucleicos. Sin embargo, está igualmente bien reconocido que junto con la sensibilidad de detección posible con la amplificación de ácidos nucleicos, la facilidad de contaminación por cantidades mínimas de secuencias de ácidos nucleicos exógenas no deseadas es sumamente alta. La contaminación por ácidos nucleicos de ADN o ARN exógenos no deseados es igualmente probable. La utilidad de las reacciones de amplificación se aumentará mediante procedimientos para controlar la introducción de ácidos nucleicos exógenos no deseados y otros contaminantes.
Antes del descubrimiento de enzimas termoestables, los procedimientos que usaban el termociclado se hacían extremadamente difíciles debido a las necesidades de adición de enzima fresca después de cada etapa de desnaturalización, puesto que inicialmente las temperaturas elevadas necesarias para la desnaturalización también inactivaban las polimerasas. Una vez que se descubrieron las enzimas termoestables, la amplificación cíclica de ácidos nucleicos se convirtió en un procedimiento mucho más simplificado en el que la adición de enzima sólo era necesaria al principio de la reacción. Por tanto, los tubos de reacción no tenían que abrirse y no tenía que añadirse nueva enzima durante la reacción, lo que permitió una mejora en la eficacia y precisión ya que se redujo el riesgo de contaminación y se redujo también el coste de las enzimas. Un ejemplo de enzima termoestable es la polimerasa aislada del organismo Thermophilus aquaticus.
En general, la amplificación isotérmica puede requerir la actividad combinada de múltiples actividades enzimáticas para las que no se han descrito variantes termoestables óptimas. La etapa inicial de una reacción de amplificación requerirá normalmente la desnaturalización de la diana de ácido nucleico, por ejemplo en la reacción de TMA, la etapa de desnaturalización inicial es normalmente ≥65ºC, pero puede ser típicamente ≥95ºC, y se usa cuando es necesaria para eliminar la estructura secundaria del ácido nucleico diana.
La mezcla de reacción se enfría después a una temperatura menor que permite la hibridación de cebadores, y es la temperatura de reacción óptima para las actividades combinadas de las enzimas de amplificación. Por ejemplo, en la TMA las enzimas son generalmente una ARN polimerasa T7 y una transcriptasa inversa (que incluye actividad RNasa H endógena). La temperatura de la reacción se mantiene constante durante todo el ciclo de amplificación isotérmica posterior.
Debido a la ausencia de enzimas termoestables adecuadas, algunas amplificaciones isotérmicas requerirán generalmente la adición de enzimas a la mezcla de reacción después de la desnaturalización a alta temperatura y el enfriamiento a una temperatura más baja. Esta necesidad es poco práctica y requiere la apertura del tubo de reacción de amplificación, que
introduce una oportunidad clave para la contaminación.
Por tanto, sería más útil si dichas reacciones se pudieran realizar más fácilmente con un riesgo reducido de contaminación por procedimientos que permitirían una desnaturalización y amplificación integradas sin la necesidad de una transferencia manual de enzimas.
Los protocolos de reacción típicos requieren el uso de varios tampones diferentes, diseñados para optimizar la actividad de la enzima particular que se esté usando en determinadas etapas en la reacción, o para la resuspensión óptima de los componentes de reacción. Por ejemplo, aunque un tampón de amplificación de PCR 10x típico contendrá KCl 500 mM y Tris HCl 100 mM, pH 8,4, la concentración de MgCl2 dependerá de la secuencia diana de ácido nucleico y del conjunto de cebadores de interés. El tampón de transcripción inversa (5x) contiene típicamente Tris-Cl 400 mM, pH 8,2; KCl 400 mM y MgCl2 300 mM, mientras que el tampón de la transcriptasa inversa del virus de la leucemia de Maloney murino (5x) contiene típicamente Tris-Cl 250 mM, pH 8,3; KCl 375 mM; DTT 50 mM (Ditiotreitol) y MgCl2 15 mM.
Aunque estos tampones de reacción se pueden preparar a granel a partir de productos químicos de soluciones madre, los productos de amplificación más disponibles en el mercado proporcionan tampones específicos y reactivos envasados a granel para su uso con el protocolo de amplificación. Por ejemplo, los ensayos de amplificación manuales disponibles en el mercado para la detección de patógenos clínicamente significativos (por ejemplo ensayos de detección de Chlamydia y Mycobacterium tuberculosis de GenProbe Inc.) requieren varias manipulaciones manuales para realizar el ensayo, incluyendo la dilución de la muestra ensayo en un tampón de dilución de muestras (SDB), la combinación de la muestra diluida con reactivos de reacción de amplificación tales como oligonucleótidos y cebadores/promotores oligonucleotídicos específicos que se han reconstituido en un tampón de reconstitución de amplificación (ARB) y, finalmente, la adición a esta mezcla de reacción de enzimas reconstituidas en un tampón de dilución de enzimas (EDB).
La preparación y uso de múltiples tampones que requiere múltiples adiciones manuales a la mezcla de reacción introduce una mayor posibilidad de contaminación. Sería más útil tener un tampón unificado único que se pudiera usar en todas las fases de un protocolo de amplificación. En particular, con los ensayos de TMA disponibles en el mercado descritos anteriormente, la necesidad de tres tampones complica mucho la automatización de dicho protocolo.
El envasado a granel de la enzima u otros componentes de reacción por los fabricantes...
Reivindicaciones:
1. Un procedimiento para la detección de la presencia o ausencia de un primer ácido nucleico monocatenario o bicatenario en una muestra por amplificación isotérmica automática de dicho primer ácido nucleico en un recipiente de reacción de doble cámara, comprendiendo dicho recipiente de reacción de doble cámara dos cámaras de reacción, una primera y una segunda, que pueden situarse en comunicación fluida entre sí, de modo que dicha comunicación fluida puede interrumpirse de forma controlable, caracterizado porque comprende:
(a) combinar en dicha primera cámara de reacción: una muestra, conteniendo potencialmente dicha muestra dicho primer ácido nucleico, tampón de reacción, una mezcla de nucleótidos libres, un primer y un segundo cebador oligonucleotídico específico, y colocar dicho recipiente de reacción en un aparato automático de modo que;
(b) la primera cámara de reacción se calienta automáticamente a una temperatura suficiente y durante un tiempo suficiente para convertir cualquier primer ácido nucleico bicatenario en la muestra a ensayar en ácido nucleico monocatenario suficiente de modo que se puede formar un producto de hibridación, comprendiendo dicho producto de hibridación dicho primer ácido nucleico y al menos uno de dichos primer y segundo cebadores oligonucleotídicos;
(c) la primera cámara de reacción se enfría después automáticamente a una temperatura suficiente de modo que se forme dicho producto de hibridación, si dicho primer ácido nucleico está presente;
(d) la mezcla de reacción se transfiere después automáticamente de la primera cámara de reacción a dicha segunda cámara de reacción mediante dicha comunicación fluida controlable, de modo que la mezcla de reacción se pone en contacto con una enzima de polimerización de ácidos nucleicos;
(e) manteniéndose automáticamente la temperatura de la segunda cámara de reacción a una temperatura suficiente que permita la amplificación mediada por un cebador oligonucleotídico específico de dicho primer ácido nucleico, si está presente;
(f) cualquier producto de amplicón de dicho primer ácido nucleico en la segunda cámara de reacción se pone en contacto después automáticamente con un ácido nucleico de captura específico para dicho amplicón de dicho primer ácido nucleico, de modo que pueda formarse un complejo de hibridación de sonda de captura-ácido nucleico unido específicamente;
(g) opcionalmente, la mezcla del complejo de hibridación se lava automáticamente de modo que el ácido nucleico unido inespecíficamente se elimine por lavado del complejo sonda de captura-ácido nucleico unido específicamente;
(h) el complejo de sonda de captura-ácido nucleico unido específicamente se pone en contacto automáticamente con una sonda de ácido nucleico marcada específica para dicho amplicón producida a partir de dicho primer ácido nucleico de modo que pueda formarse un complejo de sonda marcada-sonda de captura-ácido nucleico unido específicamente;
(i) opcionalmente, el complejo sonda marcada-sonda de captura-ácido nucleico unido específicamente se lava automáticamente de modo que el ácido nucleico de sonda marcada unido inespecíficamente se elimine por lavado del complejo de sonda marcada-sonda de captura-ácido nucleico unido específicamente;
(j) la presencia o ausencia de dicha señal generada se detecta automáticamente y se presenta opcionalmente como un valor para la señal y, opcionalmente, se registra como un valor para la señal, el complejo de sonda marcada-sonda de captura-ácido nucleico unido específicamente se pone en contacto automáticamente con una solución de modo que se genera una señal detectable si dicho amplicón y primer ácido nucleico están presentes, siendo la señal generada a partir de la muestra proporcional a la cantidad de dicho primer ácido nucleico en la muestra; realizándose cada uno de (h), (i) y (j) secuencialmente o simultáneamente.
2. Un procedimiento de acuerdo con la reivindicación 1, en el que la enzima de amplificación de ácidos nucleicos se pone en dicha segunda cámara de reacción como una cantidad de dosis de ensayo individual en un sedimento liofilizado y dicha cámara de reacción se sella antes de su uso.
3. Un procedimiento de acuerdo con la reivindicación 1, en el que la enzima de amplificación de ácidos nucleicos es una enzima termoestable.
4. Un procedimiento de acuerdo con la reivindicación 3, en el que dicha enzima de amplificación de ácidos nucleicos termoestable se pone en la primera cámara de reacción.
5. Un procedimiento de acuerdo con la reivindicación 1, que incorpora además moléculas de control interno.
6. Un procedimiento de acuerdo con la reivindicación 1, que incluye además la amplificación y detección de una segunda secuencia de ácido nucleico.
7. Un procedimiento de acuerdo con la reivindicación 1, que incluye además la detección de secuencias de control de cebadores.
Patentes similares o relacionadas:
 DISPOSITIVO PARA LA CARGA DE TARJETAS DE REACTIVOS PARA ANALIZADORES CLINICOS, del 16 de Mayo de 2008, de GRIFOLS, S.A: Dispositivo para la carga de tarjetas de reactivos para analizadores clínicos.#El dispositivo comprende un soporte en forma de cubeta o similar abierto superiormente […]
DISPOSITIVO PARA LA CARGA DE TARJETAS DE REACTIVOS PARA ANALIZADORES CLINICOS, del 16 de Mayo de 2008, de GRIFOLS, S.A: Dispositivo para la carga de tarjetas de reactivos para analizadores clínicos.#El dispositivo comprende un soporte en forma de cubeta o similar abierto superiormente […]
PROCEDIMIENTO DE SÍNTESIS DE ÁCIDO NUCLEICO, del 7 de Diciembre de 2011, de EIKEN KAGAKU KABUSHIKI KAISHA: Un procedimiento para sintetizar ácido nucleico que está provisto en sus extremos 3' y 5' con una región que consta de una región nucleotídica […]
METODO PARA LA REPLICACIÓN, AMPLIFICACIÓN, O SECUENCIACIÓN DE UN ADN MOLDE, del 24 de Noviembre de 2011, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Método para la replicación, amplificación o secuenciación de un ADN molde.La presente invención se encuadra dentro del campo de la biotecnología. Específicamente, […]
 PROCEDIMIENTO PARA LA AMPLIFICACIÓN DE ÁCIDOS NUCLEICOS, del 20 de Mayo de 2011, de BRANDEIS UNIVERSITY: Procedimiento homogéneo de detección y amplificación mediante LATE-PCR no simétrica que reduce la dispersión entre ensayos repetidos que comprende: (i) realizar una reacción […]
PROCEDIMIENTO PARA LA AMPLIFICACIÓN DE ÁCIDOS NUCLEICOS, del 20 de Mayo de 2011, de BRANDEIS UNIVERSITY: Procedimiento homogéneo de detección y amplificación mediante LATE-PCR no simétrica que reduce la dispersión entre ensayos repetidos que comprende: (i) realizar una reacción […]
 COMPOSICIÓN PARA AMPLIFICAR ÁCIDOS NUCLEICOS, del 23 de Marzo de 2011, de BIORAD PASTEUR: Una composición líquida concentrada y tamponada para amplificar ácidos nucleicos, que comprende al menos un dNTP, al menos una enzima requerida para la amplificación, […]
COMPOSICIÓN PARA AMPLIFICAR ÁCIDOS NUCLEICOS, del 23 de Marzo de 2011, de BIORAD PASTEUR: Una composición líquida concentrada y tamponada para amplificar ácidos nucleicos, que comprende al menos un dNTP, al menos una enzima requerida para la amplificación, […]
 MOLDES MODIFICADOS MEDIANTE INGENIERIA GENETICA Y SU USO EN AMPLIFICACION DE CEBADOR UNICO, del 13 de Abril de 2010, de ALEXION PHARMACEUTICALS, INC.: Método para amplificar ácido nucleico, que comprende:
a) hibridar un cebador a un molde, presentando el cebador una primera porción que se hibrida al molde […]
MOLDES MODIFICADOS MEDIANTE INGENIERIA GENETICA Y SU USO EN AMPLIFICACION DE CEBADOR UNICO, del 13 de Abril de 2010, de ALEXION PHARMACEUTICALS, INC.: Método para amplificar ácido nucleico, que comprende:
a) hibridar un cebador a un molde, presentando el cebador una primera porción que se hibrida al molde […]
 PROCEDIMIENTO PARA LA AMPLIFICACION DE INFORMACION GENETICA POR MEDIO DE CEBADORES QUE SE UNEN EN VARIOS SITIOS EN EL GENOMA, del 26 de Febrero de 2010, de OLYMPUS LIFE SCIENCE RESEARCH EUROPA GMBH: Procedimiento para la determinación de la frecuencia relativa de unos conjuntos parciales delimitables de un material genético, siendo amplificado el material […]
PROCEDIMIENTO PARA LA AMPLIFICACION DE INFORMACION GENETICA POR MEDIO DE CEBADORES QUE SE UNEN EN VARIOS SITIOS EN EL GENOMA, del 26 de Febrero de 2010, de OLYMPUS LIFE SCIENCE RESEARCH EUROPA GMBH: Procedimiento para la determinación de la frecuencia relativa de unos conjuntos parciales delimitables de un material genético, siendo amplificado el material […]
SONDAS DE DOBLE HEBRA PARA LA DETECCION DE ACIDOS NUCLEICOS, MEDIANTE FLUORESCENCIA, del 5 de Noviembre de 2009, de BIO-RAD PASTEUR: Una sonda de doble hebra, pretendida para la detección de un ácido nucleico diana, de hebra individual, o de hebra doble, mediante fluorescencia, el cual […]