DISPOSITIVO DE FIBRA ÓPTICA PARA DETECTAR ANALITOS Y SU PROCEDIMIENTO DE FABRICACIÓN.
Un dispositivo biosensor para la detección de un analito diana en una muestra que comprende una pluralidad de agujas (21) que tienen un extremo proximal y un extremo distal y que están unidas a una única montura (24),
y al menos una aguja (21) que comprende un elemento de detección (6) unido a la superficie interna de la aguja (21); caracterizado porque dicho elemento de detección (6) comprende al menos una proteína de unión periplásmica marcada luminiscente adaptada para unirse con al menos un analito diana y adaptada para experimentar un cambio de luminiscencia tras la unión de la proteína de unión periplásmica al analito diana, y dicho elemento de detección (6) está atrapado en o unido a una matriz polimérica (14) en la que una fibra óptica (4) que tiene un extremo proximal y un extremo distal se aloja al menos parcialmente en el interior de la aguja (21) y la matriz polimérica (14) está unida covalentemente al extremo distal de la fibra óptica (4) mediante grupos reactivos en la matriz polimérica (14)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/037615.
Solicitante: BECTON, DICKINSON & COMPANY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1 BECTON DRIVE FRANKLIN LAKES, NJ 07417-1880 ESTADOS UNIDOS DE AMERICA.
Inventor/es: KEITH, STEVEN, JACOBSON,Ross,W, WEIDEMAIER,Kristin, ALARCON,Javier, HERDMAN,Christopher.
Fecha de Publicación: .
Fecha Solicitud PCT: 14 de Octubre de 2005.
Clasificación Internacional de Patentes:
- A61B5/1459 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61B DIAGNOSTICO; CIRUGIA; IDENTIFICACION (análisis de material biológico G01N, p.ej. G01N 33/48). › A61B 5/00 Medidas encaminadas a establecer un diagnóstico (diagnóstico por medio de radiaciones A61B 6/00; diagnóstico por ondas ultrasónicas, sónicas o infrasónicas A61B 8/00 ); Identificación de individuos. › invasivos, p. ej. introducidos en el cuerpo por medio de un catéter.
- A61B5/145G
- G01N33/543K2
Clasificación PCT:
- A61B5/00 A61B […] › Medidas encaminadas a establecer un diagnóstico (diagnóstico por medio de radiaciones A61B 6/00; diagnóstico por ondas ultrasónicas, sónicas o infrasónicas A61B 8/00 ); Identificación de individuos.
- A61M31/00 A61 […] › A61M DISPOSITIVOS PARA INTRODUCIR AGENTES EN EL CUERPO O PARA DEPOSITARLOS SOBRE EL MISMO (introducción de remedios en o sobre el cuerpo de animales A61D 7/00; medios para la inserción de tampones A61F 13/26; dispositivos para la administración vía oral de alimentos o medicinas A61J; recipientes para la recogida, almacenamiento o administración de sangre o de fluidos médicos A61J 1/05 ); DISPOSITIVOS PARA HACER CIRCULAR LOS AGENTES POR EL CUERPO O PARA SU EXTRACCION (cirugía A61B; aspectos químicos de los artículos quirúrgicos A61L; magnetoterapia utilizando elementos magnéticos colocados dentro del cuerpo A61N 2/10 ); DISPOSITIVOS PARA INDUCIR UN ESTADO DE SUEÑO O LETARGIA O PARA PONERLE FIN. › Dispositivos para la introducción o la retención de agentes, p. ej. remedios, en las cavidades del cuerpo (A61M 25/00 tiene prioridad).
- G01N33/542 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con inhibición estérica o modificación de la señal, p. ej. extinción de fluorescencia.
- G01N33/543 G01N 33/00 […] › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
- G01N33/566 G01N 33/00 […] › utilizando un soporte específico o proteínas receptoras como reactivos para la formación de uniones por ligando.
- G01N33/66 G01N 33/00 […] › en los que intervienen azúcares de la sangre, p. ej. la galactosa.
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2358744_T3.pdf
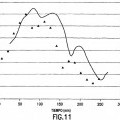
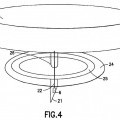
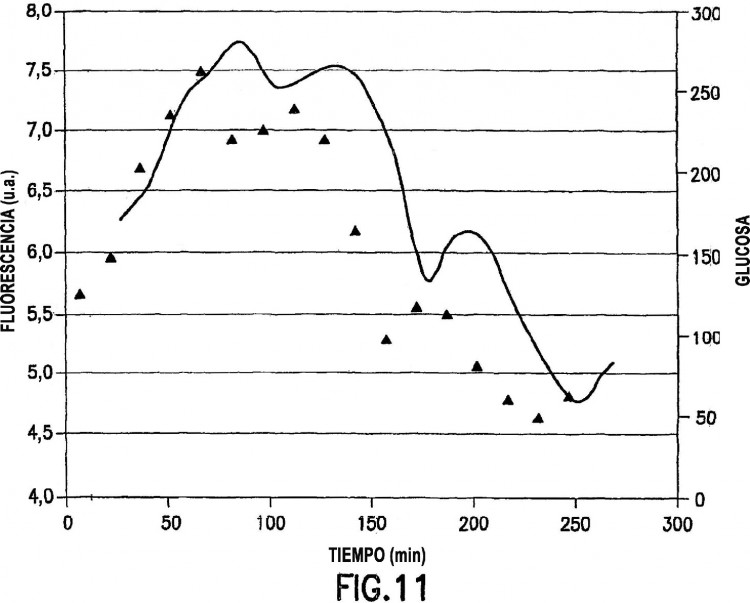
Fragmento de la descripción:
Campo de la invención
La presente invención se refiere a un dispositivo que se puede usar para vigilar las concentraciones de compuestos fisiológicamente relevantes
Antecedentes de la invención
El control de concentraciones in vivo de compuestos fisiológicamente relevantes para mejorar el diagnóstico y el tratamiento de diversas enfermedades y trastornos es una meta deseable y podría mejorar la vida de muchas personas. Los avances en este campo se muestran particularmente prometedores en el área de facilitar un control metabólico adecuado en diabéticos. Actualmente, la mayor parte de los diabéticos usa el procedimiento de la “tira reactiva en dedo” para vigilar el nivel de glucosa en sangre, y el seguimiento de este procedimiento por el paciente es problemático debido al dolor producido por los frecuentes pinchazos en el dedo. Como consecuencia, se han hecho esfuerzos para desarrollar procedimientos no invasivos o mínimamente invasivos in vivo y más eficaces in vitro para vigilar de manera frecuente y/o continua la glucosa en sangre u otros fluidos biológicos.
Las soluciones para el control in vivo de manera frecuente y/o continua tienden a clasificarse en dos categorías generales: “no invasiva” y “mínimamente invasiva”. El control no invasivo determina los niveles de analito rastreando directamente cambios espectroscópicos en la piel y el tejido. La espectroscopía de radiación infrarroja y de impedancia de ondas de radio son ejemplos de esta tecnología. El progreso con estas soluciones ha sido lento debido a la necesidad de una calibración frecuente, iluminación reproducible de la muestra, y varianzas en los fondos espectroscópicos entre individuos. La solución “mínimamente invasiva” evita la extracción directa de sangre del cuerpo y se basa en la vigilancia de cambios de señal en los fluidos biológicos usando un elemento detector intermedio Los biosensores de este tipo son dispositivos capaces de proporcionar información analítica cuantitativa o semicuantitativa específica usando un elemento de reconocimiento biológico que se combina con un elemento de transducción (de detección).
La mayor parte de sistemas convencionales para el control frecuente o continuo del analito implican biosensores amperométricos que emplean enzimas tales como glucosa oxidasa (GOx) para oxidar glucosa a ácido glucurónico y peróxido de hidrógeno, generando una señal electroquímica. Estos sensores están sometidos a una medida imprecisa debido a la deficiencia de oxígeno y a la aparición de subproductos de oxidación. Una medida precisa de las concentraciones de glucosa requiere un exceso de oxígeno, que generalmente no está presente en la sangre o el fluido intersticial humano. También, la propia reacción electroquímica genera la aparición de subproductos de oxidación que pueden inhibir o degradar la enzima y su capa protectora.
Se han desarrollado también biosensores basados en señales ópticas en lugar de electromecánicas, y pueden ofrecer mejoras significativas en la estabilidad y en la calibración. Por ejemplo referenciar una señal óptica dependiente del analito a una segunda señal independiente del analito puede corregir las fuentes de ruido e inestabilidad en el sensor. Sin embargo, no se ha explotado todavía el potencial de detección óptica para la detección in vivo del analito. Una razón para esto es que muchos procedimientos de detección óptica actuales se basan en la química enzimática tales como la glucosa oxidasa. En un procedimiento común, se usa un colorante fluorescente sensible a oxígeno para vigilar el consumo de oxígeno por la reacción enzimática de la GOx. Aunque se trata de un biosensor óptico, en el que el nivel de la señal de fluorescencia varía con el cambio de los niveles de oxígeno, dicho sensor está sometido a los mismos problemas que los dispositivos amperométricos basados en esta misma química: deficiencia de oxígeno y degradación enzimática.
Para superar los desafíos asociados con la detección de la enzima (por ejemplo, la GOx), ya sea electroquímica como óptica, se está explorando la detección óptica o fluorescente basada en proteínas no enzimáticas. Se han usado concanavalina A y dextrano marcados para crear un ensayo competitivo FRET; sin embargo, este sistema requiere atrapar ambos componentes, y el intervalo dinámico del ensayo está limitado. Véase Ballerstadt, R., Schultz, J.S.; "Competitive-binding assay method based on fluorescence quenching of ligands held in close proximity by a multivalent receptor." Anal. Chem. Acta 345 (1-3): 203-212 (1997). Véase también, Russell, R.J., Pishko M.V., Gefrides C.C., McShane, M. J., Cote, G.L.; "A fluorescence-based glucose biosensor using concanavalin A and dextran encapsulated in a poly(ethylene glycol) hydrogel" Anal. Chem. 71 (15): 3126-3132 (1999).
Otra química de detección basada en proteínas usa el receptor periplásmico de Escherichia coli (E. coli), la proteína de unión a glucosa-galactosa (GGBP) para generar una señal de fluorescencia en respuesta a la unión a la glucosa. Véanse, por ejemplo, Tolosa, L., I. Gryczynski, L. R. Eichhorn, J. D. Dattelbaum, F. N. Castellano, G. Rao, y J. R. Lakowicz; "Glucose sensor for low-cost lifetime-based sensing using a genetically engineered protein" Anal. Biochem.
267: 114-120 (1999); Hellinga, H. W., and J. S. Marvin; "Protein engineering and the development of generic biosensors." Trends Biotechnol. 16: 183-189 (1998); Salins, L. L., R A. Ware, C. M. Ensor, y S. Daunert, "A novel reagentless sensing system for measuring glucose based on the galactose/glucose-binding protein" Anal Biochem 294: 19-26 (2001); y de Lorimier, R. M., J. J. Smith, M. A. Dwyer, L. L. Looger, K. M. Sali, C. D. Paavola, S. S. Rizk, S. Sadigov, D. W. Conrad, L. Loew, y H. W. Hellinga. "Construction of a fluorescent biosensor family" Protein Sci. 11: 2655-2675 (2002). La GGBP experimenta un cambio de conformación sustancial tras la unión al ligando, atrapando el ligando entre sus dos dominios globulares. Véase, por ejemplo, Shilton, B. H., M. M. Flocco, M. Nilsson, y S. L. Mowbray; "Conformational changes of three periplasmic preceptors for bacterial chemotaxis and transport: the maltose-, glucose/galactose-and ribosebinding proteins" J. Mol. Biol. 264: 350-363 (1996). Si se marca de manera sitioespecífica la proteína con un fluoróforo ambientalmente sensible, se puede aprovechar este atributo para generar una señal fluorescente. Véase, por ejemplo, Salins, L. L., R. A. Ware, C. M. Ensor, y S. Daunert; "A novel reagentless sensing system for measuring glucose based on the galactose/glucose binding protein" Anal Biochem 294: 19-26 (2001). Debido a que la GGBP ni consume glucosa ni genera productos de reacción, se puede usar como sensor sin reactivo. Esto puede proporcionar mayor precisión y fiabilidad que los biosensores amperométricos.
En el documento WO 00/74763 A2 se da a conocer un dispositivo biosensor que se corresponde con la primera parte de la reivindicación 1. Este dispositivo se proporciona para la administración de fármacos a través de un tejido biológico y para el muestreo controlado de fluidos biológicos de manera mínimamente invasiva, indolora y conveniente. El dispositivo incluye una porción superior o sustrato del cual sobresale una pluralidad de microagujas. El dispositivo de microagujas incluye un sensor o biosensor químico integrado. El sistema de detección del analito puede incluir enzimas que reaccionan con el analito de interés y transductores tanto mecánicos como ópticos que miden el contenido de la reacción.
El documento US 2003/0134346 A1 da a conocer una composición de proteínas de unión mutadas que contienen grupos indicadores para usar en dispositivos biosensores de analitos. Un biosensor de glucosa comprende al menos una proteína de unión mutada y al menos un grupo indicador unido a la anterior para proporcionar un cambio de señal detectable y reversible cuando dicha proteína de unión mutada se expone a concentraciones variantes de glucosa.
El artículo de GE Xudong y col ["DUAL-LABELED GLUCOSE BINDING PROTEIN FOR RATIOMETRIC MEASUREMENTS OF GLUCOSE" ANALYTICAL CHEMISTRY, AMERICAN CHEMICAL SOCIETY. COLUMBUS, EE.UU, vol. 76, nº. 5, 1 de marzo 2004 (2004-03-01), páginas 1403-1410, XP001196709 ISSN: 003-2700] describe un dispositivo de control de glucosa muy sensible que comprende una proteína de unión a glucosa.
El documento US 2003/0153026 A1 de la empresa solicitante da a conocer un biosensor... [Seguir leyendo]
Reivindicaciones:
1. Un dispositivo biosensor para la detección de un analito diana en una muestra que comprende una pluralidad de agujas (21) que tienen un extremo proximal y un extremo distal y que están unidas a una única montura (24), y al menos una aguja (21) que comprende un elemento de detección (6) unido a la superficie interna de la aguja (21);
caracterizado porque
dicho elemento de detección (6) comprende al menos una proteína de unión periplásmica marcada luminiscente adaptada para unirse con al menos un analito diana y adaptada para experimentar un cambio de luminiscencia tras la unión de la proteína de unión periplásmica al analito diana, y dicho elemento de detección (6) está atrapado en o unido a una matriz polimérica (14) en la que una fibra óptica (4) que tiene un extremo proximal y un extremo distal se aloja al menos parcialmente en el interior de la aguja (21) y la matriz polimérica (14) está unida covalentemente al extremo distal de la fibra óptica (4) mediante grupos reactivos en la matriz polimérica (14).
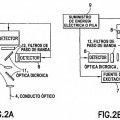
2. El dispositivo de la reivindicación 1, que comprende además un miembro de acoplamiento óptico para unir la fibra óptica (4) a un sistema óptico (2) y que está configurada y dimensionada para recibir un componente óptico que se puede unir a la anterior.
3. El dispositivo de la reivindicación 1, que comprende además al menos un grupo de referencia asociado con la proteína de unión periplásmica, en el que el grupo de referencia produce una señal luminiscente que no cambia sustancialmente tras la unión del analito diana con la proteína de unión periplásmica y se usa para la referenciación y la calibración interna.
4. El dispositivo de la reivindicación 1, en el que la aguja (21) que contiene dicho elemento de detección (6) está adaptado además para insertarse en o a través de la piel de un paciente.
5. El dispositivo de la reivindicación 1, en el que la aguja (21) y el elemento de detección (6) son estériles.
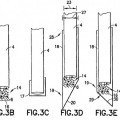
6. El dispositivo de la reivindicación 1, en el que la matriz polimérica (14) se extiende desde el extremo distal de la fibra óptica (4) una distancia de entre 5 µm a aproximadamente 1000 µm.
7. El dispositivo de la reivindicación 1, en el que la matriz polimérica (14) incluye una superficie proximal unida a la fibra óptica (4) y una superficie distal separada de la superficie proximal, en el que la superficie distal comprende una superficie reflectora o de dispersión (16).
8. El dispositivo de la reivindicación 7, en el que la matriz polimérica (14) incluye partículas de dispersión de luz.
9. El dispositivo de la reivindicación 8, en el que la fibra óptica (4) y el elemento de detección se alojan en el interior de la aguja (21).
10. El dispositivo de la reivindicación 8, en el que la aguja se extiende desde un extremo proximal hasta un extremo distal y el elemento de detección se sitúa adyacente al extremo distal de la aguja.
11. El dispositivo de la reivindicación 10, en el que el extremo distal incluye una punta biselada.
12. El dispositivo de una de las reivindicaciones 1-11, en el que la aguja (21) tiene uno o más puertos.
13. El dispositivo de la reivindicación 12, en el que dicho uno o más puertos se sitúan entre el extremo proximal y el extremo distal.
14. El dispositivo de la reivindicación 12 o 13, en el que uno o más puertos permiten el acceso del analito al elemento de detección.
15. El dispositivo de la reivindicación 12 o 13, en el que el uno o más puertos permiten la administración de un agente terapéutico a su través.
16. El dispositivo de una de las reivindicaciones 1-15, que comprende además un elemento de detección de la temperatura para la detección de la temperatura de la muestra.
17. El dispositivo de la reivindicación 9, en el que el extremo distal de la aguja (21) incluye una porción de la punta flexada (29) que se extiende distalmente más allá y adyacente al elemento de detección (6).
18. El dispositivo de la reivindicación 17, en el que la porción de la punta flexada (29) incluye una superficie reflectante de la luz (30) enfrentada a la fibra óptica (4).
19. El dispositivo de una de las reivindicaciones 1-18, que se puede insertar en el cuerpo de un paciente para la detección de un analito diana en una muestra.
20. El dispositivo de una de las reivindicaciones 1-19, en el que al menos una porción del extremo proximal de la al menos una aguja (21) está configurada para permanecer en el exterior del cuerpo del paciente cuando se lleva puesto el dispositivo, y en el que al menos una porción del extremo distal de la aguja (21) está configurada para permanecer en el interior del cuerpo del paciente cuando se lleva puesto el dispositivo.
21. El dispositivo de la reivindicación 20, que comprende además un dispositivo limitante de la profundidad unido a al menos una aguja (21), en el que el dispositivo limitante de la profundidad limita la profundidad a la que se puede insertar el extremo distal del cuerpo de la punta en el cuerpo del paciente.
22. El dispositivo de la reivindicación 20, en el que el extremo proximal de al menos una aguja (21) está unido a un parche (24) y el parche está configurado y dimensionado para llevarse puesto en la parte externa de la piel del paciente.
23. El dispositivo de la reivindicación 20, en el que el extremo proximal de la al menos una aguja (21) está unido a un reloj y el reloj está configurado y dimensionado para llevarse puesto en la zona externa de la muñeca del paciente.
24. El dispositivo de una de las reivindicaciones 1-23, en el que el elemento de detección (6) está configurado para transmitir una señal óptica en respuesta a la detección de glucosa.
25. El dispositivo de una de las reivindicaciones 1-24 en el que los grupos reactivos en la matriz polimérica (14) se unen covalentemente a la fibra óptica (4) mediante grupos amina en el extremo distal de la fibra óptica (4).
26. Un procedimiento de fabricación de un dispositivo biosensor para la detección de un analito diana en una muestra que comprende:
proporcionar una aguja (21) que tiene un extremo proximal (28) y un extremo distal (19) que incluye una punta biselada (29);
insertar un extremo distal de una fibra óptica (4) en la cánula de la aguja;
proporcionar una matriz polimérica (14) que atrapa un elemento de detección (6) o a la cual se une un elemento de detección, y cuya matriz polimérica (14) se une covalentemente al extremo distal de la fibra óptica, en el que el elemento de detección (6) comprende al menos una proteína de unión periplásmica marcada luminiscente adaptada para experimentar un cambio de luminiscencia tras la unión de la proteína de unión del analito diana.
27. El procedimiento de la reivindicación 26, que comprende además inmovilizar el elemento de detección (6) en la matriz polimérica (14).
28. El procedimiento de la reivindicación 26, que comprende además unir la matriz (14) a la cánula de la aguja adyacente al extremo distal de la aguja.
29. El procedimiento de la reivindicación 26, en el que los grupos reactivos de la matriz polimérica (14) se unen covalentemente a la fibra óptica (4) mediante grupos amina en el extremo distal de la fibra óptica (4).
Patentes similares o relacionadas:
Sistemas para visualizar el tejido ablacionado, del 21 de Octubre de 2019, de The George Washington University: Un sistema para la captación de imágenes de tejido que comprende: un catéter con un extremo distal y un extremo proximal ; un elemento […]
Dispositivo de medición para medir parámetros cerebrales, del 29 de Mayo de 2019, de Luciole Medical AG: Dispositivo de medición para medir parámetros de un tejido corporal con una sonda alargada para la introducción en el tejido corporal, que comprende: […]
Elemento sensor implantable, del 24 de Abril de 2019, de EYESENSE AG: Elemento sensor para detectar al menos un analito en un líquido corporal o en un tejido corporal , en particular para determinar al menos una concentración […]
Sensor ocular para la detección de un analito en un líquido ocular, del 17 de Diciembre de 2018, de EYESENSE AG: Sensor ocular para la detección de al menos un analito en un líquido ocular, presentando el sensor ocular al menos un material de sensor, estando configurado […]
Aparato de medición de información sanguínea, del 13 de Septiembre de 2017, de FUJIFILM CORPORATION: Un aparato de medición de información sanguínea , que comprende: una sección de iluminación para aplicar luz de iluminación a una […]
Aparato y método para medir el flujo sanguíneo dentro del tracto gastrointestinal, del 5 de Julio de 2017, de APD Advanced Perfusion Diagnostics: Un sistema de medición del flujo sanguíneo, que comprende: un catéter configurado para su colocación dentro del tracto gastrointestinal de un paciente, […]
Estructuras sensoras electroquímicas y luminiscentes integradas en substrato común, del 5 de Julio de 2017, de Joanneum Research Forschungsgesellschaft mbH: Un mecanismo sensor para detectar información indicativa de una sustancia fisiológica en un material corporal de un sujeto fisiológico , comprendiendo […]
 Sistemas de espectroscopía de fluorescencia inducida por láser de resolución en el tiempo y sus usos, del 20 de Enero de 2016, de CEDARS-SINAI MEDICAL CENTER: Un sistema para caracterizar una muestra biológica analizando la emisión de luz fluorescente de la muestra biológica tras la excitación, que comprende:
(i) […]
Sistemas de espectroscopía de fluorescencia inducida por láser de resolución en el tiempo y sus usos, del 20 de Enero de 2016, de CEDARS-SINAI MEDICAL CENTER: Un sistema para caracterizar una muestra biológica analizando la emisión de luz fluorescente de la muestra biológica tras la excitación, que comprende:
(i) […]