DETECCIÓN DE LA ACTIVIDAD DEL FACTOR DE VON-WILLEBRAND (VWF).
Un método para detectar la enfermedad de von-Willebrand (vWD) que comprende las etapas de:
a) detectar la actividad del Factor de von Willebrand (vWF) en una muestra que comprende una forma soluble o parte de la glicoproteína Ib (α) (GPIb (α)) y ristocetina o un fragmento del mismo o botrocetina capaz de inducir la unión de vWF a GpIb (α), b) determinar la cantidad de vWF-antígeno en dicha muestra, c) determinar la proporción entre la actividad de vWF y el antígeno de vWF para dicha muestra, d) comparar la baja proporción obtenida (c) respecto al intervalo de proporciones establecidas como el intervalo normal
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2000/006345.
Solicitante: K.U. LEUVEN RESEARCH & DEVELOPMENT.
Nacionalidad solicitante: Bélgica.
Dirección: GROOT BEGIJNHOF, BENEDENSTRAAT 59 3000 LEUVEN BELGICA.
Inventor/es: DECKMYN,HANS, CAUWENBERGHS,NANCY, VANHOORELBEKE,KAREN.
Fecha de Publicación: .
Fecha Solicitud PCT: 5 de Julio de 2000.
Clasificación Internacional de Patentes:
- G01N33/86 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que interviene el tiempo de coagulación de la sangre.
Clasificación PCT:
- G01N33/86 G01N 33/00 […] › en los que interviene el tiempo de coagulación de la sangre.
Clasificación antigua:
- G01N33/48 G01N 33/00 […] › Material biológico, p. ej. sangre, orina (G01N 33/02, G01N 33/26, G01N 33/44, G01N 33/46 tienen prioridad ); Hemocitómetros (cómputo de glóbulos repartidos sobre una superficie por barrido óptico de la superficie G06M 11/02).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
PDF original: ES-2358576_T3.pdf
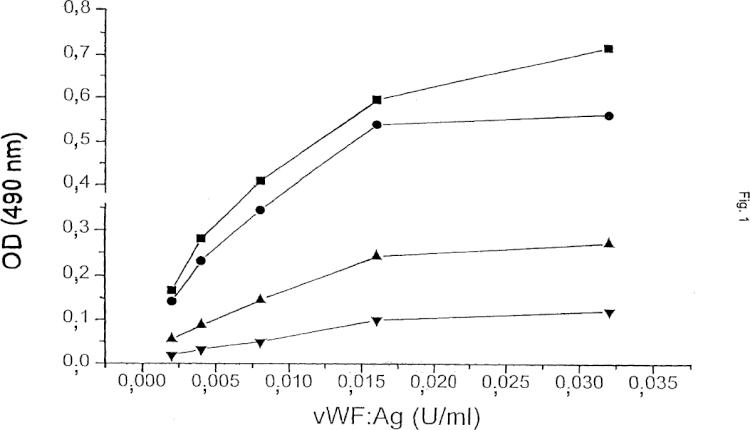
Fragmento de la descripción:
Se describe un método para detectar la actividad del factor de von-Willebrand (vWF) que comprende analizar una muestra en presencia de una forma soluble o una parte de la glicoproteína Ib (α) (GPIb (α)) y ristocetina, o una sustancia funcionalmente equivalente. Además, la invención se refiere al uso de la forma soluble anteriormente mencionada o parte de la glicoproteína Ib (α), de la ristocetina o una sustancia equivalente funcional, de anticuerpo(s) anti-GPIB (α) que reacciona(n) específicamente y/o parejas de unión específicas, como anticuerpo(s) anti-vWF (α) que reacciona(n) específicamente para llevar a cabo el método de la invención. Además, la presente invención se refiere a kits para llevar a cabo el método de la invención.
Varios documentos son citados por todo el texto de esta memoria descriptiva. Cada uno de los documentos citados en este documento (incluyendo cualesquiera memorias descriptivas de fabricantes, instrucciones, etc.) es, por medio de ésta, incorporado como referencia; sin embargo, no se admite que cualquier documento citado sea en efecto la técnica anterior de la presente invención.
El factor de Von Willebrand (vWF) es una glicoproteína grande multimérica que está presente en el plasma, subendotelio y α-gránulos de plaquetas. El vWF tiene dos funciones distintas en la hemostasia primaria: promueve la adhesión de plaquetas en sitios con daños vasculares y protege de que el factor de coagulación VIII (FVIII) sea inactivado por la proteína C activada (para una revisión, véase: Sadler, Annu Rev Biochem 1998; 67: 395-424).
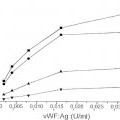
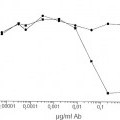
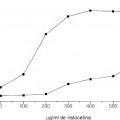
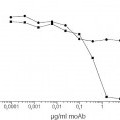
La enfermedad de Von Willebrand (vWD) genera anormalidades cuantitativas y cualitativas en el vWF. Es el desorden de sangrado heredado más común con un predominio del 0,1 %-1 % (Rodeghiero, Blood 1987; 69: 454-9). Se distinguen tres categorías principales del vWD (Sadler, Thromb Haemost 1994; 71: 520-5). Los tipos 1 y 3 se refieren a una deficiencia cuantitativa media y severa del vWF, respectivamente, mientras que el tipo 2 se refiere a anormalidades cualitativas. El tipo cualitativo 2 del vWD está dividido además en cuatro subtipos (A, B, M y N). En los individuos del tipo 2A, hay una ausencia de multímeros de peso molecular alto (HMW). Las variantes del tipo 2B muestran una mayor afinidad para la glicoproteína (GP) Ib en plaquetas que causan una pérdida de multímeros de HMW en el plasma. El VWD tipo 2M incluye variantes en las cuales la adhesión de plaquetas está dificultada pero la distribución del multímero vWF es normal. Las variantes del tipo 2N muestran una afinidad marcadamente menor para el factor VIII (FVIII). Como se dice, entre otras cosas, en Veyradier, Int. J. Clin. Lab. Res. 28 (1998), 201-210, una menor proporción de la actividad del cofactor de ristocetina del factor de von Willebrand / antígeno del factor de von Willebrand está a favor de los tres subtipos (2A, 2M, y 2B) definidos por una interacción normal entre el factor de von Willebrand y la glicoproteína Ib de plaquetas, mientras que una menor proporción del factor VIII / antígeno del factor de von Willebrand sugiere el subtipo 2N, definido por una unión defectuosa del factor de von Willebrand al factor VIII. En la mayor parte de los laboratorios, las pruebas de rastreo básicas usadas a fin de evaluar a un nuevo paciente que se sospecha que padece vWD son: el Tiempo de Sangrado (TS), nivel de antígeno de vWF (vWF:Ag) y aglutinación de plaquetas inducida por ristocetina de vWF, denominada actividad del cofactor de ristocetina (vWF:RiCof). Otros estudios, tales como la determinación de vWF:RiCoF a varias concentraciones de ristocetina, la aglutinación de plaquetas inducida por ristocetina con plasma y plaquetas del paciente, análisis de gel del multímero y análisis de ADN permiten una clasificación más del vWD requerido para una terapia directa y apropiada (Ewenstein, Annu Rev Med 1997; 48: 525-42; Veyradier, loc. cit.). Dichos ensayos, sin embargo, pueden ser realizados sólo en laboratorios muy especializados. También se mostró que la determinación de la actividad de unión del colágeno de vWF (vWF:CBA) era un instrumento valioso en la diagnosis de pacientes con vWD (Brown, Thromb Res 1986; 43: 30311, Favaloro, Blood Coagul Fibrinolysis 1991; 2: 285-91).
Debido a las limitaciones de cada ensayo y debido a una amplia diversidad de variedades intraindividuales, ninguna prueba simple es lo suficientemente eficaz para permitir la detección de todas las variantes de vWD. La medida del vWF:Ag es la que con más frecuencia se realiza como ensayo ELISA (Ingerslev, Scand J Clin LabInvest 1987; 47: 143-9). Este ensayo proporciona buena información sobre el nivel absoluto del vWF presente pero no da ninguna información sobre la calidad del vWF que puede ser obtenida. Por lo tanto, el ensayo de vWF:Ag ayudará a detectar todos los pacientes con vWD tipo 3, la mayor parte del tipo 1 y sólo alguno del tipo 2, ya que muchos pacientes con vWD del tipo 2 proporcionará resultados de vWF:Ag que están dentro del intervalo de referencia normal.
Los dos ensayos de vWF no detectan la concentración de vWF (vWF:Ag) sólo, pero se correlacionan con sus propiedades funcionales: el ensayo del cofactor de vWF:ristocetina y el ensayo de unión de vWF:colágeno. Ya que los rasgos cualitativos / las propiedades funcionales del vWF son medidos con estos ensayos la terminología "actividad de vWF" se usa para determinar el vWF por estos procedimientos. En lo siguiente, la expresión "actividad de vWF" se usa para describir la interacción dependiente de ristocetina entre su GPIb (α) (o un fragmento) y vWF. La ristocetina es un antibiótico que promueve la interacción entre el complejo GP Ib/V/IX de plaqueta y vWF (Howard, Thromb Diath Haemorrh 1971; 26: 362-9; Hoylaerts, Biochem J 1995; 306: 453-63). Esta actividad del co-factor de ristocetina es observada principalmente en presencia de formas de HMW de vWF (Fischer, Thromb Res 1996; 84:55-66; Federici, Br J Haematol 1989; 73:93-9). La región de GPIb implicada en esta interacción ha sido identificada respecto a la parte globular de 42 kDa del amino terminal de GPlba (Vincente, J. Biol Chem 1988, 263:18473-18479). La actividad de vWF:RiCoF se determina usando un procedimiento de aglutinación de plaquetas (Macfarlane, Thromb Diath Haemorrh 1975; 34:306-8). Las diluciones de plasma pobre en plaquetas del paciente son mezcladas con las plaquetas fijadas de para-formaldehido lavado en presencia de una concentración fija de ristocetina y se mide la capacidad del plasma de paciente de inducir la aglutinación de plaqueta. El ensayo de vWF:RiCof permite la identificación de pacientes tipo 2A y 2B cuando son medidos bajos niveles de vWF:RiCof con relación a vWF:Ag. Este ensayo, sin embargo, tiene una variabilidad alta tanto de interensayo como interlaboratorio debido a la complejidad del procedimiento, p. ej., el uso de plaquetas de donante, las diferentes etapas de ensayo y a veces la difícil interpretación de la aglutinación de plaquetas (Favaloro, Pathology 1997; 29:385-91). Se sabe que la alta variabilidad en el ensayo de vWF:RiCof puede llevar a un diagnóstico erróneo de vWD. Además, la alta variabilidad del ensayo de vWF:RiCof puede ser debida al sistema bastante complejo usado, es decir al empleo de plaquetas enteras. Los ensayos de vWF basados en plaquetas están comprometidos por el hecho de que las plaquetas tienen más de un sitio de unión para vWF (Ruggeri, J. Clin. Invest. 1983; 72: 1-12) que comprenden, entre otras cosas, el complejo GPIIb/IIIa (De Marco, J. Clin. Invest. 1986; 77: 1272-1277). Además, se sabe que vWF se une a otras moléculas (macro)biológicas como proteínas y lípidos modificados, que comprenden no sólo el Factor VIII y colágenos (fibrilares), sino también heparinas, glicosaminoglicanos y sulfatidas (véase, por ejemplo, Mohlke, J. Lab Clin Med 1997 130: 253-261). Se sabe además que la unión de vWF al subendotelio induce un cambio estructural que permite la interacción primaria con GPIb, generando la última una señal para la activación de plaquetas sobre la cual se une el vWF (mediado por el dominio de RGD a GPIIb/IIIa) a un complejo en dicha plaqueta activada. Como GPIb, el complejo GPIIb/IIIa es un componente integral de la membrana de las plaquetas que se piensa que es esencial para la adhesión normal y la agregación (véase, por ejemplo, Berliner, J Biol Chem 1988, 263:75007505). Como Lechner ("Blutgerinnungsstorungen", Springer Verlag Berlín-Heidelberg-Nueva-York, 1982, p.197-200) describe, la preparación de plaquetas que se usan en ensayos vWF: RiCoF llevan a una activación de dichas plaquetas. Por lo tanto, todas las plaquetas, como se usan comúnmente en ensayos de vWF:RiCoF, comprenden más... [Seguir leyendo]
Reivindicaciones:
1. Un método para detectar la enfermedad de von-Willebrand (vWD) que comprende las etapas de:
a) detectar la actividad del Factor de von Willebrand (vWF) en una muestra que comprende una forma soluble o parte de la glicoproteína Ib (α) (GPIb (α)) y ristocetina o un fragmento del mismo o botrocetina capaz de inducir la unión de vWF a GpIb (α),
b) determinar la cantidad de vWF-antígeno en dicha muestra,
c) determinar la proporción entre la actividad de vWF y el antígeno de vWF para dicha muestra,
d) comparar la baja proporción obtenida (c) respecto al intervalo de proporciones establecidas como el intervalo normal.
2. El método de la reivindicación 1, en el que la detección de la enfermedad de von-Willebrand comprende discriminar entre tipos diferentes de la enfermedad de von-Willebrand.
3. El método de la reivindicación 2, en el que la detección de la enfermedad de von-Willebrand comprende discriminar entre la enfermedad de von-Willebrand del tipo 1 y del tipo 2.
4. El método de cualquiera de las reivindicaciones 1 a 3, en el que dicha detección de la actividad del factor de von-Willebrand (vWF) es realizada detectando la formación de un complejo de vWF y GPIb (α) y/o un complejo formado por vWF y GPIb (α).
5. El método de cualquiera de las reivindicaciones 1 a 4, en el que dicho GPIb (α) se une a un soporte sólido.
6. El método de la reivindicación 5, en el que dicho GPIb (α) se une a dicho soporte sólido por una reacción específica del anticuerpo anti-GPIb (α).
7. El método de la reivindicación 4, en el que dicho complejo se une a un soporte sólido.
8. El método de la reivindicación 7, en el que dicho complejo se une a dicho soporte por una reacción específica del anticuerpo anti-GPIb (α), por una reacción específica del anticuerpo anti-vWF, por un reacción específica del anticuerpo del antifactor VIII y/o por el colágeno.
9. El método de cualquiera de las reivindicaciones 1 a 8, en el que dicha detección se realiza por una reacción específica del anticuerpo anti-vWF, por una reacción específica del anticuerpo anti Factor VIII, por una reacción específica del anticuerpo anti-GPIb (α), por colágeno y/o sus mezclas.
10. El método de cualquiera de las reivindicaciones 6, 8 y 9, en el que dicho anticuerpo es un anticuerpo monoclónico, un anticuerpo policlónico o un anticuerpo quimérico.
11. El método de la reivindicación 9 o 10, en el que dicho anticuerpo o dicho colágeno se marca de forma detectable.
12. El método de cualquiera de las reivindicaciones 5 a 7, en el que dicho soporte sólido es un soporte de plástico, un vidrio, un silicio, un metal coloidal, una celulosa o un soporte polimérico.
13. El método de cualquiera de las reivindicaciones 5 a 7, en el que dicho soporte sólido se selecciona del grupo que consiste en polímeros orgánicos sólidos, partículas metálicas coloidales de celulosa/ membranas de celulosa, superficies plásticas, y cualquier combinación de estos.
14. El método de la reivindicación 13, en el que dicha partícula metálica coloidal es una partícula de oro.
15. El método de la reivindicación 13, en el que dicha superficie de plástico es el pocillo de una placa de microtítulo.
16. El método de la reivindicación 13, en el que dicho polímero orgánico sólido es una cuenta de látex.
17. El método de cualquiera de las reivindicaciones 1 a 16, en el que dicha detección se realiza por un ensayo heterogéneo o uno homogéneo.
18. El método de la reivindicación 17, en el que dicho ensayo heterogéneo es un ensayo inmune-absorbente de unión enzimática (ELISA), un radioinmunoensayo (RIA), un inmunoensayo radiométrico (IRMA), un inmunoensayo fluorescente (FIA), un inmunoensayo quimioluminiscente (CLIA) o un inmunoensayo electro-quimioluminiscente (ECL).
19. El método de la reivindicación 17, en el que dicho ensayo homogéneo es un ensayo de aglutinación.
20. El método de la reivindicación 19, en el que dicho ensayo de aglutinación está basado en la aglutinación de cuentas de látex.
21. El método de la reivindicación 19, en el que dicha aglutinación es medida por variación de la carga eléctrica, variación del campo magnético, variación turbidimétrica o dispersión de la luz.
22. El método de cualquiera de las reivindicaciones 1 a 21, en el que dicha muestra es una muestra de sangre.
23. El método de cualquiera de las reivindicaciones 1 a 21, en el que dicha muestra es una muestra de suero.
24. El método de la reivindicación 22, en el que dicha muestra de sangre es una muestra de plasma.
25. El método de cualquiera de las reivindicaciones 22 a 24, en el que dicha muestra está diluida.
26. El uso de una forma soluble o una parte de la glicoproteína Ib (α) (GPIb (α)) en el método de cualquiera de las reivindicaciones 1 a 25.
27. El uso de ristocetina, botrocetina in vitro en el método de cualquiera de las reivindicaciones 1 a 25.
28. El uso de un anticuerpo de anti-GPIb (α) que reacciona específicamente en el método de cualquiera de las reivindicaciones 6 a 25.
29. El uso de un anticuerpo de anti-vWF que reacciona específicamente en el método de cualquiera de las reivindicaciones 8 a 25.
30. El uso de un kit in vitro que comprende:
(a) una forma soluble o parte de glicoproteína Ib (α) (GPIb (α)) y
(b) ristocetina in vitro, botrocetina capaz de inducir la unión de vWF a GpIb (α), para detectar la enfermedad de von-Willebrand (vWD)
31. El uso según la reivindicación 30, en el que la detección de la enfermedad de von-Willebrand comprende discriminar entre tipos diferentes de la enfermedad de von-Willebrand.
32. El uso según la reivindicación 30 o 31, en el que el kit comprende además un anticuerpo según se define en cualquiera de las reivindicaciones 6, 8, 9, 10 y 11.
33. El uso según cualquiera de las reivindicaciones 30 a 32, en el que el kit comprende además un anticuerpo capaz de unirse al vWF-antígeno.
5 34. El uso según cualquiera de las reivindicaciones 30 a 33, en el que el kit comprende además un estándar y/o medios para la detección en ensayos homogéneos y/o heterogéneos según se define en cualquiera de las reivindicaciones 17 a 21.
35. El uso según cualquiera de las reivindicaciones 30 a 34, en el que la forma soluble o parte de GP1b (α) es una proteína recombinante.
10 36. El método de cualquiera de las reivindicaciones 1 a 25 o el uso de cualquiera de las reivindicaciones 26 a 35, en el que dicha forma soluble o parte de la glicoproteína Ib (α) (GPIb (α)) es recombinantemente producida.
Patentes similares o relacionadas:
Procedimiento de prueba de plaquetas en sangre, del 15 de Julio de 2020, de FUJIMORI KOGYO CO., LTD: Procedimiento para someter a prueba la agregación plaquetaria, que comprende someter sangre anticoagulada a un tratamiento débil de activación […]
Composición para la determinación de las características de coagulación de un líquido de ensayo, del 6 de Mayo de 2020, de C A CASYSO AG: Una composición de diagnóstico para su uso en el análisis viscoelástico de un líquido de ensayo seleccionado de entre sangre entera o plasma sanguíneo, que comprende: […]
Concentración de células raras, del 23 de Octubre de 2019, de SIEMENS HEALTHCARE DIAGNOSTICS INC.: Método para aumentar una razón de células raras con respecto a células no raras en una muestra de sangre que se sospecha que contiene células raras y células no raras, comprendiendo […]
Procedimiento de detección de coagulación intravascular diseminada o coagulación intravascular diseminada infecciosa, del 2 de Octubre de 2019, de LSI Medience Corporation: Un procedimiento in vitro de detección de coagulación intravascular diseminada, que comprende medir sCD14-ST en una muestra.
Interfaz y procedimientos de un interpretador de resultados de un sistema de examen de sangre, del 18 de Septiembre de 2019, de C A Casyso GmbH: Un procedimiento para proporcionar un producto de interpretación de resultados, que comprende: recibir, en una máquina analizadora de sangre […]
 Ensayo para determinar anticoagulantes en sangre o plasma sanguíneo, del 31 de Julio de 2019, de Ravmarker AB: Un ensayo para determinar los anticoagulantes en una muestra de sangre o de plasma sanguíneo, en el que los anticoagulantes determinados en dicho ensayo son inhibidores […]
Ensayo para determinar anticoagulantes en sangre o plasma sanguíneo, del 31 de Julio de 2019, de Ravmarker AB: Un ensayo para determinar los anticoagulantes en una muestra de sangre o de plasma sanguíneo, en el que los anticoagulantes determinados en dicho ensayo son inhibidores […]
Dispositivo que incluye componentes sanguíneos para separar moléculas o partículas diana de muestras, del 24 de Julio de 2019, de Debiopharm International S.A: Dispositivo de recogida de muestras para separar agentes infecciosos, toxinas, ácidos nucleicos y/o proteínas de una muestra que comprende: (i) un código […]
Reactivo de tiempo de protrombina que contiene un quelante de hierro, del 6 de Junio de 2019, de SIEMENS HEALTHCARE DIAGNOSTICS PRODUCTS GMBH: Reactivo de tiempo de protrombina que contiene proteína de factor tisular y fosfolípidos, caracterizado porque el reactivo contiene además al menos un quelante de hierro, […]