COMPOSICIONES FARMACEUTICAS DE CD5.
La presente invención se refiere a composiciones farmacéuticas que comprenden el ectodominio soluble de CD5 y a su empleo en la prevención y/o el tratamiento de infecciones fúngicas y/o septicemia fúngica,
así como trastornos inflamatorios desencadenados por componentes fúngicos
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200801860.
Solicitante: HOSPITAL CLINIC I PROVINCIAL DE BARCELONA
UNIVERSITAT DE BARCELONA
FUNDACIO CLINIC PER A LA RECERCA BIOMEDICA.
Nacionalidad solicitante: España.
Provincia: BARCELONA.
Inventor/es: LOZANO SOTO,FRANCISCO, VERA FERNANDEZ,JORGE.
Fecha de Solicitud: 20 de Junio de 2008.
Fecha de Publicación: .
Fecha de Concesión: 28 de Abril de 2011.
Clasificación Internacional de Patentes:
- A61K38/17 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
Clasificación PCT:
- A61K38/17 A61K 38/00 […] › que provienen de animales; que provienen de humanos.
PDF original: ES-2336752_B1.pdf

Fragmento de la descripción:
Composiciones farmacéuticas de CD5.
Campo de la invención
La presente invención pertenece al campo de las infecciones fúngicas. Se refiere específicamente a composiciones farmacéuticas que comprenden el ectodominio soluble de CD5 para la prevención y/o el tratamiento de infecciones fúngicas y/o septicemia fúngica, así como trastornos inflamatorios desencadenados por componentes fúngicos.
Antecedentes de la invención
El reconocimiento de patógenos por el sistema inmunitario innato se basa en un número limitado de receptores codificados por la línea germinal que han evolucionado hasta identificar estructuras microbianas conservadas, esenciales para su supervivencia y no compartidas por el huésped, los denominados patrones moleculares asociados a patógenos (PAMP) (1, 2). Ejemplos de PAMP son el lipopolisacárido (LPS) de bacterias Gram negativas, el ácido lipoteicoico (LTA) y el peptidoglicano (PGN) de bacterias Gram positivas, el lipoarabinomanano de micobacterias, y los β-glucanos y mananos de hongos. Existen varias clases estructural y funcionalmente diversas de receptores de reconocimiento de patrones (PRR) que inducen diversas rutas de defensa del huésped. Los dominios de proteína implicados en el reconocimiento de patrones incluyen, entre otros, el dominio lectina de tipo C de las lectinas de células dendrítícas (DC), las repeticiones ricas en leucina (LRR) de receptores tipo Toll (TLR) y el dominio rico en cisteínas tipo receptor scavenger (SRCR) (2). Este último se describió por primera vez tras la clonación del receptor scavenger clase A tipo I (SR-AI) de los macrófagos murinos (3). La comparación de secuencias con distintas proteínas, tales como el receptor speract de erizo de mar, el CD5 humano y murino y el factor I del complemento (CFI) reveló la existencia de un motivo conservado de 100 aminoácidos de tamaño, característico de una nueva superfamilia de receptores proteicos, denominada SRCR-SF. Esta familia está compuesta actualmente por más de 30 proteínas diferentes, secretadas y/o de membrana, con representantes en la mayoría de las especies animales, desde los invertebrados inferiores hasta los mamíferos (4). Los miembros de la SRCR-SF se dividen en dos grupos: los miembros del grupo A contienen dominios SRCR compuestos por 6 cisteínas y están codificados por dos exones, mientras que los del grupo B contienen 8 cisteínas y están codificados por un único exón. Datos estructurales recientes indican, sin embargo, que ambos dominios SRCR (A y B) comparten un armazón proteínico similar (un núcleo central formado por dos láminas β antiparalelas y una hélice α), observándose las diferencias principales en los bucles de conexión externos (5). Esta situación recuerda la de otros módulos proteicos del sistema inmunitario a partir de los que se ha establecido la evolución y se han construido miles de proteínas diferentes (por ejemplo, el dominio tipo inmunoglobulina). La versatilidad de estos dominios conservados radica en el hecho de que los residuos clave que estabilizan la estructura de dominio están conservados a lo largo de la evolución mientras que otros pueden evolucionar libremente (especialmente aquéllos en los bucles externos) dando lugar a una gran diversidad funcional (6). Por consiguiente, a pesar de su alto grado de conservación estructural y filogenética no hay una función unificadora descrita para los dominios SRCR. Algunos de ellos se han implicado en interacciones proteína-proteína siendo los ejemplos mejor estudiados de ello la interacción del receptor linfocitario CD6 con CD166/ALCAM, una molécula de adhesión transmembrana que pertenece a la superfamilia de las Ig (7, 8), y la del receptor de macrófagos de CD163/M130 con el complejo de hemoglobina-haptoglobina (9). También se sabe que algunos miembros de SRCR-SF de ambos grupos, A (es decir, SR-AI/II, MARCO y SCARA5) y B (es decir, DMBT1, Spα y CD6), interaccionan con los PAMP presentes en superficies de bacterias, tales como LPS, LTA y PGN. Aunque estas interacciones se mapearon inicialmente fuera del dominio SRCR (10), datos recientes demuestran la participación directa de los dominios SRCR en el mismo (11-14). Por tanto, sigue siendo necesario analizar si la detección de patógenos es una propiedad general compartida por todos los miembros de la SRCR-SF o sólo por un grupo seleccionado.
Los receptores transmembrana tipo I CD5 y CD6 son dos miembros linfoides del grupo B de la SRCR-SF. Ambos comparten similitudes importantes a nivel estructural y funcional y están codificados por genes contiguos en la misma región cromosómica que se cree que derivan de la duplicación de un gen ancestral común (15, 16). CD5 y CD6 se expresan en timocitos desde fases tempranas de su desarrollo, en células T periféricas maduras y en células B1a, una pequeña subpoblación de células B maduras responsable de la producción de anticuerpos naturales polirreactivos y que se expande en ciertas enfermedades autoinmunitarias y en leucemias linfocíticas crónicas de células B (17). Las regiones extracelulares de CD5 y CD6, están compuestas exclusivamente por tres dominios consecutivos SRCR del grupo B, que muestran una extensa identidad de secuencia aminoacídica (5). Las principales diferencias entre CD5 y CD6 se encuentran en sus regiones citoplasmáticas, las cuales carecen de actividad catalítica intrínseca pero contienen varios motivos estructurales compatibles con una función transductora de señales (18, 19). A ese respecto, CD5 y CD6 se asocian físicamente al receptor específico de antígeno presente en células T (TCR) y B (BCR) (20, 21) y se ubican junto con éste en el centro de la sinapsis inmunológica (21, 22). Por tanto, CD5 y CD6 están bien situados para modular positiva o negativamente las señales de activación y diferenciación generadas por el receptor específico de antígeno (22-26) a través de rutas de señalización complejas y todavía no completamente comprendidas (23, 27-29). Esto se consigue probablemente a través de la interacción de los ectodominios de CD5 y CD6 con diferentes contrareceptores de superficie celular. Aunque está bien establecido que CD6 se une a CD166/ALCAM (30), todavía falta un ligando de CD5 bona fide (31-35). De manera interesante, parece que CD5 y CD6 se diferencian en restos críticos para la unión a CD166/ALCAM (36).
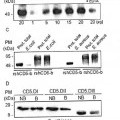
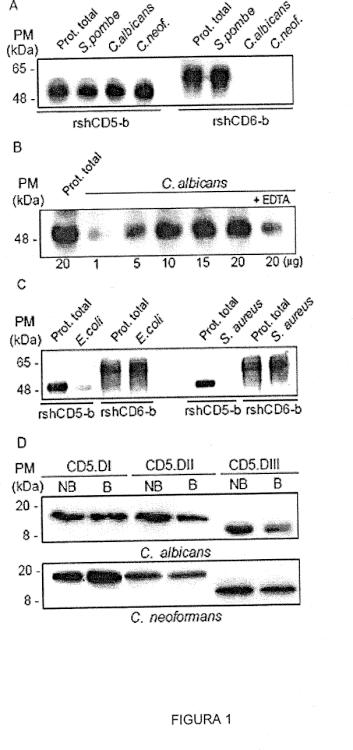
En un estudio previo se exploraron las capacidades de unión a bacterias de los ectodominios de CD5 y CD6, los cuales se sabe que existen como formas solubles circulantes en suero (37, 38). Los datos obtenidos indican que ambas formas de CD6, solubles y de membrana, pero no de CD5, se unen a la superficie de bacterias Gram negativas y bacterias Gram positivas a través del reconocimiento de los PAMP específicos (en concreto, LPS y LTA, respectivamente) (39).
Otros estudios han demostrado que las células que expresan en su superficie el receptor CD5, ya sean células T o células B, poseen la capacidad de reconocer y, en mayor o menor medida, afectar al normal desarrollo de C. neoformans y C. albicans (48, 49).
Sin embargo, no se ha descrito ni sugerido el mecanismo por el cual este receptor reconoce o tiene afinidad por las células fúngicas.
Ahora, los autores de la presente invención han extendido estos estudios el análisis de las propiedades de reconocimiento y de unión de CD5 y CD6 a estructuras fúngicas y han comprobado que, en comparación con CD6, el ectodominio de CD5 es adecuado para el reconocimiento de componentes conservados de las superficies celulares fúngicas, demostrando por primera vez que dicha región extracelular aislada del receptor CD5 puede proporcionar profilaxis in vivo por sí misma frente a una infección por hongos en general y no sólo frente C. neoformans y C. albicans.
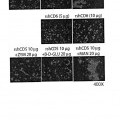
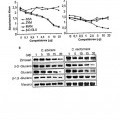
Así, han demostrado que formas solubles del ectodominio de CD5 se unen a y agregan específicamente células fúngicas. Esto se realiza a través del reconocimiento, por el ectodominio soluble de CD5, de β-glucanos, un componente estructural y altamente conservado de las paredes celulares fúngicas.
Además, de forma sorprendente, los autores de la presente invención han demostrado que los ectodominios de CD5 solubles tienen un efecto protector en el modelo de ratón de síndrome del shock séptico inducido porzimosán.
Estos resultados apoyan la utilidad terapéutica de la administración del ectodominio soluble de CD5 humano para el tratamiento del síndrome del shock séptico u otros procesos inflamatorios de origen fúngico.
Breve descripción de las figuras
Figura... [Seguir leyendo]
Reivindicaciones:
1. Composición farmacéutica que comprende el ectodominio soluble de CD5 y al menos un excipiente farmacéutico.
2. Composición según la reivindicación 1 en forma inyectable.
3. Composición según cualquiera de las reivindicaciones 1 ó 2, para la prevención y/o el tratamiento de una infección fúngica y/o septicemia fúngica y/o cualquier trastorno inflamatorio desencadenado por componentes fúngicos.
4. Composición según la reivindicación 1, en la que la infección y/o septicemia y/o el trastorno inflamatorio se produce por Candida albicans o Criptococcus neoformans.
5. Uso del ectodominio soluble de CD5 para el reconocimiento de β-glucanos.
6. Uso del ectodominio soluble de CD5 para agregar células fúngicas y/o componentes de la pared celular fúngica ricos en β-glucanos.
7. Uso del ectodominio de CD5 soluble para la fabricación de un medicamento para la prevención y/o el tratamiento de una infección fúngica y/o septicemia fúngica y/o cualquier trastorno inflamatorio desencadenado por componentes fúngicos.
8. Uso según la reivindicación 7, en el que la infección y/o septicemia y/o el trastorno inflamatorio se produce por Candida albicans o Criptococcus neoformans.
9. Procedimiento para obtener un ectodominio DI de CD5 soluble humano recombinante que comprende:
10. Procedimiento según la reivindicación 9, en el que el vector de expresión empleado en b) es pCEP-Pu.
11. Procedimiento según la reivindicación 10, en el que la expresión del ectodominio DI de CD5 soluble humano recombinante se lleva a cabo en células HEK 293-EBNA.
12. Procedimiento para obtener un ectodominio DII de CD5 soluble recombinante que comprende:
13. Procedimiento según la reivindicación 12, en el que el vector de expresión empleado en b) es pCEP-Pu.
14. Procedimiento según la reivindicación 13, en el que la expresión del ectodominio DII de CD5 humano recombinante soluble se lleva a cabo en células HEK 293-EBNA.
15. Oligonucleótido con secuencia mostrada en la SEQ ID NO 1.
16. Oligonucleótido con secuencia mostrada en la SEQ ID NO 2.
17. Oligonucleótido con secuencia mostrada en la SEQ ID NO 3.
18. Oligonucleótido con secuencia mostrada en la SEQ ID NO 4.
Patentes similares o relacionadas:
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Biomarcador de enfermedad autoinmunitaria, del 15 de Julio de 2020, de Tzartos, Socrates: Un método de diagnóstico o pronóstico de una enfermedad autoinmunitaria asociada con la formación de lesiones desmielinizadas del sistema nervioso central (SNC) […]
Compuestos de TAFA4 y usos de los mismos para tratar el dolor, del 1 de Julio de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (C.N.R.S.): Una proteína TAFA4 aislada o un agonista de la misma, para uso como ingrediente activo para prevenir o tratar el dolor en un sujeto, en donde […]
Nueva inmunoterapia contra diversos tumores como el cáncer gastrointestinal y gástrico, del 24 de Junio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido seleccionado del grupo siguiente: a) péptido consistente en la secuencia conforme a la SEQ ID N.º 86, b) el péptido conforme a a), en la […]
Inmunoterapia WT1 para enfermedad angiogénica intraocular, del 17 de Junio de 2020, de INTERNATIONAL INSTITUTE OF CANCER IMMUNOLOGY, INC.: Una composición farmacéutica que comprende un péptido WT1 o péptido WT1 variante para su uso en el tratamiento y/o prevención de una enfermedad […]
Usos de composiciones de caseína, del 17 de Junio de 2020, de FONTERRA CO-OPERATIVE GROUP LIMITED: Uso de una composicion de caseina para aumentar la concentracion de leucina libre en suero sanguineo en un sujeto, en donde la composicion de caseina comprende o la caseina […]
Péptidos inhibidores derivados del transcrito de tipo TREM-1 (TLT-1) y sus usos, del 10 de Junio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un polipéptido de 6 a 16 aminoácidos que comprende al menos 6 aminoácidos consecutivos de la secuencia de aminoácidos sec. con núm. de ident.: 4 para su uso en el tratamiento […]