COMPOSICIONES PARA DESENCADENAR UNA RESPUESTA INMUNITARIA CONTRA MYCOBACTERIUM AVIUM SUBESPECIE PARATUBERCULOSIS.
Uso de una composición que comprende uno o más vectores de expresión para la fabricación de un medicamento para estimular una respuesta inmunitaria en un rumiante contra M.
paratuberculosis; en el que el uno o más vectores de expresión comprenden al menos cinco secuencias polinucleotídicas aisladas que codifican antígenos de M. paratuberculosis, y en el que los vectores de expresión son capaces de expresar dichos antígenos de M. paratuberculosis; y en el que los antígenos de M. paratuberculosis son los antígenos de M. paratuberculosis 85A, 85B, 85C, proteína de 35 kDa de M. paratuberculosis y superóxido dismutasa (SOD)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/005509.
Solicitante: CORNELL RESEARCH FOUNDATION, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: CORNELL BUSINESS & TECHNOLOGY PARK 20 THORNWOOD DRIVE SUITE 105 ITHACA, NEW YORK 14850 ESTADOS UNIDOS DE AMERICA.
Inventor/es: CHANG, YUNG-FU.
Fecha de Publicación: .
Fecha Solicitud PCT: 16 de Febrero de 2006.
Clasificación Internacional de Patentes:
- A61K39/04 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Mycobacterium, p. ej. Mycobacterium tuberculosis.
Clasificación PCT:
- A01N63/00 A […] › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › Biocidas, productos que repelen o atraen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen microorganismos, virus, hongos microscópicos, animales, o sustancias producidas por, u obtenidas a partir de microorganismos, virus, hongos microscópicos o animales, p. ej. encimas o productos de fermentación (que contienen compuestos de constitución determinada A01N 27/00 - A01N 59/00; algas unicelulares A01N 65/03).
- A61K38/00 A61K […] › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K39/00 A61K […] › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K39/02 A61K 39/00 […] › Antígenos bacterianos.
- A61K39/04 A61K 39/00 […] › Mycobacterium, p. ej. Mycobacterium tuberculosis.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2357968_T3.pdf


Fragmento de la descripción:
La presente invención se refiere en general a la estimulación de respuestas inmunitarias, y más específicamente a composiciones y usos para estimular respuestas inmunitarias profilácticas y/o terapéuticas contra Mycobacterium 5 avium subespecie paratuberculosis.
La Mycobacterium avium subespecie paratuberculosis (MPT) es el agente causante de la enfermedad de Johne (EJ), que causa enteritis granulomatosa crónica en rumiantes. Los animales afectados clínicamente desarrollan diarrea crónica y pérdida de peso progresiva que, dado el caso, da como resultado la muerte, mientras que los animales infectados subclínicamente principalmente tienen una producción reducida de leche. La EJ es de enorme 10 importancia económica para la industria láctea mundial, causando pérdidas importantes debido a la producción reducida y al sacrificio temprano de animales con estimaciones de un 20% de los rebaños lecheros de EE.UU. afectados y costes de 220 millones de dólares al año para la industria láctea (Wells, y col. 2000. J. Am. Vet. Med. Assoc. 216: 1450-1457). El ganado vacuno es más susceptible de infección por este organismo en los primeros 6 meses de vida, pero la enfermedad típicamente no se evidencia hasta los 3 a 5 años de edad. La infección ocurre 15 mediante la ingestión de estiércol contaminado, calostro o leche de vacas infectadas (Sweeney, 1996. Vet. Clin. N. Am. Food Anim. Pract. 12: 305-312). También ocurre infección fetal, particularmente en vacas preñadas con enfermedad avanzada (Sweeney, y col. 1992. Am. J. Vet. Res. 53: 477-480). Aunque la EJ es una enfermedad infecciosa importante de los rumiantes, no existe una vacuna eficaz contra esta enfermedad. La única vacuna disponible actualmente en los Estados Unidos consiste en M. avium subespecie paratuberculosis inactivada en un 20 coadyuvante oleoso (Kormendy, B. 1992. Acta Vet. Hung. 40: 171-184; Larsen, y col., 1978. Am. J. Vet. Res. 39: 65-69). Sin embargo, dichos programas de vacunación han generado graves problemas de salud pública. Por ejemplo, al menos un veterinario se inoculó accidentalmente en la mano durante la vacunación de animales (Patterson, y col., (1988) J. Am. Vet. Med. Assoc. 192: 1197-1199). Adicionalmente, los estudios han demostrado que hay una fuerte reacción en los sitios de inyección después de la vacunación con esta bacteria inactivada (Kormendy, B. 1992. Acta 25 Vet. Hung. 40: 171-184; Larsen, y col., 1978, Am. J. Vet. Res. 39: 65-69). Otra desventaja de esta vacuna es que los animales vacunados se vuelven positivos en la prueba cutánea de tuberculina (Kormendy, B. 1992. Acta Vet. Hung. 40: 171-184; Larsen, y col., 1978. Am. J. Vet. Res. 39: 65-69). Por tanto, existe la necesidad de desarrollar vacunas más eficaces contra la EJ que puedan usarse como composiciones profilácticas y/o terapéuticas seguras y eficaces para infección por MPT. 30
El documento WO 03/076898 describe diagnósticos de micobacterias.
Velaz-Faircloth y col. Infection and Immunity, vol. 67(8), agosto de 1999, páginas 4243-4250, describen la protección frente a M. avium por vacunas de ADN que expresan antígenos micobacterianos en forma de proteínas de fusión con GFP.
Uzonna J.E. y col., Vaccine, vol. 21, 2003, páginas 3101-3109, describen la eficacia de vacunaciones con la cepa 35 comercial y de campo M. paratuberculosis con IL-12 recombinante en un modelo de infección experimental bovina.
Mullerad J. y col., Med. Microbiol. Immunol., vol.190, 2002, páginas 179-187, describen la inmunogenicidad del antígeno 85B de M. paratuberculosis.
Shin y col. J. Vet. Sci. vol. 5(2), 2004, páginas 111-117, describen la respuesta de anticuerpos comparativa de cinco antígenos recombinantes con relación a los niveles de excreción bacteriana y el desarrollo de diagnóstico serológico 40 basado en el antígeno de 25 kDa de M. avium subespecie paratuberculosis.
Shin y col., Infect. Immun. vol. 73(8), agosto de 2005, páginas 5074-5085, describen las respuestas inmunitarias celulares in vitro ante antígenos recombinantes de M. avium subespecie paratuberculosis.
Dheenadhayalan y col., DNA Sequence, vol. 13(5), 2002, páginas 287-294, describen la clonación y caracterización de los genes que codifican los antígenos 85A, 85B y 85C de M. avium subespecie paratuberculosis. 45
La presente invención proporciona usos para estimular una respuesta inmunitaria en rumiantes contra M. paratuberculosis (MPT), como se define en las reivindicaciones. Las composiciones comprenden componentes inmunitarios, que son polinucleótidos que codifican antígenos de MPT, como se define en la reivindicación. Las composiciones comprenden al menos cinco componentes inmunogénicos recombinantes: los antígenos de MPT 85A, 85B, 85C, de 35kDa y superóxido dismutasa (SOD). Son otros antígenos de MPT ejemplares MptC, MptD y 50 proteína similar a ESAT-6.
El uso es para estimular una respuesta inmunitaria en un rumiante contra bacterias MPT.
Las composiciones que comprenden antígenos proteicos de MPT recombinantes, polinucleótidos de ADN que codifican antígenos de MPT o combinaciones de los mismos, pueden formularse con portadores farmacéuticos estándar y pueden ser para administración mediante cualquiera de una variedad de vías convencionales. Las 55
composiciones pueden ser para administración en cualquier momento a un rumiante susceptible de contraer infección por MPT o a un animal que esté infectado por MPT. Sin embargo, es preferible que las composiciones de la invención sean para administración antes de la infección por MPT, tal como para administración a rumiantes preñadas que pueden transferir componentes inmunogénicos profilácticos a sus crías mediante el calostro, o para administración durante el periodo de una a cinco semanas después del nacimiento. 5
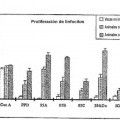
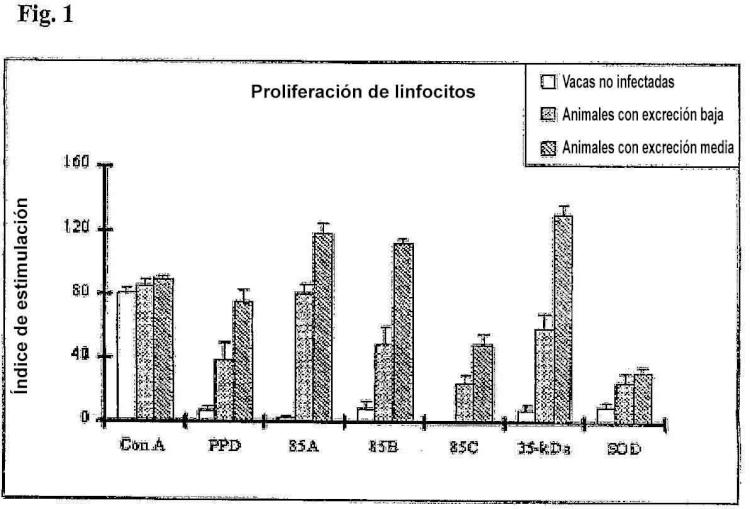
La Fig. 1 es una representación gráfica de los datos del análisis de respuestas proliferativas de células mononucleares de sangre periférica de vacas infectadas y sanas de control estimuladas in vitro con 5 proteínas recombinantes de MPT. Los resultados se expresan como un índice de estimulación y las barras de error representan la desviación estándar de la media. No se observó una proliferación significativa ante ningún antígeno por PBMC de vacas no infectadas (P>0,05). Mostraron la mayor actividad proliferativa 85A y 10 la proteína de 35 kDa en animales de excreción baja y media, respectivamente.
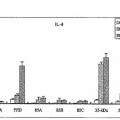
La Fig. 2. es una representación gráfica de los datos del análisis de la producción de interferón γ en respuesta ante antígenos individuales con relación a los niveles de excreción de MPT. Los resultados se dan como valores de DO en pocillos estimulados–valores de DO en pocillos de control (IFN-γ producido naturalmente). Las barras de error representan las desviaciones estándar de las medias. 85A y 85B eran los antígenos más 15 inducibles a producir IFN-γ en células mononucleares de sangre periférica bovina a partir de animales con ambos tipos de excreción.
La Fig. 3. es una representación gráfica de los datos del análisis de las respuestas de anticuerpo ante antígenos individuales con relación a los valores de excreción de MPT. Las barras representan los valores medios de DO a 405 nm. Las barras de error representan las desviaciones estándar de las medias. Todos los antígenos 20 recombinante mostraron aumentos de las respuestas de anticuerpo según los niveles de excreción y las respuestas de anticuerpo ante la proteína de 35 kDa estaban positivamente separados entre las vacas sanas no infectadas y con ambos tipos de excreción (P<0,01).
Las Fig. 4A-4D son representaciones gráficas de los datos del análisis de los cambios en la distribución de subconjuntos de linfocitos T en linfocitos de sangre periférica bovina después de estimulación con antígenos 25 recombinantes, como se determina mediante análisis por FACS. Fig. 4A. CD4; Ag 85A y Ag 85B inducían una mayor proporción de linfocitos T CD4+ en animales de excreción media en comparación con animales de excreción baja, mientras que el porcentaje de linfocitos CD4+ no cambiaba en el ganado vacuno de control no infectado. Fig. 4B. CDB; Ag 85A aumentaba la proporción de linfocitos T CD8+ en animales de excreción media, mientras que el porcentaje aumentado de linfocitos CD8+ era muy bajo en ganado vacuno no 30 infectado. Fig. 4C. CD25; Ag 85A y Ag85B aumentaban la proporción de linfocitos T CD25+ en ambos grupos de excreción, mientras que tenían poco efecto en ganado vacuno no infectado. En contraposición, Ag 85C y la proteína de 35 kDa aumentaban... [Seguir leyendo]
Reivindicaciones:
1. Uso de una composición que comprende uno o más vectores de expresión para la fabricación de un medicamento para estimular una respuesta inmunitaria en un rumiante contra M. paratuberculosis;
en el que el uno o más vectores de expresión comprenden al menos cinco secuencias polinucleotídicas aisladas que codifican antígenos de M. paratuberculosis, y en el que los vectores de expresión son capaces de expresar dichos 5 antígenos de M. paratuberculosis; y
en el que los antígenos de M. paratuberculosis son los antígenos de M. paratuberculosis 85A, 85B, 85C, proteína de 35 kDa de M. paratuberculosis y superóxido dismutasa (SOD).
2. Uso según la reivindicación 1, en el que el rumiante es un animal bovino, una oveja, una cabra, un ciervo o un alce. 10
3. Uso según la reivindicación 2, en el que el rumiante es animal bovino.
4. Uso según cualquiera de las reivindicaciones 1-3, en el que el rumiante no está infectado por M. paratuberculosis.
5. Uso según cualquiera de las reivindicaciones 1-3, en el que el rumiante está infectado por M. paratuberculosis.
6. Uso según la reivindicación 3, en el que el animal bovino tiene la enfermedad de Johne.
7. Uso según cualquiera de las reivindicaciones 1-6, en el que el animal está preñado. 15
8. Uso según cualquiera de las reivindicaciones 1-7, en el que la composición comprende un portador farmacéuticamente aceptable.
9. Uso según la reivindicación 8, en el que la composición comprende adicionalmente un coadyuvante.
10. Una composición que comprende uno o más vectores de expresión para uso en la estimulación de una respuesta inmunitaria contra M. paratuberculosis en un rumiante; 20
en la que el uno o más vectores de expresión comprenden al menos cinco secuencias polinucleotídicas aisladas que codifican antígenos de M. paratuberculosis, en la que los vectores de expresión son capaces de expresar dichos antígenos de M. paratuberculosis; y
en la que los antígenos de M. paratuberculosis son los antígenos de M. paratuberculosis 85A, 85B, 85C, proteína de 35 kDa de M. paratuberculosis y superóxido dismutasa (SOD). 25
11. La composición de la reivindicación 10, que comprende adicionalmente un portador farmacéuticamente aceptable.
12. La composición de la reivindicación 10, que comprende adicionalmente un coadyuvante.
13. Uso según cualquiera de las reivindicaciones 1-9, o de una composición para uso según cualquiera de las reivindicaciones 10-12, en el que la composición comprende un vector de expresión que comprende dichas al menos 30 cinco secuencias polinucleotídicas aisladas, en el que dicho vector de expresión es capaz de expresar dichos al menos cinco antígenos de M. paratuberculosis.
14. Uso según cualquiera de las reivindicaciones 1-9, o de una composición para su uso según cualquiera de las reivindicaciones 10-12, en el que la composición comprende al menos cinco vectores de expresión, en el que cada uno de dichos al menos cinco vectores de expresión comprende una diferente de dichas al menos cinco secuencias 35 polinucleotídicas aisladas, y en el que cada uno de dichos al menos cinco vectores de expresión es capaz de expresar uno diferente de dichos al menos cinco antígenos de M. paratuberculosis.
Patentes similares o relacionadas:
Composiciones inmunogénicas de PCV2 multivalentes y métodos para producir dichas composiciones, del 27 de Mayo de 2020, de Boehringer Ingelheim Animal Health USA Inc: Una vacuna combinada multivalente para uso en un método para (i) la prevención de una infección por PCV2, o de reinfección por PCV2 o (ii) la reducción o eliminación […]
Arginina desiminasa con reactividad cruzada reducida hacia anticuerpos para ADI - PEG 20 para el tratamiento del cáncer, del 6 de Mayo de 2020, de TDW Group: Una composición terapéutica que comprende una arginina desiminasa (ADI) aislada y un vehículo farmacéuticamente aceptable, en donde la ADI aislada comprende la secuencia de […]
Mycobacterium recombinante como vacuna para uso en seres humanos, del 18 de Marzo de 2020, de VAKZINE PROJEKT MANAGEMENT GMBH: Una célula de Mycobacterium bovis recombinante de la cepa Danesa subtipo Praga que es deficiente en ureasa y que comprende una molécula de ácido nucleico […]
VACUNA MULTIVALENTE PARA EL TRATAMIENTO Y PREVENCIÓN DE LA TUBERCULOSIS, LISTERIOSIS Y NEUMONÍA, del 26 de Diciembre de 2019, de FUNDACIÓN INSTITUTO DE INVESTIGACIÓN MARQUÉS DE VALDECILLA: La presente invención se refiere a una vacuna sintética multivalente eficaz en el tratamiento y/o prevención de la tuberculosis, listeriosis y neumonías. Las vacunas terapéuticas […]
VACUNA MULTIVALENTE PARA EL TRATAMIENTO Y PREVENCIÓN DE LA TUBERCULOSIS, LISTERIOSIS Y NEUMONÍA, del 23 de Diciembre de 2019, de FUNDACIÓN INSTITUTO DE INVESTIGACIÓN MARQUÉS DE VALDECILLA: Vacuna multivalente para el tratamiento y prevención de la tuberculosis, listeriosis y neumonía. La presente invención se refiere a una vacuna sintética […]
 Composición antigénica de micobacterias, del 31 de Julio de 2019, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una composición inmunogénica que comprende un antígeno relacionado con M72, en la que el antígeno relacionado con M72 comprende una secuencia […]
Composición antigénica de micobacterias, del 31 de Julio de 2019, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una composición inmunogénica que comprende un antígeno relacionado con M72, en la que el antígeno relacionado con M72 comprende una secuencia […]
 Vacunas antimicobacterianas, del 31 de Julio de 2019, de UNIVERSITE DE GENEVE: Una partícula de virus infeccioso de la coriomeningitis linfocítica deficiente en la replicación para uso como una vacuna en un método para tratar o prevenir una infección […]
Vacunas antimicobacterianas, del 31 de Julio de 2019, de UNIVERSITE DE GENEVE: Una partícula de virus infeccioso de la coriomeningitis linfocítica deficiente en la replicación para uso como una vacuna en un método para tratar o prevenir una infección […]
Vacuna TB contra la tuberculosis para impedir la reactivación, del 28 de Mayo de 2019, de STATENS SERUM INSTITUT: Vacuna para la utilización en el bloqueo de la reactivación de la tuberculosis en individuos con infección latente por M. tuberculosis, que comprende […]