COMPLEJO COVALENTE DE FACTOR VII Y FACTOR TISULAR.
Complejo covalente de un polipéptido de factor VII funcionalmente activo y un polipéptido de factor tisular,
donde dichos polipéptido de factor VII y polipéptido de factor tisular están vinculados de manera covalente mediante una o más uniones directas entre cadenas laterales de aminoácidos de conjuntos de (i) un aminoácido del polipéptido de factor VII y (ii) un aminoácido del polipéptido de factor tisular
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/053105.
Solicitante: NOVO NORDISK HEALTH CARE AG.
Nacionalidad solicitante: Suiza.
Dirección: ANDREASSTRASSE 15 8050 ZÜRICH SUIZA.
Inventor/es: OLSEN, OLE HVILSTED, PETERSEN,ANDERS,KLARSKOV, STENNICKE,HENNING RALF, ØSTERGAARD,HENRIK.
Fecha de Publicación: .
Fecha Solicitud PCT: 30 de Marzo de 2007.
Clasificación Internacional de Patentes:
- C07K14/705Z
- C07K14/745 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factores de coagulación sanguínea o de fibrinolisis.
Clasificación PCT:
- A61K38/48 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que actúan sobre enlaces peptídicos (3.4).
- C07K14/705 C07K 14/00 […] › Receptores; Antígenos celulares de superficie; Determinantes celulares de superficie.
- C07K14/745 C07K 14/00 […] › Factores de coagulación sanguínea o de fibrinolisis.
- C12N9/64 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › que provienen de tejido animal, p. ej. renina.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Complejo covalente de factor VII y factor tisular.
Campo de la invención
La presente invención se refiere a nuevos complejos covalentes de un polipéptido de factor VII y un polipéptido de factor tisular, en particular a tales complejos los cuales son funcionalmente activos y tienen una actividad proteolítica de factor X mejorada en comparación con el polipéptido de factor VII libre correspondiente. Tales complejos se creen particularmente útiles en el tratamiento de trastornos de sangrado.
Antecedentes de la invención
Los polipéptidos de factor VIIa con actividad biológica aumentada son moléculas deseables para el tratamiento de sangrados descontrolados que son parcialmente o completamente refractarias a la terapia de factor VIIa recombinante convencional debido a la fuerza subóptima del factor VIIa recombinante. Enfoques actuales para mejorar la potencia reflejan el mecanismo de acción del factor VIIa recombinante el cual parece ser la activación de factor X directa en la plaqueta activada independiente de factor tisular.
El factor tisular es un receptor de glicoproteína de membrana integral de 263 aminoácidos residiendo en las células de la adventitia vascular. Consiste en una parte extracelular plegada en dos dominios de tipo III de fibronectina compactos (1-219) cada uno estabilizado por una única unión disulfuro, un segmento de transmembrana (220-242), y una cola citoplásmica corta (243-263). Éste sirve como el factor determinante de coagulación formando un complejo apretado dependiente de Ca2+ con factor VII el cual se captura a partir de la circulación en una lesión vascular. El factor tisular también aumenta inmensamente la actividad proteolítica del factor VIIa hacia sus sustratos fisiológicos de factor IX y factor X proporcionando un andamio para interacciones de exositio macromoleculares óptimas e induciendo a cambios conformacionales en el dominio de la proteasa de factor VIIa dando como resultado la definición correcta de la región de sitio activo. La activación conformacional de FVIIa mediante TF la cual resulta de la interacción directa proteína-proteína, se puede recapitular in vitro suministrando factor VIIa con el ectodominio soluble del factor tisular (sTF).
Miyata et al., Biochemistry, 36, 1997, 5120-5127, revela un complejo covalente de factor VIIa recombinante y factor tisular soluble estando químicamente reticulado mediante un reactivo amina-específico homo-bifuncional. No obstante el complejo reticulado no mostró actividad proteolítica hacia el factor X.
Breve descripción de la invención
La presente invención se refiere a nuevos complejos covalentes de un polipéptido de factor VII y un polipéptido de factor tisular. Los complejos mostraron una actividad proteolítica mejorada hacia el factor X de sustrato macromolecular en relación al polipéptido de factor VII libre correspondiente.
Más particularmente, la presente invención se refiere a un complejo covalente de un polipéptido de factor VII y un polipéptido de factor tisular, donde el polipéptido de factor VII y el polipéptido de factor tisular están vinculados covalentemente mediante uno o más enlaces designados entre cadenas laterales de aminoácido de conjuntos de (i) un aminoácido del polipéptido de factor VII y (ii) un aminoácido del polipéptido de factor tisular.
Por otra parte, la presente invención también se refiere a un complejo covalente de un polipéptido de factor VIIa y un polipéptido de factor tisular, donde el polipéptido de factor VIIa y el polipéptido de factor tisular están vinculados covalentemente mediante uno o más enlaces entre cadenas laterales de aminoácidos de conjuntos de (i) un aminoácido del polipéptido de factor VIIa y (ii) un aminoácido del polipéptido de factor tisular, donde la actividad proteolítica del polipéptido de factor VIIa es al menos 2 veces, tal como al menos 50 veces, por ejemplo al menos 100 veces, tal como al menos 200 veces, o al menos 250 veces, de la cantidad de factor VIIa libre nativo (de tipo salvaje), como se determina por el ensayo proteolítico in vitro definido aquí.
La presente invención también se refiere a un método para la producción de un complejo de un polipéptido de factor VII y un polipéptido de factor tisular tal y como se define aquí, el método comprendiendo a) transfectar una célula con (i) un vector de expresión comprendiendo una molécula de ácido nucleico codificando el polipéptido de factor VII y regiones de control de expresión operativamente vinculados a la misma y (ii) y un vector de expresión comprendiendo una molécula de ácido nucleico codificando el polipéptido de factor tisular y regiones de control de expresión operativamente vinculados a la misma, b) cultivar la célula modificada bajo condiciones para la expresión del polipéptido de factor VII y el polipéptido de factor tisular, y c) aislar el complejo expresado por medios adecuados.
Breve descripción de los dibujos
La Figura 1 muestra un modelo del complejo covalente de factor VIIa y el factor tisular soluble conteniendo un bisulfuro de extensión por palmos de interfaz entre v207C en factor tisular soluble y f40C en factor VIIa. La Co-distancia de v207C o f40C con los residuos de cisteína nativos (tipo salvaje) a través de la interfaz es significativamente mayor de 7 Å lo cual excluye la formación de parejas de bisulfuro no intencionadas entre las dos moléculas.
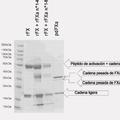
La Figura 2 muestra un gel de SDS-poliacrilamida manchado de Coomassie de factor VIIa nativo (tipo salvaje) (vía A) y el complejo de factor VIIa purificado F40C-sTF(1-219) v207C (vía B) bajo condiciones no reductoras y reductoras, respectivamente. HC y LC representan las cadenas pesada y ligera del factor VIIa.
La Figura 3 muestra una inmunotransferencia de factor VIIa de tipo salvaje (vía A), un medio acondicionado a partir de la coexpresión transitoria de q64C y sTF(1-219) g109C (vía B) de factor VII, y complejo F40C-sTF(1-219) v207C (vía C) de factor VIIa purificado.
Descripción detallada de la invención
La presente invención, i.a., se refiere a un complejo covalente de un polipéptido de factor VII y un polipéptido de factor tisular, donde el polipéptido de factor VII y el polipéptido de factor tisular están enlazados covalentemente mediante uno o más enlaces designados entre cadenas laterales de aminoácido de conjuntos de (i) un aminoácido del polipéptido de factor VII y (ii) un aminoácido del polipéptido de factor tisular.
En el presente contexto, el término "complejo covalente" se refiere a dos moléculas (aquí: un polipéptido de factor VII y un polipéptido de factor tisular) asociadas por al menos un enlace o unión covalente y una pluralidad de interacciones no covalentes, por ejemplo uniones de hidrógeno, interacciones hidrofóbicas, etc. Por lo tanto, el polipéptido de factor VII y el polipéptido de factor tisular están vinculados covalentemente de esta manera.
Los dos polipéptidos se vinculan mediante uno o más enlaces designados entre cadenas laterales de aminoácidos de conjuntos de (i) un aminoácido del polipéptido de factor VII y (ii) un aminoácido del polipéptido de factor tisular.
Cuando se usa aquí, el término "polipéptido de factor VII" comprende factor VII de tipo salvaje (es decir, un polipéptido que tiene la secuencia de aminoácidos descrita en la patente EEUU nº. 4.784.950), al igual que variantes de factor VII, derivados de factor VII y conjugados de factor VII mostrando sustancialmente una actividad biológica igual o mejorada en relación al factor VII de tipo salvaje. El término "factor VII" se utiliza para expresar polipéptidos de factor VII en sus formas no divididas (zimógenos), al igual que aquellos que se han procesado proteolíticamente para producir sus formas bioactivas respectivas, las cuales pueden designarse como factor VIIa. Típicamente, el factor VII se divide entre los residuos 152 y 153 para producir factor VIIa. El término "polipéptido de factor VII" también comprenden polipéptidos, incluyendo variantes, en los cuales la actividad biológica de factor VIIa se ha modificado sustancialmente o se ha reducido en cierta medida en relación a la actividad de factor VIIa de tipo salvaje. Estos polipéptidos incluyen, sin limitación, factor VII o factor VIIa en los cuales se han introducido alteraciones de secuencias de aminoácidos específicas que modifican o disgregan la bioactividad del polipép- tido.
Reivindicaciones:
1. Complejo covalente de un polipéptido de factor VII funcionalmente activo y un polipéptido de factor tisular, donde dichos polipéptido de factor VII y polipéptido de factor tisular están vinculados de manera covalente mediante una o más uniones directas entre cadenas laterales de aminoácidos de conjuntos de (i) un aminoácido del polipéptido de factor VII y (ii) un aminoácido del polipéptido de factor tisular.
2. Complejo según la reivindicación 1, donde la actividad proteolítica del polipéptido de factor VII es al menos 2 veces, tal como al menos 50 veces, por ejemplo al menos 100 veces, tal como al menos 200 veces, o al menos 250 veces, la del factor VIIa libre nativo (de tipo salvaje), como se determina por el ensayo de proteólisis in vitro.
3. Complejo según cualquiera de las reivindicaciones precedentes, donde los conjuntos de aminoácidos comprenden uno o más aminoácidos de cisteína.
4. Complejo según la reivindicación 3, donde cada uno de los conjuntos comprende un aminoácido de cisteína.
5. Complejo según la reivindicación 3, donde cada uno de los conjuntos comprende dos aminoácidos de cisteína.
6. Complejo según cualquiera de las reivindicaciones precedentes, donde al menos uno de los aminoácidos en las posiciones Tr17Thr17, Lys20, Ile22, Ser42, Gly43, Asp44, Trp45, Lys46, Ser47, Phe50, Cys57, Asp58, Asp61, Gly109, Gln110, Leu133, Ser205, Pro206 y Val207 del polipéptido de factor tisular soluble, en particular Trp45, Asp58, Gly109, Pro206 y Val207 del polipéptido de factor tisular soluble, se ha sustituido por un aminoácido con una cadena lateral reactiva que da lugar a dicha(s) unión(es) directa(s).
7. Complejo según cualquiera de las reivindicaciones precedentes, donde al menos uno de los aminoácidos en las posiciones Leu39Leu39, Phe40, Ile42, Ser43, Tyr44, Gln64, Leu65, Ile69, Glu77, Gly78, Arg79, Val92, Phe275, Val276, Arg277, Met306, Thr307, y Glu325 del polipéptido de factor VII, en particular Phe40, Ser43, Gln64 Glu77 y Phe275 del polipéptido de factor VII, se ha sido sustituido por un aminoácido con una cadena lateral reactiva que da lugar a dicha(s) unión(es) directa(s).
8. El complejo según cualquiera de las reivindicaciones precedentes, donde uno o ambos aminoácidos de al menos uno de los conjuntos de aminoácidos
FVII-Ile69 - sTF-Thr17,
FVII-Ile69 - sTF-Lys20,
FVII-Arg79 - sTF-Ile22,
FVII-Val92 - sTF-Ser47,
FVII-Val92 - sTF-Phe50,
FVII-Gly78 - sTF-Cys57,
FVII-Glu77 - sTF-Asp58,
FVII-Gly78 - sTF-Asp58,
FVII-Arg79 - sTF-Asp58,
FVII-Arg277 - sTF-Ser42,
FVII-Val276 - sTF-Gly43,
FVII-Arg277 - sTF-Gly43,
FVII-Phe275 - sTF-Asp44,
FVII-Val276 - sTF-Asp44,
FVII-Arg277 - sTF-Asp44,
FVII-Phe275 - sTF-Trp45,
FVII-Val276 - sTF-Trp45,
FVII-Argl34 - sTF-Trp45,
FVII-Phe275 - sTF-Lys46,
FVII-Gln64 - sTF-Gly109,
FVII-Gln64 - sTF-Gln110,
FVII-Leu65 - sTF-Gln110,
FVII-Phe71 - sTF-Leu133,
FVII-Ser43 - sTF-Ser205,
FVII-Leu39 - sTF-Pro206,
FVII-Phe40 - sTF-Pro206,
FVII-Ile42 - sTF-Pro206,
FVII-Ser43 - sTF-Pro206,
FVII-Tyr44 - sTF-Pro206,
FVII-Leu39 - sTF-Val207,
FVII-Phe40 - sTF-Val207, y
FVII-Ser43 - sTF-Val207,
En particular al menos uno de los conjuntos de aminoácidos
FVII-Phe40 - sTF-Val207,
FVII-Ser43 - sTF-Pro206,
FVII-Gln64 - sTF-Gly109,
FVII-Glu77 - sTF-Asp58, y
FVII-Phe275 - sTF-Trp45,
se han sustituido por un aminoácido con una cadena lateral reactiva que da lugar a dicha(s) unión(es) directa(s).
9. Complejo según cualquiera de las reivindicaciones precedentes, donde al menos una unión directa está situada entre dos aminoácidos de cisteína.
10. Complejo según cualquiera de las reivindicaciones precedentes, donde al menos una unión directa está formada vía un aminoácido fotorreactivo.
11. Complejo según la reivindicación 10, donde dicho aminoácido fotorreactivo está seleccionado del grupo que consiste en foto-Ile, foto-Leu y foto-Met.
12. Complejo covalente de un polipéptido de factor VII funcionalmente activo y un polipéptido de factor tisular, donde dicho polipéptido de factor VII y dicho polipéptido de factor tisular están vinculados de manera covalente mediante una fracción enlazadora entre cadenas laterales de aminoácidos de uno o más conjuntos de (i) un aminoácido del polipéptido de factor VII y (ii) un aminoácido del polipéptido de factor tisular, donde dicha fracción enlazadora se deriva de un reactivo heterobifuncional.
13. Método para la producción de un complejo de un polipéptido de factor VII funcionalmente activo y un polipéptido de factor tisular tal y como se define en cualquiera de las reivindicaciones 1-12, dicho método comprendiendo a) transfectar una célula con (i) un vector de expresión comprendiendo una molécula de ácido nucleico codificando el polipéptido de factor VII y regiones de control de expresión operativamente vinculadas a ella y (ii) y un vector de expresión comprendiendo una molécula de ácido nucleico codificando el polipéptido de factor tisular y regiones de control de expresión operativamente vinculadas a ella, b) cultivar la célula modificada bajo condiciones para la expresión del polipéptido de factor VII y el polipéptido de factor tisular, y c) aislar el complejo expresado por medios adecuados.
Patentes similares o relacionadas:
Polipéptidos de unión a IL-17A, del 15 de Julio de 2020, de AFFIBODY AB: Polipéptido de unión a IL-17A, que comprende un motivo de unión BM a IL-17A, cuyo motivo consiste en una secuencia de aminoácidos seleccionada […]
Medios mejorados para la expresión de proteínas recombinantes dependientes de vitamina k, del 6 de Mayo de 2020, de CSL Behring Lengnau AG: Un procedimiento para mejorar la actividad de una proteína recombinante dependiente de vitamina K que comprende las siguientes etapas: a) proporcionar […]
Método para purificar y cuantificar la trombina y sus polipéptidos de degradación, del 25 de Marzo de 2020, de OMRIX BIOPHARMACEUTICALS LTD.: Un método cromatográfico de un solo paso para cuantificar α-trombina en una solución que comprende la α-trombina y al menos uno de un polipéptido de degradación […]
Sistemas de expresión específica de hígado optimizados para FVIII y FIX, del 23 de Octubre de 2019, de VRIJE UNIVERSITEIT BRUSSEL: Casete de expresión de ácido nucleico que comprende: - una repetición triple dispuesta en tándem de un elemento regulador de ácido nucleico específico de hígado, consistiendo […]
Direccionamiento de factores de coagulación al TLT-1 en plaquetas activadas, del 23 de Octubre de 2019, de NOVO NORDISK HEALTH CARE AG: Una proteína procoagulante que comprende (i) al menos un factor de coagulación, que es un polipéptido de FVII o un polipéptido de FIX, unido covalentemente […]
Composición y apósito para tratamiento de heridas, del 14 de Agosto de 2019, de Protege Biomedical, LLC: Una composición para la curación de heridas, que comprende: una mezcla sustancialmente homogénea que comprende una cantidad de mullita, en la que la cantidad de mullita es efectiva […]
 Activación de factor X, del 31 de Julio de 2019, de Baxalta Incorporated: Método para activar el factor de coagulación X (FX) que comprende;
a) poner en contacto una disolución acuosa que comprende FX con un material de […]
Activación de factor X, del 31 de Julio de 2019, de Baxalta Incorporated: Método para activar el factor de coagulación X (FX) que comprende;
a) poner en contacto una disolución acuosa que comprende FX con un material de […]
Métodos y composiciones para proteínas del factor IX modificadas, del 19 de Junio de 2019, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Una proteína del Factor IX (FIX) aislada que comprende la secuencia de aminoácidos como se expone en la SEQ ID NO: 3, en donde Xaa es leucina.