FORMULACIONES DE FÁRMACO-LÍPIDO PARA LA ADMINISTRACIÓN DIRIGIDA DE FÁRMACOS A CÉLULAS INMUNES MIELOIDES Y LINFOIDES.
Un complejo lípido-fármaco que comprende un fármaco y que comprende además ligandos directores en una superficie exterior que unen específicamente a la superficie de una célula inmune al menos una combinación de los siguientes marcadores:
CD209 y CD4; o CD209 y CD45R0 en el que dicho fármaco es un agente inmunomodulador que se activa en una célula inmune a la que se dirige dicho o ligando director y en el que dicho ligando director es un anticuerpo monoclonal
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/030578.
Solicitante: RODOS BIOTARGET GMBH.
Nacionalidad solicitante: Alemania.
Dirección: FEODOR-LYNEN-STR. 23 30625 HANNOVER ALEMANIA.
Inventor/es: SCOLARO, MICHAEL, J., SULLIVAN, SEAN, M., GIESELER,Robert,K, MARQUITAN,Guido.
Fecha de Publicación: .
Fecha Solicitud PCT: 17 de Septiembre de 2004.
Clasificación PCT:
- A61K47/48
- A61P31/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos.
Clasificación antigua:
- A61K47/48
- A61P31/00 A61P […] › Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre.
PDF original: ES-2361578_T3.pdf
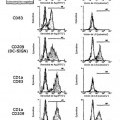


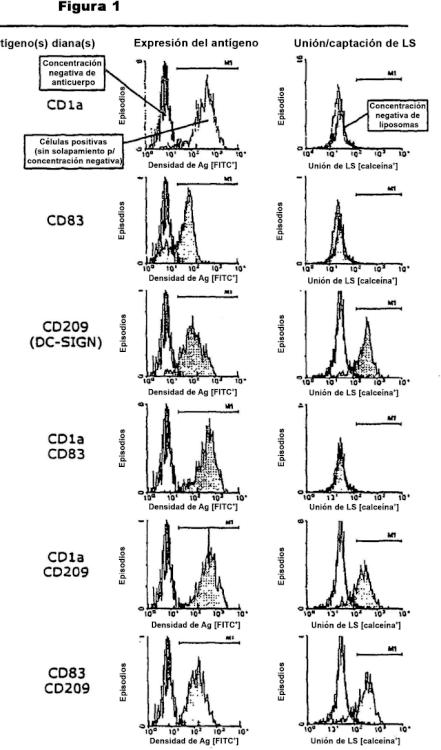
Fragmento de la descripción:
Antecedentes de la invención
1. Campo de la invención
La presente invención se refiere a las artes médicas, y en particular, a la administración dirigida de un fármaco liposomal.
2. Discusión de la técnica relacionada
Las células dendríticas mieloides (My-DC) pertenecen al grupo más potente de células especializadas presentadoras de antígenos, con la capacidad única de inducir respuestas inmunes celulares y humorales primarias (revisado en Banchereau J, Paczesny S, Blanco P, Bennett L, Pascual V, Fay J, Palucka AK, Dendritic cells: controllers of the immune system and a new promise for immunotherapy, Ann N Y Acad Sci 987: 180-7 [2003]). Estás células, que se encuentran en el interior de los órganos y estructuras linfáticos, son también un importante componente del depósito de VIH, junto con otras poblaciones reserva principales, es decir, células dendríticas foliculares, macrófagos, linfocitos T latentes/de recuerdo, y las células del sistema nervioso central. (Por ejemplo, Schrager LK, D'Souza MP, Cellular and anatomical reservoirs of HIV-1 in patients receiving potent antiretroviral combination therapy, JAMA 280: 67-71 [1998]). Es una característica clave de las células de depósito que el VIH las comprometa y aproveche, pero no las mate, llevando de esta manera a la infección continua de otras células inmunes y no inmunes en una persona infectada. (Gieseler RK, Marquitan G, Scolaro MJ, Cohen MD, Lessons from history: dysfunctional APCs, inherent dangers of STI and an important goal, as yet unmet, Trends Immunol. 2003; 24:11).
La generación in vitro de My-DC ha permitido la caracterización fenotípica y funcional comprehensiva de las My-DC y el estudio de la ontogenia de estas células, que se ha encontrado que comparten, con los macrófagos, un progenitor mieloide común temprano (Gieseler RK, Röber RA, Kuhn R, Weber K, Osborn M, Peters JH, Dendritic accessory cells derived from rat bone marrow precursors under chemically defined conditions in vitro belong to the myeloid lineage, Eur J Cell Biol 1991; 54: 171-81; Peters JH, Xu H, Ruppert J, Ostermeier D, Friedrichs D, Gieseler RK, Signals required for differentiating dendritic cells from human monocytes in vitro, Adv Exp Med Biol 1993; 329: 275-80; Peters JH, Gieseler R, Thiele B, Steinbach F, Dendritic cells: from ontogenetic orphans to myelomonocytic descendants, Immunol Today 1996; 17: 273-8; Gieseler R, Heise D, Soruri A, Schwartz P, Peters JH, In-vitro differentiation of mature dendritic cells from human blood monocytes, Dev Immunol 1998; 6: 25-39).
El descubrimiento de la molécula no integrina de captura de la molécula de adhesión intercelular 3 específica de las My-DC (DC-SIGN) en el año 2000 fue un hito de la investigación inmunológica: DC-SIGN, una de las varias lectinas de tipo C, es una molécula DC clave distintiva y juega un papel esencial en la captura y el transporte migratorio del VIH. Además de la infección de linfocitos T debida a la producción de virus activo mediante las My-DC, la interacción entre VIH y DC-SIGN permite eventualmente a las My-DC infectar en trans linfocitos T auxiliares cooperadores. Análogamente, las variantes de DC-SIGN se expresan mediante macrófagos (otro depósito principal de VIH-1) así como mediante algunos tipos celulares mucosales y placentales (Soilleux, EJ y col. Constitutive and induced expression of DC-SIGN on dendritic cell and macrophage subpopulations in situ and in vitro, J Leukoc Biol 71: 44557 [2002]; Geijtenbeek, TBH y col., Marginal zone macrophages express a murine homologue of DC-SIGN that captures blood-borne antigens in vivo, Blood 100: 2908-16 [2002]; Soilleux EJ y col., Placental expression of DCSIGN may mediate intrauterine vertical transmission of HIV, J Pathol. 195(5): 586-92 [2001]; Soilleux EJ, Coleman N, Transplacental transmission of HIV: a potential role for HIV binding lectins, Int J Biochem Cell Biol.; 35(3): 283-7 [2003]; Kämmerer U y col.. Unique appearance of proliferating antigen-presenting cells expressing DC-SIGN (CD209) in the decidua of early human pregnancy, Am J Pathol. 162(3): 887-96 [2003]). Estas leptinas de tipo C se consideran piezas fundamentales en la transmisión horizontal y vertical del VIH en un individuo dado (Geijtenbeek TB, van Kooyk Y, DC-SIGN: a novel HIV receptor on DCs that mediates HIV-1 transmission, Curr Top Microbiol Immunol 276: 31-54 [2003]). In vivo, la DC-SIGN no solo se expresa por las DC mieloides, sino que también por subpoblaciones de macrófagos, que constituyen otro grupo principal de células de depósito de VIH (Soilleux EJ y col., Constitutive and induced expression of DC-SIGN on dendritic cell and macrophage subpopulations in situ and in vitro, J Leukoc Biol. 71(3): 445-57 [2002]).
Se sabe que DC-SIGN es un receptor de adhesión endocítico.
En primer lugar, las partículas unidas a DC-SIGN se transbordan a la ruta de procesamiento y presentación del antígeno MHC de clase II y acceden al mecanismo que genera la inmunidad de los linfocitos T (según sea deseable en el caso de alguna infección vírica), así como, la inmunidad de los linfocitos B (como apoyo en el aclaramiento de virus, mediante mecanismos secundarios para la generación de anticuerpos, tales como la fagocitosis mediada por el receptor Fc o, en el caso de anticuerpos citotóxicos, lisis mediada por el complemento) (por ejemplo, Schjetne KW y col., Mouse C-specific T cell clone indicates that DC-SIGN is an efficient target for antibody-mediated delivery of T cell epitopes for MHC class II presentation, Int Immunol 14(12): 1423-30 [2002]; Engering, A y col., The dendritic cellspecific adhesion receptor DC-SIGN internalizes antigen for presentation to T cells, J Immunol. 168(5): 2118-26 [2002]).
En segundo lugar, Turville y col., demostraron que la infección de células Th mediante las MyDC con VIH-1 es un proceso en dos fases que depende de la etapa de desarrollo de las DC, incluyendo el transporte direccional del virus a la sinapsis inmunológica, así como la síntesis activa de novo de VIH-1 a partir del ADN provírico (Turville SG, Santos JJ, Frank I y col. Immunodeficiency virus uptake, turnover, and two-phase transfer in human dendritic cells, Blood; online publication ahead of print: DOI 10.1182/blood-2003-09-3129 [2003]). Además, los importantes papeles de DC-SIGN en el transporte migratorio del virus mediante las MyDC (Geijtenbeek TBH, van Kooyk Y, DC-SIGN: a novel HIV receptor on DCs that mediates HIV-1 transmission, Curr Top Microbiol Immunol; 276: 31-54 [2003]) y en la infección en trans de los linfocitos T, Cell; 100: 587-97 [2000]), apoyan muchísimo un papel clave patogénico para estas células. Curiosamente, se ha demostrado ahora que la transferencia pasiva de las MyDc a las células Th mediante DC-SIGN requiere en primer lugar que VIH-1 se internalice en compartimentos intracelulares resistentes a la tripsina (McDonald D, Wu L, Bohks SM, KewalRamani VN, Unutmaz D, Hope TJ, Recruitment of HIV and its receptors to dendritic cell-T cell junctions, Science; 300: 1295-7 [2003]; Kwon DS, Gregorio G, Bitton N, Hendrickson WA, Littman DR, DC-SIGN-mediated internalization of HIV is required for trans-enhancement of T cell infection, Immunity;16: 135-44 [2002]). De hecho, tras la infección con VIH-1, son demostrables lo compartimentos intracitoplasmáticos con virus infeccioso acumulado en MyDC inmaduras y maduras (Frank I, Piatak M Jr, Stoessel H, Romani N, Bonnyay D, Lifson JD, Pope M, Infectious and whole inactivated simian immunodeficiency viruses interact similarly with primate dendritic cells (DCs): differential intracellular fate of visions in mature and immature DCs, J Virol; 76: 2936-51 [2002]).
Se ha demostrado que la Terapia Antirretrovírica Muy Activa (HAART) es eficaz para reducir la carga vírica en plasma a niveles indetectables en individuos infectados con VIH y para disminuir marcadamente el número de copias de ARN de VIH-1 en tejidos linfáticos secundarios (Wong, J.K. y col., Recovery of replication-competent HIV despite prolonged suppression of plasma viremia, Science, 278: 1291-1295 [1997]; Cavert, W. y col., Kinetics of response in lymphoid tissues to antirretroviral therapy of HIV-1 infection, Science 276(5314): 960-964 [1997]). Sin embargo, la capacidad de VIH-1 para establecer una infección latente permite a las partículas víricas persistir en tejidos a pesar de las respuestas inmunes y de la terapia antirretrovírica (Gangne J-F, Désormeaux A, Perron S, Tremblay M.J, Bergeron M.G, Targeted delivery of indinavir to HIV-1 primary reservoirs with immunoliposomes, Biochim Biophys Acta, 1558: 198-210 [2002]). Se ha teorizado que la susceptibilidad de las células dendríticas de ser infectadas con VIH, junto... [Seguir leyendo]
Reivindicaciones:
1. Un complejo lípido-fármaco que comprende un fármaco y que comprende además ligandos directores en una superficie exterior que unen específicamente a la superficie de una célula inmune al menos una combinación de los siguientes marcadores:
CD209 y CD4; o CD209 y CD45R0
en el que dicho fármaco es un agente inmunomodulador que se activa en una célula inmune a la que se dirige dicho
o ligando director y en el que dicho ligando director es un anticuerpo monoclonal.
2. El complejo lípido-fármaco de la reivindicación 1 en el que dicho complejo lípido-fármaco es un complejo liposoma-fármaco.
3. El complejo lípido-fármaco de la reivindicación 1 o 2, en el que dicho complejo lípido-fármaco comprende adamas en la superficie externa una proteína A de Staphylococcus aureus adaptada para unirse específicamente a la inmunoglobulina G (lgG).
4. El complejo lípido-fármaco de la reivindicación 3, en el que dicho anticuerpo monoclonal queda específicamente unido por dicha proteína A de Staphylococcus aureus.
5. El complejo lípido-fármaco de una cualquiera de las reivindicaciones 1 a 4, en el que dicho complejo lípidofármaco comprende uno o más fármacos secundarios.
6. El complejo lípido-fármaco de la reivindicación 1, en el que dicho agente inmunomolulador es un inmunosupresor.
7. El complejo lípido-fármaco de la reivindicación 1, en el que dicho agente inmunomolulador es un agente inmunoactivador.
8. El complejo lípido-fármaco de una cualquiera de las reivindicaciones 1 a 7, en el que dicha célula inmune se selecciona entre el grupo que consiste en una célula progenitora mieloide, una célula dendrítica, un monocito, un macrófago y un linfocito T.
9. El complejo lípido-fármaco de la reivindicación 8 en el que dicho linfocito T es un linfocito T de recuerdo.
10. El complejo lípido-fármaco de la reivindicación 8 en el que dicha célula dendrítica se selecciona entre el grupo que consiste en una célula dendrítica mieloide, una célula dendrítica plasmacitoide, y una célula dendrítica folicular.
11. Un procedimiento ex vivo o in vitro para administrar preferentemente un fármaco a una célula de mamífero del tipo seleccionado entre el grupo que consiste en una célula progenitora mieloide, una célula dendrítica, un monocito, un macrófago y un linfocito T, en el que el fármaco se dirige al tipo de célula seleccionado mediante el complejo lípido-fármaco de una cualquiera de las reivindicaciones 1 a 10.
12. El procedimiento in vitro de la reivindicación 11 en el que dicho tipo celular es infectado por un agente infeccioso.
13. El complejo lípido-fármaco de una cualquiera de las reivindicaciones 1 a 10 para su uso para prevenir o tratar una dolencia infecciosa o inmune.
14. El uso del complejo lípido-fármaco de una cualquiera de las reivindicaciones 1 a 10 en la fabricación de un medicamento para prevenir o tratar una infección por un agente infeccioso.
15. El uso de la reivindicación 14 en el que dicho agente infeccioso es un virus, una bacteria, un hongo, un protozoo
o un prión.
16. El uso de la reivindicación 15 en el que dicho virus se selecciona entre el grupo que consiste en VIH, VSH, VEB, CMV, virus Ebola y Marburg, VHA, VHB, VHC y VPH.
17. El uso de la reivindicación 16 en el que dicho virus se selecciona entre el grupo que consiste en VIH-1 y VIH-2.
18. Uso del complejo lípido-fármaco de una cualquiera de las reivindicaciones 1 a 10 en la fabricación de un medicamento para prevenir o tratar una dolencia infecciosa o inmune; opcionalmente una dolencia organoespecífica
o autoinmune sistémica.
19. Uso del complejo lípido-fármaco de una cualquiera de las reivindicaciones 1 a 10 en la fabricación de un medicamento para tratar una proliferación patológica de células inmunes, un cáncer linfoide primario o metastásico o una dolencia autoinmune.
Patentes similares o relacionadas:
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]
GELES DE QUITOSANO(A) CONTENIENDO NANOPARTICULAS METALICAS DE COBRE, PLATA Y ANTIBIOTICOS (CIPROFLOXACINO, CEFOTAXIME, GENTAMICINA Y CLOXACILINA), del 12 de Diciembre de 2019, de CARDENAS Y CIA LTDA: En la presente invención se describen geles de quitosano (poli-beta-glucosamina) con propiedades bactericidas y fungicidas en mezcla con nanopartículas […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Composiciones y métodos para la liberación dirigida de fármacos in vitro e in vivo a células de mamíferos mediante minicélulas intactas derivadas de bacterias, del 23 de Octubre de 2019, de ENGENEIC MOLECULAR DELIVERY PTY LTD: Una composición que comprende: (a) una pluralidad de minicélulas intactas derivadas de bacterias que tienen paredes celulares intactas, en donde la pluralidad […]
Moléculas con semividas prolongadas, composiciones y usos de las mismas, del 16 de Octubre de 2019, de MEDIMMUNE, LLC: Una molécula modificada que comprende una proteína o agente no de proteína y un dominio constante de IgG, en la que el dominio constante de IgG comprende un dominio CH3 humano […]
Método para la preparación de oligo etilenglicol monodisperso, del 19 de Junio de 2019, de NEKTAR THERAPEUTICS: Un método para preparar un oligo (etilenglicol) monodisperso, comprendiendo dicho método: (i) hacer reaccionar un oligo (etilenglicol) terminado […]
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Usos terapéuticos de anticuerpos monoclonales frente al receptor de la angiotensina II tipo 1, del 17 de Mayo de 2019, de QUEEN MARY AND WESTFIELD COLLEGE: Un anticuerpo monoclonal o un fragmento del mismo que se une al péptido que consiste en la secuencia EDGIKRIQDD para su uso en el tratamiento de la proliferación […]