DISOCIACION DE RACEMATOS DE 2,6-TRANS-DIMETILMORFOLINA.
Procedimiento para la obtención de trans-2,6-dimetilmorfolina ópticamente activa mediante (i) reacción con hasta 0,
5 moles de ácido amigdálico ópticamente activo y hasta 0,5 moles de ácido acético por mol de trans-2,6-dimetilmorfolina racémica, (ii) separación de la sal formada a partir de ácido amigdálico ópticamente activo y uno de los enantiómeros de trans-2,6-dimetilmorfolina del otro enantiómero de trans-2,6-dimetilmorfolina, y (iii) aislamiento de la trans-2,6-dimetilmorfolina ópticamente activa deseada
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/069862.
Solicitante: BASF SE.
Nacionalidad solicitante: Alemania.
Dirección: BASF SE GLOBAL INTELLECTUAL PROPERTY GVX - C6,67056 LUDWIGSHAFEN.
Inventor/es: HAESE, FRANK, DITRICH, KLAUS.
Fecha de Publicación: .
Fecha Concesión Europea: 26 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C07D295/027 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 295/00 Compuestos heterocíclicos que contienen ciclos polimetileno-imina de al menos cinco miembros, ciclos aza-3 biciclo [3.2.2] nonano, piperazina, morfolina o tiomorfolina, que tienen solamente átomos de hidrógeno unidos directamente a los átomos de carbono del ciclo. › que no contienen más que un heterociclo.
Clasificación PCT:
- C07D295/02 C07D 295/00 […] › que contienen solamente átomos de hidrógeno y carbono en adición a los heteroelementos del ciclo.
Fragmento de la descripción:
Disociación de racematos de 2,6-trans-dimetilmorfolina.
La presente invención se refiere a un procedimiento para la obtención de trans-2,6-dimetilmorfolina ópticamente activa mediante la reacción de trans-2,6-dimetilmorfolina racémica con ácido amigdálico ópticamente activo en presencia de ácido acético.
Estado de la técnica
Trans-2,6-dimetilmorfolina es un producto intermedio para la síntesis de fungicidas y medicamentos. No obstante, ya que generalmente sólo un enantiómero de trans-2,6-dimetilmorfolina presenta la actividad biológica buscada, es deseable sintetizar trans-2,6-dimetilmorfolina en forma ópticamente activa.
Esto se efectúa, a modo de ejemplo, mediante una costosa síntesis enantioselectiva, como se describe por Licandro et al. (Gazzetta Chimica Italiana 127, 815-817, 1997). En esta se sintetiza (-)-(2R, 6R)-2,6-dimetilmorfolina en una síntesis de nueve etapas a partir de 1,2-propanodiol.
Esta síntesis es muy costosa y prolongada; por consiguiente, existe una gran demanda de métodos de obtención alternativos, que permitan un acceso más económico y más rápido a trans-2,6-dimetilmorfolina ópticamente activa.
Descripción de la invención
La presente invención se refiere a un procedimiento para la obtención de trans-2,6-dimetilmorfolina ópticamente activa mediante (i) reacción con hasta 0,5 moles de ácido amigdálico ópticamente activo y hasta 0,5 moles de ácido acético por mol de trans-2,6-dimetilmorfolina racémica, (ii) separación de la sal formada a partir de ácido amigdálico ópticamente activo y uno de los enantiómeros de trans-2,6-dimetilmorfolina del otro enantiómero de trans-2,6-dimetilmorfolina, y (iii) aislamiento de la trans-2,6-dimetilmorfolina ópticamente activa deseada.
Trans-2,6-dimetilmorfolina racémica se puede aislar también a partir de una mezcla de trans- y cis-2,6-dimetilmorfolina, como es obtenible mediante síntesis conocidas por el especialista, mediante destilación.
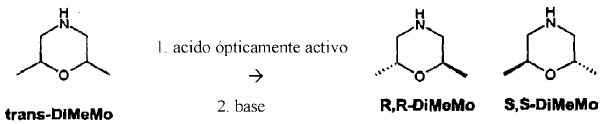
La trans-2,6-dimetilmorfolina racémica se hace reaccionar entonces con ácido amigdálico ópticamente activo. Por mol de trans-2,6-dimetilmorfolina racémica se añaden hasta 0,5 moles de ácido amigdálico ópticamente activo. El ácido amigdálico se puede añadir a la trans-2,6-dimetilmorfolina, o viceversa. Es preferente la disposición de ácido amigdálico y la adición de trans-2,6-dimetilmorfolina racémica.
Con ácido D-amigdálico cristaliza la S,S-trans-2,6-dimetilmorfolina, con ácido L-amigdálico cristaliza la R,R-trans-2,6-dimetilmorfolina. La estructura de la amina cristalizada se determinó por análisis estructural de rayos X.
El acondicionamiento especial del procedimiento según la invención consiste en añadir hasta 0,5 moles de ácido amigdálico ópticamente activo y hasta 0,5 moles de ácido acético por mol de trans-2,6-dimetilmorfolina racémica.
Este modo de proceder tiene la ventaja de que un enantiómero de trans-2,6-dimetilmorfolina con el ácido amigdálico ópticamente activo forma la correspondiente sal, que precipita a partir del medio de reacción, mientras que el otro enantiómero de trans-2,6-dimetilmorfolina queda en disolución junto con el ácido acético. De este modo se pueden separar fácilmente entre sí y aislar los enantiómeros.
La temperatura del procedimiento según la invención no es especialmente crítica. Se puede variar en un amplio intervalo. Es preferente una temperatura entre 0 y 150, de modo especialmente preferente entre 5 y 50ºC. En caso deseado se puede enfriar la mezcla de reacción para descargar los calores de mezcla producido, y/o completar precipitaciones de sales.
La reacción se puede llevar a cabo en muchos disolventes orgánicos de uso común; preferentemente se emplean alcanoles como disolvente. El procedimiento según la invención transcurre con rendimiento especialmente bueno con isopropanol como disolvente.
La separación de la sal producida en el paso (i) se efectúa preferentemente a través de cristalización y filtración de los cristales. Para la aceleración de la cristalización re recomienda añadir algunos cristales de inoculado. Los cristales producidos ya tienen generalmente una pureza óptica elevada, de más de un 70, preferentemente más de un 80% ee. Para conseguir un aumento adicional de la pureza óptica, se pueden recristalizar estas sales. A modo de ejemplo, una recristalización doble de las sales a partir de isopropanol proporciona una pureza óptica de más de un 98% ee.
A partir de la sal se puede liberar la R,R-trans-2,6-dimetilmorfolina ópticamente activa mediante adición de una base, preferentemente hidróxido sódico, y aislar, a modo de ejemplo, mediante destilación en vacío.
La S,S-trans-2,6-dimetilmorfolina ópticamente activa se puede aislar como sal a partir de la disolución de reacción, y liberar igualmente por medio de base.
Bajo condiciones apropiadas se consigue también recuperar el reactivo auxiliar-el ácido amigdálico-empleado para la disociación de racematos en forma ópticamente activa.
Los siguientes ejemplos sirven para la explicación y descripción adicional de la invención.
Parte experimental
A continuación se representa el esquema general del procedimiento según la invención
Disociación de racematos a escala preparativa
a. Precipitación de R-amigdalato
Puesta en práctica
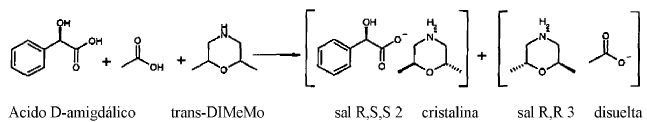
Se dispuso ácido D-amigdálico (330,4 g, 2,714 moles) en isopropanol (2 l), en primer lugar se mezcló con ácido acético (130,4 g, 2,714 moles), y después continuamente gota a gota con trans-2,6-dimetilmorfolina (trans-DiMeMo, 500 g, 4,348 moles). En este caso la temperatura de la mezcla aumentó a 45ºC. La disolución clara se inoculó con sal R,S,S 2, y se dejó reposar durante la noche a temperatura ambiente. Al día siguiente se enfrió la mezcla bajo agitación a 10ºC, y se succionó el residuo precipitado. La S,S-DiMeMo aislada (sal R,S,S 2, 440 g (húmeda), 34%) enlazada presentaba una pureza óptica de un 74% ee. La sal se llevó a ebullición en isopropanol (1 L), se enfrió a temperatura ambiente, y se inoculó con un cristal de sal R,S,S 2. Se dejó reposar de nuevo durante la noche a temperatura ambiente, y se succionó de nuevo al día siguiente. Se obtuvo 350 g (30%, húmedo) de sal R,S,S 2, la S,S-DiMeMo enlazada en la misma presentaba una pureza óptica de un 97,7% ee. La sal se disolvió de nuevo en isopropanol (1 L) en caliente (70ºC), y se dejó reposar durante la noche a temperatura ambiente. De nuevo se inoculó con un cristal de sal R,S,S 2 y se dejó reposar durante la noche. La sal precipitada se succionó y se secó en armario secador. Se obtuvo 266,5 (23%) de sal R,S,S 2, la S,S-DiMeMo enlazada en la misma presentaba una pureza óptica de un 98,3% ee. El punto de fusión de la sal R,S,S 2 se situaba en 134ºC.
La configuración absoluta de la trans-2,6-dimetilmorfolina enlazada en la sal se determinó mediante análisis estructural de rayos X (véase anexo 1). Después precipita preferentemente la S,S-DiMeMo con ácido D-amigdálico.
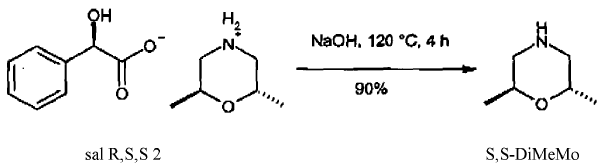
b. Liberación de S,S-2,6-dimetilmorfolina (S,S-DiMeMo) a partir de D-amigdalato (sal R,S,S 2) en medio básico
Realización
Se disolvió el D-amigdalato (sal R,S,S 2, 266,5 g, 1 mol) en hidróxido sódico al 20 % (400 ml), y se agitó una hora a 50ºC. De esto resultó una disolución clara. Se aumentó la temperatura del baño a 120ºC, y se destiló a través de un puente de destilación la S,S-DiMeMo liberada en el azeótropo con agua (transición: 100ºC). Después de haberse transformado aproximadamente 300 ml de condensado se enfrió el depósito de destilación a temperatura ambiente y se acidificó con HCl al 10% . El ácido amigdálico precipitado se succionó y se secó a vacío. Un análisis de la pureza óptica dio por resultado que el ácido D-amigdálico se había racemizado completamente.
El condensado transformado se saturó mediante adición de NaOH sólido; precipitó una fase orgánica, que se diluyó con MTBE (200 ml). Se extrajo con MTBE (2 x 100 ml), se reunieron los extractos, se secaron sobre Na2SO4, y se concentraron por rotación. Se obtuvo 101...
Reivindicaciones:
1. Procedimiento para la obtención de trans-2,6-dimetilmorfolina ópticamente activa mediante (i) reacción con hasta 0,5 moles de ácido amigdálico ópticamente activo y hasta 0,5 moles de ácido acético por mol de trans-2,6-dimetilmorfolina racémica, (ii) separación de la sal formada a partir de ácido amigdálico ópticamente activo y uno de los enantiómeros de trans-2,6-dimetilmorfolina del otro enantiómero de trans-2,6-dimetilmorfolina, y (iii) aislamiento de la trans-2,6-dimetilmorfolina ópticamente activa deseada.
2. Procedimiento según la reivindicación 1, caracterizado porque la separación (ii) se efectúa mediante precipitación de la sal a partir del medio de reacción.
3. Procedimiento según la reivindicación 1, caracterizado porque la reacción se lleva a cabo en isopropanol.
4. Procedimiento según la reivindicación 1-3, caracterizado porque se precipita la S,S-trans-2,6-dimetilmorfolina con ácido D-amigdálico.
5. Procedimiento según la reivindicación 1-3, caracterizado porque se precipita la R,R-trans-2,6-dimetilmorfolina con ácido L-amigdálico.
Patentes similares o relacionadas:
Sal de lisina de ácido 15-hidroxi-8(Z),11(Z),13(E)-eicosatrienoico, del 27 de Febrero de 2019, de DS Biopharma Limited: Una sal de lisina de ácido 15-hidroxi-8(Z),11(Z),13(E)-eicosatrienoico (15-HETrE).
Procedimiento para la preparación de aminas primarias mediante aminación de alcohol bajo catálisis homogénea, del 17 de Junio de 2015, de BASF SE: Procedimiento para la preparación de aminas primarias mediante aminación de alcoholes con amoniaco con eliminación de agua que comprende las etapas (a) reacción bajo […]
Reticulador para vulcanización, un procedimiento para su fabricación, así como un producto de hule fabricado de acuerdo con ello, del 30 de Mayo de 2012, de GRIBOV, IOURII (50.0%): Procedimiento para la fabricación de un reticulador para vulcanización, caracterizado porque un compuesto hidrogenado y heterocíclico se transforma con azufre, eligiéndose el […]
USO DE DERIVADOS DE 1,4-BIS(3-AMINOALQUIL)PIPERAZINA EN EL TRATAMIENTO DE ENFERMEDADES NEURODEGENERATIVAS, del 6 de Febrero de 2012, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM) UNIVERSITE DU DROIT ET DE LA SANTE (LILLE II): Uso de un compuesto de fórmula (I) en la que n y m son idénticos o diferentes, y representan independientemente un número entero superior o igual a 2, comprendiendo […]
DERIVADOS DE 4-FENIL-1-PIPERAZINILO , -PIPERIDINILO Y -TETRAHIDROPIRIDILO., del 1 de Marzo de 2005, de H. LUNDBECK A/S: Un derivado de 4-fenil-1-piperazinilo sustituido de halógeno de fórmula I: **(Fórmula)** en la que W es C, CH o N y la línea de puntos que sale de W indica un enlace […]
PROCEDIMIENTO PARA LA OBTENCION DE FENOXIALQUILAMINAS., del 1 de Junio de 1979, de MERCK PATENT GESELLSCHAFT MIT BESCHRANKTER HAFTUNG: Procedimiento para la obtención de fenoxialquilaminas de fórmula Ar-O-R (I) dónde Ar significa fenilo o fenilo sustituido una o dos veces por F, Cl,. Br, alquilo […]
 DERIVADOS DE 4-FENIL-PIPERAZINIL, -PIPERIDINIL Y TETRAHIDROPIRIDIL COMO ANTAGONISTAS DE DOPAMINA D4, del 1 de Agosto de 2008, de H. LUNDBECK A/S: Un derivado de 4-fenil-1-piperazinilo sustituido de halógeno de fórmula I: (Ver fórmula) * en la que W es C, CH o N y la línea de puntos que sale de W indica un enlace cuando […]
DERIVADOS DE 4-FENIL-PIPERAZINIL, -PIPERIDINIL Y TETRAHIDROPIRIDIL COMO ANTAGONISTAS DE DOPAMINA D4, del 1 de Agosto de 2008, de H. LUNDBECK A/S: Un derivado de 4-fenil-1-piperazinilo sustituido de halógeno de fórmula I: (Ver fórmula) * en la que W es C, CH o N y la línea de puntos que sale de W indica un enlace cuando […]
Compuesto aromático y uso del mismo en el tratamiento de trastornos asociados con el metabolismo óseo, del 15 de Marzo de 2019, de KYOTO PHARMACEUTICAL INDUSTRIES, LTD.: Un compuesto de la fórmula (I) o una sal farmacológicamente aceptable:**Fórmula** en donde cada sustituyente es como se define a continuación […]